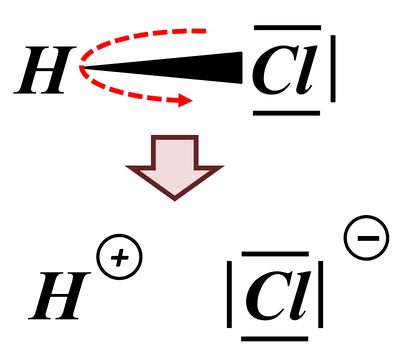
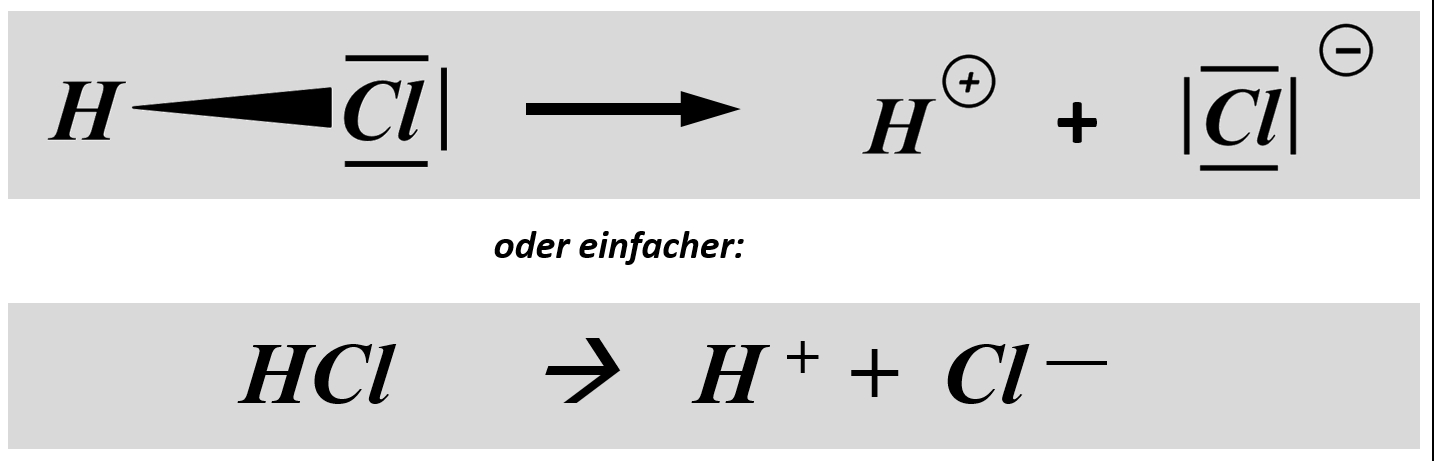
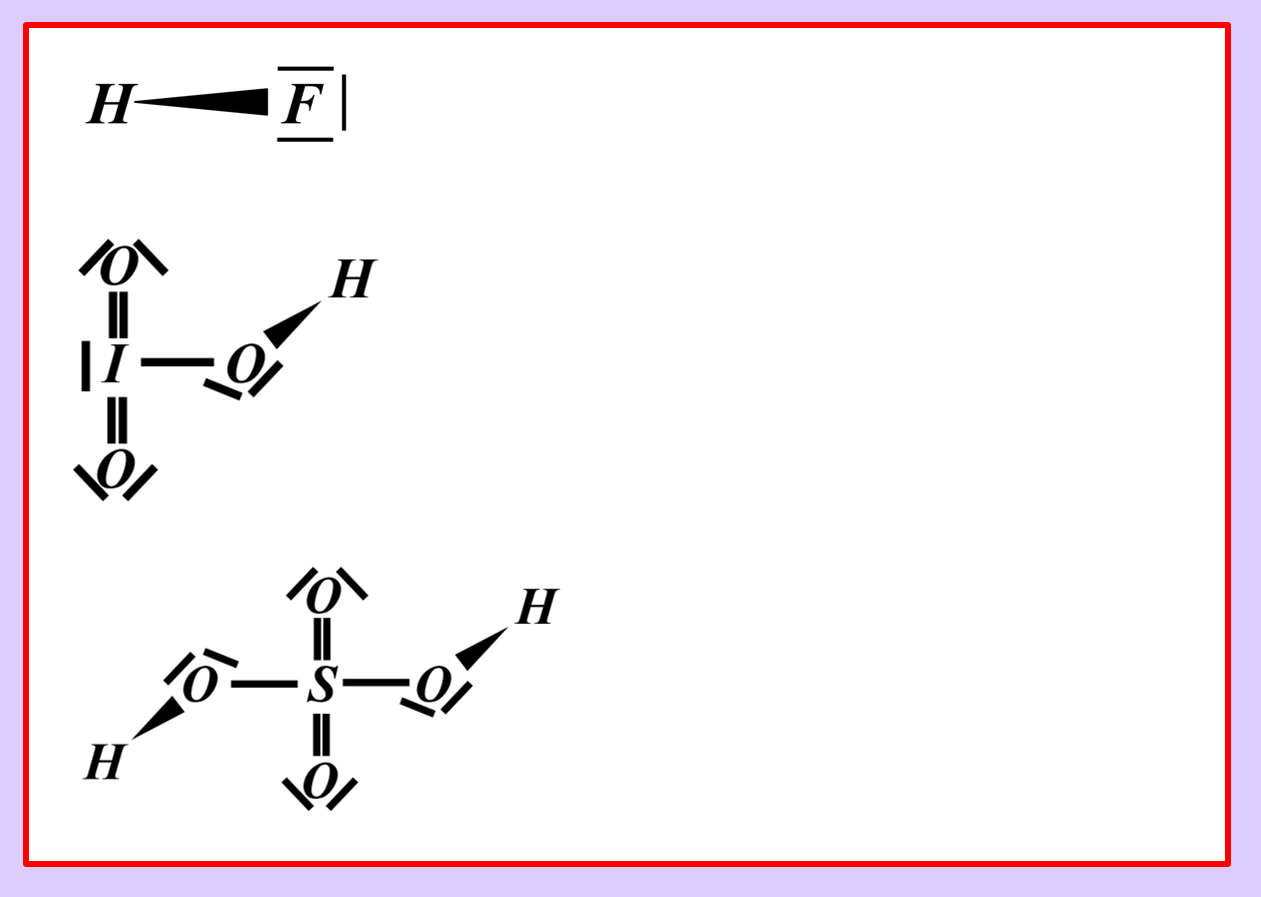
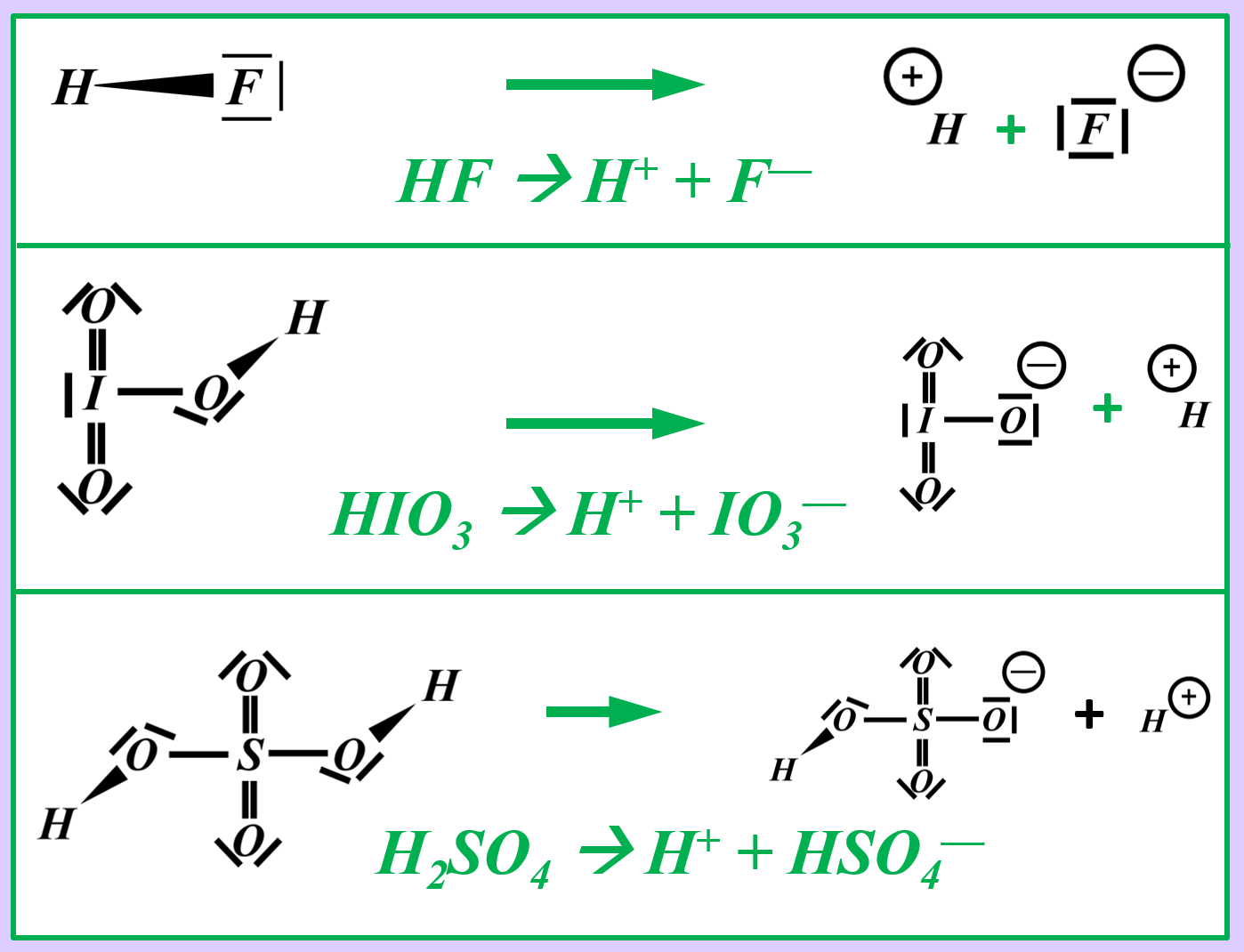
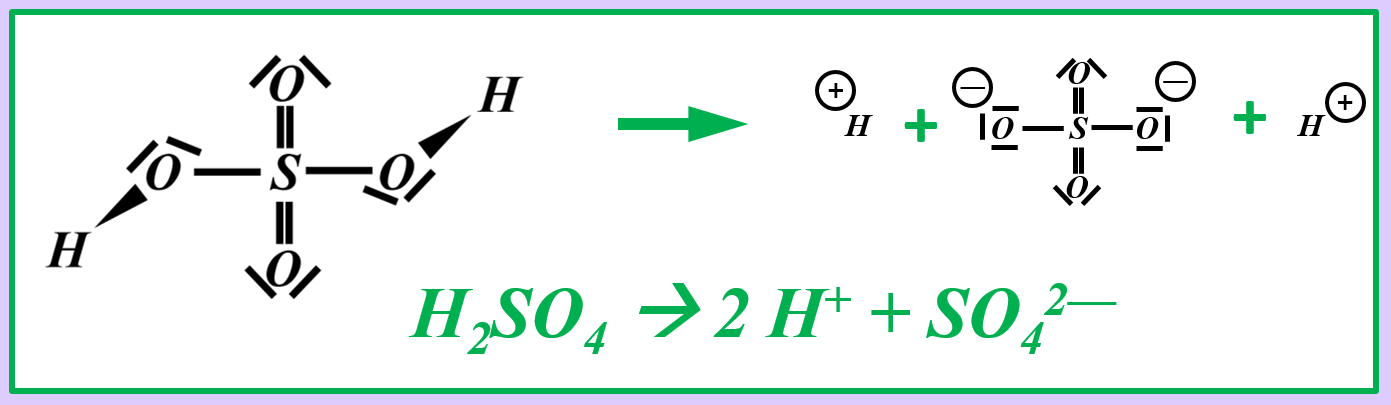
Benutzer:Thomas Lux/Test Q11-Struktur
Aus RMG-Wiki
Distanzunterricht Dienstag, 02.02.
Verbessert gegenseitig eure Hausaufgabe (Buch, S. 42 - Aufgabe 6):
- Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
- Besorgt euch einen Rotstift.
- Macht ein Foto von eurer Hausaufgabe und schickt sie an eure Korrekturpartnerin bzw. euren Korrekturpartner.
- Druckt dann diese Lösungen, die ihr jetzt erhalten habt, aus. (Wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
- Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint/Paint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
- Beachtet dann die unten stehende Musterlösung und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler.
- Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon).
- Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
- Ihr erhaltet ca. um 13:30 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück.
Distanzunterricht Montag, 01.02.
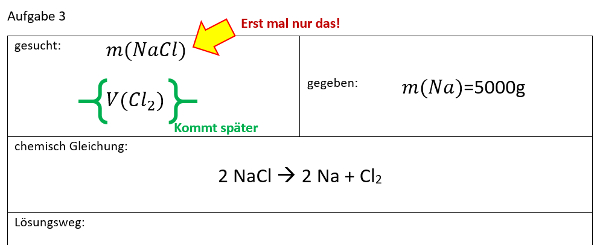
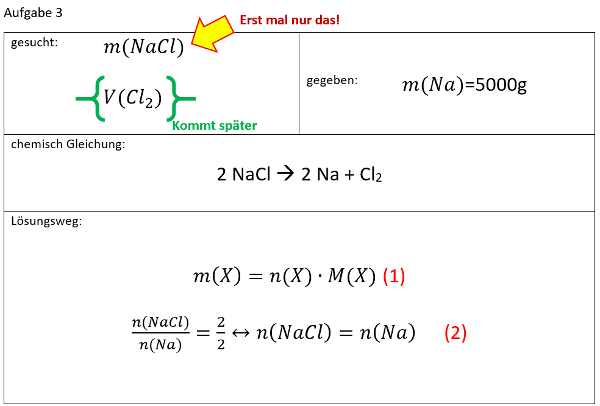
Ihr benötigt euer Buch auf der S. 42. Geht zum Lösen der Aufgabe systematisch vor, wie wir es in den letzten Einheiten immer geübt haben:
- Überlegt zunächst welche Größe gesucht ist!
- Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. NA immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u ma(X) sich jederzeit aus dem Periodensystem "ablesen" lassen)
- Wenn ihr eine passende Gleichung gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um!
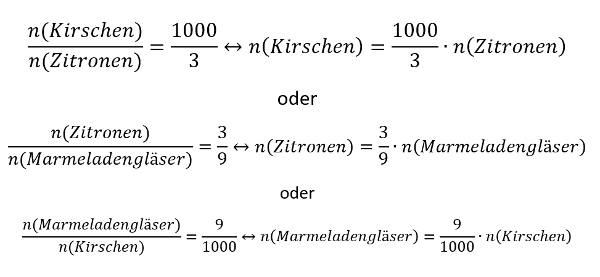
- Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich über die chemische Gleichung das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B).
- Klickt erst auf "Lösung, wenn ihr tatsächlich den Tipp umgesetzt habt und etwas auf dem Papier stehen habt"
Arbeitsauftrag 27.04.
Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.