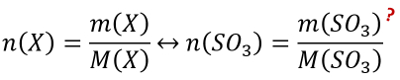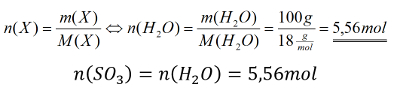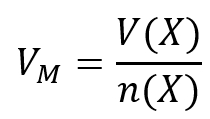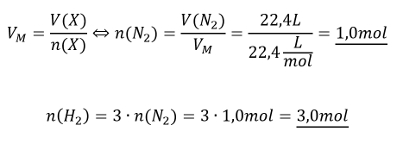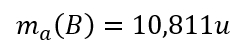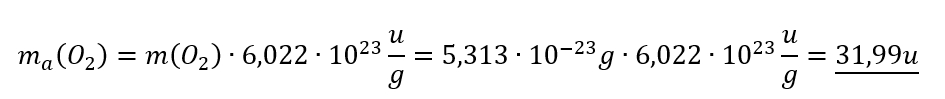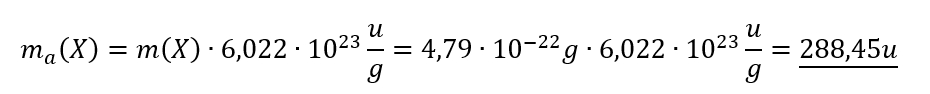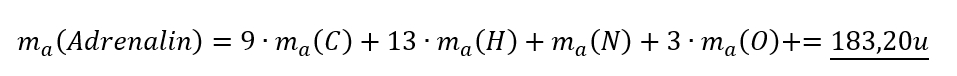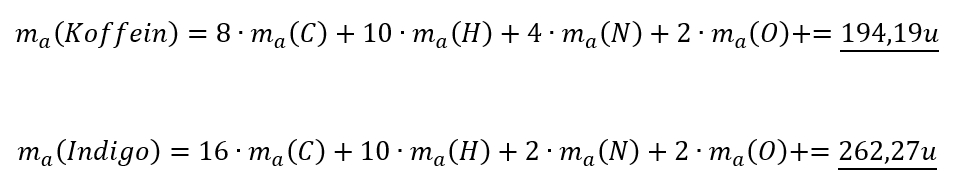9e 2020 21/Chemie: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 66: | Zeile 66: | ||
|Lösung|Lösung ausblenden}}<br> | |Lösung|Lösung ausblenden}}<br> | ||
<br> | <br> | ||
Ich hoffe, die Tipps haben geholfen, die Aufgaben zu lösen. Macht jetzt die '''Aufgabe 6''' ohne Tipps (einer vielleicht: Eisen(III)-chlorid hat die chemische Formel FeCl<sub>3</sub>). | Ich hoffe, die Tipps haben geholfen, die Aufgaben zu lösen. Macht jetzt die '''Aufgabe 6''' ohne Tipps (einer vielleicht: Eisen(III)-chlorid hat die chemische Formel FeCl<sub>3</sub>).<br> | ||
Schreibt bitte sauber und ordentlich, eure Lösung müsst ihr morgen (Dienstag, 02.02.) einem Partner schicken und korrigieren lassen (ähnlich wie letzte Woche). Eine Musterlösung dazu wird morgen hier erscheinen. Ihr selbst müsst dann wieder die Korrektur überprüfen und von der doppelt korrigierten Version schickt ihr mir ein Foto oder eine pdf-Datei. | |||
|Farbe= #607 | |Farbe= #607 | ||
Version vom 1. Februar 2021, 05:09 Uhr
Distanzunterricht im Januar
Distanzunterricht Montag, 01.02.
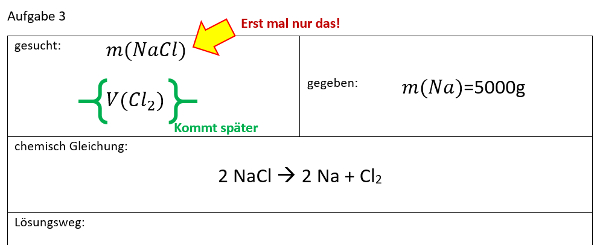
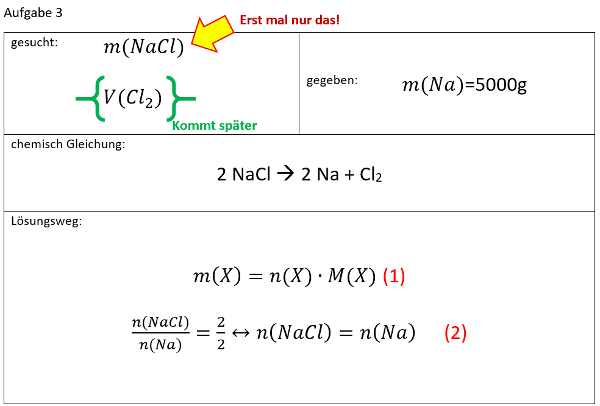
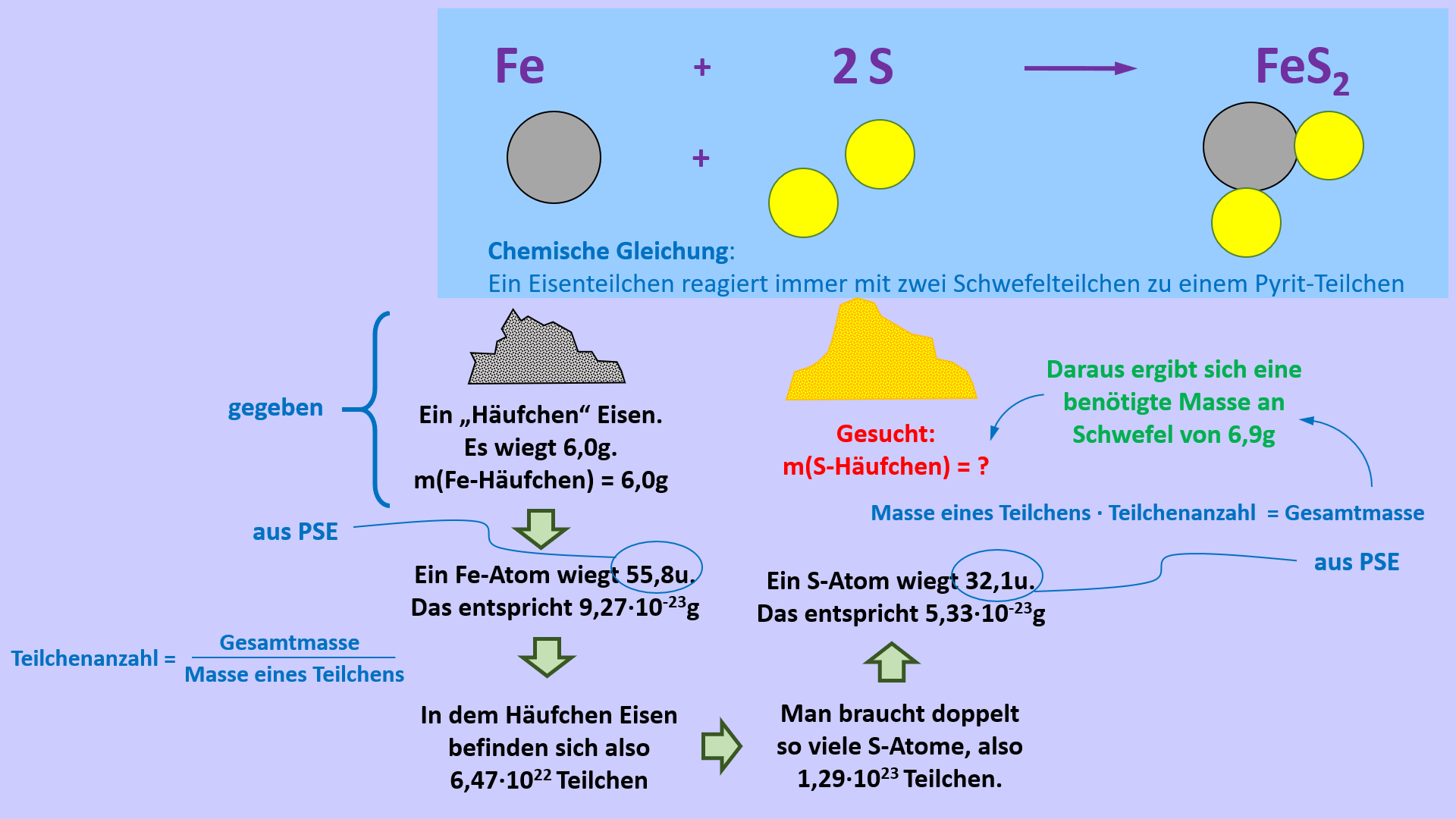
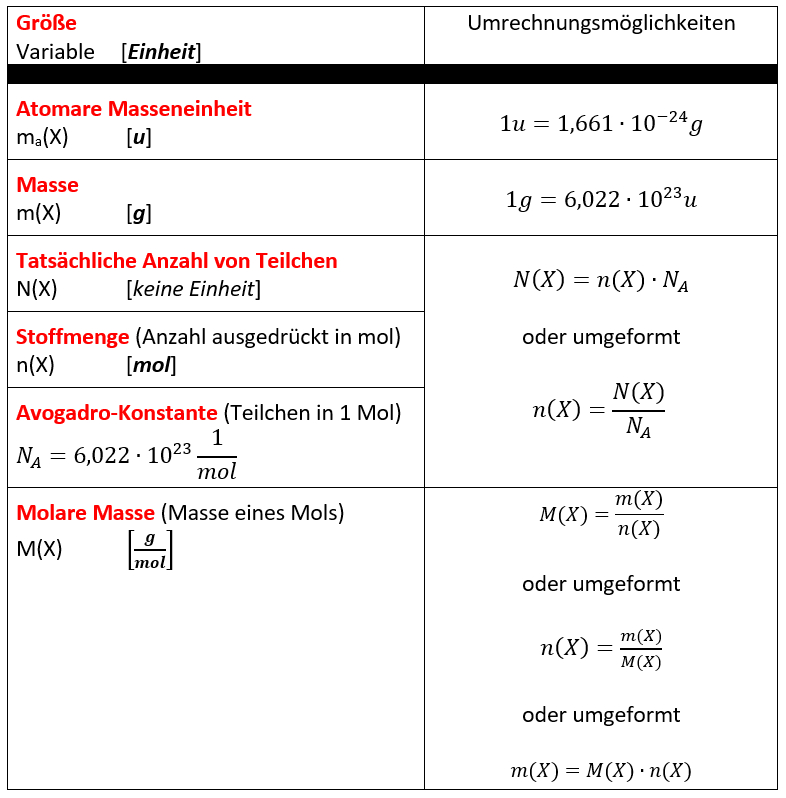
Ihr benötigt euer Buch auf der S. 42. Geht zum Lösen der Aufgabe systematisch vor, wie wir es in den letzten Einheiten immer geübt haben:
- Überlegt zunächst welche Größe gesucht ist!
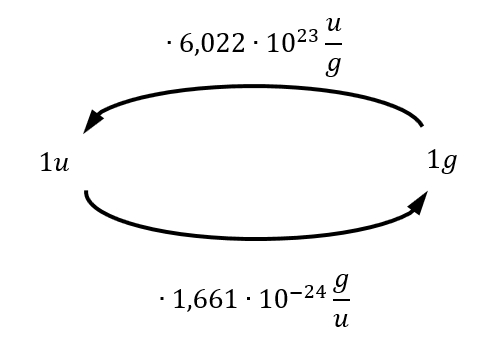
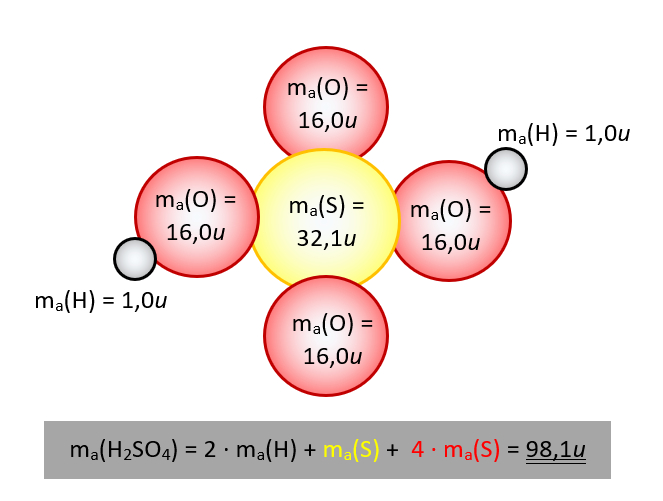
- Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. NA immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u ma(X) sich jederzeit aus dem Periodensystem "ablesen" lassen)
- Wenn ihr eine passende Gleichung gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um!
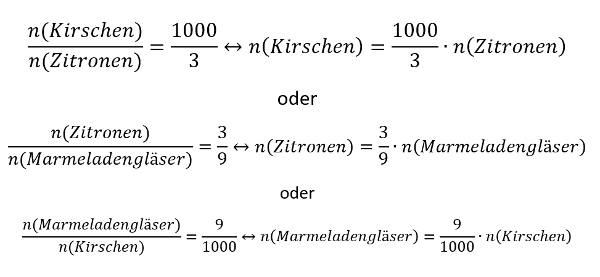
- Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich über die chemische Gleichung das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B).
- Klickt erst auf "Lösung, wenn ihr tatsächlich den Tipp umgesetzt habt und etwas auf dem Papier stehen habt"
Distanzunterricht Donnerstag, 28.01.
Videokonferenz: Rechnen mit molaren Größen
- Aufgaben 1, 2 und 7, 8, 9 auf AB bearbeitet
Distanzunterricht Dienstag, 26.01.
Verbessert gegenseitig eure Hausaufgabe:
- Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
- Besorgt euch einen Rotstift!
- Macht ein Foto von eurer Hausaufgabe (Aufgabe 10 und Aufgabe 12 auf dem AB) und schickt sie an eure Korrekturpartnerin bzw. euren Korrekturpartner!
- Druckt dann die Lösungen, die ihr jetzt erhalten habt aus (wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
- Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
- Geht zunächst auf dieser Seite Schritt für Schritt die Musterlösung durch und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler!
- Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon)
- Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
- Ihr erhaltet um 13:50 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück!
Distanzunterricht Montag, 25.01.
Videokonferenz: Rechnen mit molaren Größen
- Bitte Hausaufgabe bereithalten: Ihr solltet die Aufgaben 1 - 4 auf der zweiten Seite dieses Arbeitsblattes bearbeiten: Hier klicken
- Neuer Unterrichtsstoff: Das molare Volumen (Bereits auf verteiltem Hefteintrag enthalten)
Distanzunterricht Donnerstag, 21.01.
Videokonferenz: Rechnen mit molaren Größen
Distanzunterricht Dienstag, 19.01.
Videokonferenz: Rechnen mit molaren Größen
Distanzunterricht Montag, 18.01.
In den vorangegangenen Einheiten habt ihr einen historischen Einblick in die Probleme erhalten, die sich beim Arbeiten mit der Masse von Stoffportionen ergeben. Für die weiteren Einheiten sind diese historischen Aspekte erst einmal weniger interessant. Wir wollen in den nächsten Einheiten eher dahin kommen, dass in der Lage seid, z.B. folgende Aufgaben zu lösen:
"Ein Auto verbraucht pro hundert gefahrene Kilometer im Durchschnitt 5,0L Benzin. Wie viel Gramm Kohlenstoffdioxid wird auf diesem Weg ausgestoßen."
Bis dahin müssen jedoch noch einige Dinge geklärt werden und wir fangen heute erst einmal mit kleinen Schritten an. Ihr benötigt für diese Einheit einen Stift, Zettel und euer Buch!
Distanzunterricht Donnerstag, 14.01.
Videokonferenz mit Besprechung der Ergebnisse vom Versuch der letzten Einheit.
Distanzunterricht Dienstag, 12.01.
Bitte bearbeitet diese Einheit am besten von 14:00 Uhr bis 14:45 Uhr. Es handelt sich hier um einen kleinen "Versuch". Das Ergebnis eures Versuchs sollt ihr alle in ein einziges Dokument schreiben, damit man eure Ergebnisse vergleichen kann. Dies funktioniert am besten über ein Padlet: Das ist ein Online-Dokument, in das viele Nutzer auch gleichzeitig Sachen eintragen können. Ihr erhalten über den Schulmanager am Dienstag gegen 13:45 Uhr einen Arbeitsauftrag, in dem der Link zu diesem Padlet enthalten ist.
Sollte der Schulmanager heute nachmittag (Dienstag, 12.01.) immer noch nicht funktionieren, dann erhaltet ihr hier eine .pdf-Datei, in der ein Link zu einer Excel-Tabelle verfügbar ist, in die ihr eure Werte eintragen könnt. Direkt ins Netz möchte ich diesen Link nicht stellen, da hier die Gefahr der unerlaubten Verwendung zu groß ist.
Arbeitsauftrag für Montag, 11.01.
Bitte bearbeitet von 09:45 Uhr bis 10:10 Uhr die folgenden Aufgaben. Ihr benötigt dazu euer Schulbuch! Um 10:15 Uhr starten wir eine Konferenz, um die gestellten Aufgaben zu verbessern! (Den Link für die Konferenz habt ihr per Schulmanager bekommen)
Distanzlernen vor Weihnachten
Arbeitsauftrag für Donnerstag, 17.12.
Termine
Versuchsprotokolle
Grundwissen