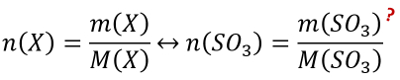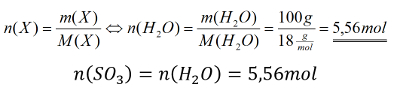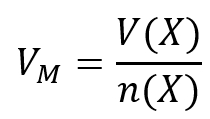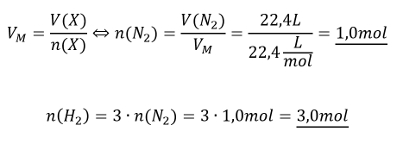Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
=== Distanzunterricht Montag, 01.02.=== | |||
Ihr benötigt das Arbeitsblatt mit den Aufgaben (doppelseitig, links: Aufgaben 1 - 9, rechts: Aufgaben 10 - 17). Versucht heute die Aufgaben 7 - 9 (lins) zu lösen. Diese sind eher mittel - schwer. Gebt trotzdem nicht gleich auf, sondern geht systematisch vor, wie wir es in den letzten Einheiten immer geübt haben: | |||
* Überlegt zunächst welche Größe gesucht ist! | |||
* Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. N<sub>A</sub> immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u m<sub>a</sub>(X) sich jederzeit aus dem Periodensystem "ablesen" lassen) | |||
* Wenn ihr eine passende Gleichung gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um! | |||
* Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich über die chemische Gleichung das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B). | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Tipps zur Lösung'''</span> | |||
|Inhalt= | |||
'''Aufgabe 7:''' <br> | |||
Ammoniak wird mit einem speziellen Gerät untersucht. Die Analyse ergibt ein Massenverhältnis von Stickstoff : Wasserstoff = 4,66 : 1. Berechne daraus das Atomzahlenverhältnis und leite die chemische Formel von Ammoniak ab!<br> | |||
<br> | |||
''Hinweis: Diese Aufgabenstellung wirkt vielleicht etwas seltsam. Denn die chemische Formel von Ammoniak solltet ihr ja schon wissen: NH<sub>3</sub>. Trotzdem ist sie in gewisser Weise realistisch. Denn genau so wird auch heute noch in der Chemie gearbeitet, wenn man eine unbekannte Substanz entdeckt (z.B. aus neu entdeckten Pflanzen, Tieren oder Pilzen), um sie als Medikament o.ä. einzusetzen: Man bestimmt das Massenverhältnis aller enthaltenen Elemente und daraus kann man die chemische Gleichung des unbekannten Stoffs ableiten.'' <br> | |||
''Außerdem gibt es hier zwei Wege, um zum Ziel zu kommen. Hier zunächst mal die erste Variante, später noch eine zweite.''<br> | |||
Bitte klickt erst auf "Lösung", wenn ihr den Tipp wirklich selbst versucht habt, umzusetzen.<br> | |||
<br> | |||
'''Tipp 1:''' Hier wird das Atomzahlen- '''Verhältnis''' verlangt. Zunächst mal: Ein "Verhältnis" kennt ihr vielleicht von Fußball-Tabellen, wenn es ums Tor-Verhältnis geht (aktuell am 30.01.2021 liebt bei Bayern ein Torverhältnis von 53:25 vor) . Oder vielleicht auch von manchen "Rezepten": Beim Reiskochen nimmt man z.B. (bei bestimmten Sorten) 1 Teil Reis und 1,5 Teile Wasser, das entspricht dem Verhältnis 1:1,5. In den Naturwissenschaften schreibt man Verhältnisse aber nicht mit Doppelpunkt (was eigentlich für "pro" steht), sondern mit einem Bruchstrich!<br> | |||
O.k., wir brauchen also einen Bruchstrich, auf dem im Zähler eine Anzahl von Atomen und im Nenner eine Anzahl von Atomen steht. Suche nach der Größe, mit der man in der Chemie eine Anzahl (ohne Einheit) ausdrückt und formuliere dann den "Bruchstrich"!<br> | |||
Überlegt euch auch schon mal Gleichungen, die helfen könnten und gegebene Größen! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S1.jpg]]<br> | |||
Den Bruchstrich solltet ihr mit dem Tipp aufgestellt haben können! Nochmal in Worten: Man sucht das Verhältnis der Anzahl von den Stickstoffatomen zur Anzahl der Wasserstoffatome. <br> | |||
Gegeben sind: | |||
* Die Molare Masse M(X) - kann man aus dem PSE ableiten | |||
* Das Massenverhältnis von Stickstoff zu Wasserstoff | |||
* Eine Gleichung in der N(X) vorkommt. - Die braucht man auf jeden Fall, denn das muss man ja ausrechnen! | |||
* Die zweite Gleichung habt ihr vielleicht noch nicht für nötig erachtet, aber wenn ihr die erste Gleichung anschaut seht ihr, dass diese nur die Stoffmenge n(X) und eine Konstante N<sub>A</sub> enthält. Die Konstante ist nicht das Problem. Aber n(X)! Das hat man nicht gegeben. Daher muss man nach einer Gleichung suchen, mit der man n(X) ausrechnen kann, mit Größen, die man hat. Die zweite Gleichung erfüllt diese Bedingungen. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 2:''' '''Sowohl im Zähler''' als '''auch im Nenner''' des gesuchten Bruchs könnt ihr jetzt N mit Hilfe der 1. Gleichung ausdrücken. Macht das! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S2.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 3:''' Die Stoffmenge n(N) bzw. n(H) ist aus der Angaben leider nicht ableitbar. Aber man kann n(X) ja mit Hilfe der zweiten Gleichung durch m(X) / M(X) ersetzen. Macht das! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S3.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
<br>'''Tipp 4:''' Die Masse m(X) von Stickstoff und Wasserstoff hat man zwar eigentlich auch nicht genau gegeben, aber das Verhältnis! Das genügt, denn die bisher erarbeitete Gleichung verlangt ja nach einer Masse im Zähler und einer im Nenner, daher darf man das gegebenen Verhältnis verwenden. Macht das und berechnet ein Ergebnis und zwar Zähler und Nenner getrennt! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S3.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 5:''' Was bedeutet dieses Ergebnis jetzt für die Zusammensetzung eines Ammoniak-Moleküls? | |||
{{Lösung versteckt| | |||
Die Lösung zeigt, dass im Stoff Ammoniak pro einem N-Atom drei H-Atome enthalten sind. Das bedeutet die chemische Formel könnte sein NH<sub>3</sub>, aber auch N<sub>2</sub>H<sub>6</sub> oder N<sub>3</sub>H<sub>9</sub> usw....<br> | |||
Die Aufgabe war nicht so schön. Die nächste wird besser! | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
'''Aufgabe 12:''' Im Labor soll Ammoniak aus den Elementen hergestellte werden (also aus H<sub>2</sub> und N<sub>2</sub>). Es gibt noch exakt 22,4L Stickstoff. Welche Stoffmenge an Wasserstoff benötigt man, um den gesamten Stickstoff zu Ammoniak umzusetzen.<br> | |||
<br>'''Tipp 1:''' Es geht hier um die Stoffmenge. Darüber hinaus ist ein Volumen gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A12_S1.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 2:''' Direkt lässt sich die Stoffmenge von Wasserstoff mit dieser Gleichung nicht berechnen, es fehlt das Volumen, V(H<sub>2</sub>). Aber wie immer kann über die chemische Gleichung die Stoffmengen der beteiligten Stoffe in Beziehung zueinander setzen. Stelle die chemische Gleichung auf und drücke dann die Stoffmenge des benötigten Wasserstoffs in der Stoffmenge des Stickstoffs aus! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A12_S2.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 3:''' Jetzt kann die Stoffmenge des Stickstoffs ausgerechnet werden und daraus die Stoffmenge des benötigten Wasserstoffs! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A12_S3.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Arbeitsauftrag 27.04. == | == Arbeitsauftrag 27.04. == | ||
Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.<br> | Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.<br> | ||
Version vom 30. Januar 2021, 12:03 Uhr
Distanzunterricht Montag, 01.02.
Ihr benötigt das Arbeitsblatt mit den Aufgaben (doppelseitig, links: Aufgaben 1 - 9, rechts: Aufgaben 10 - 17). Versucht heute die Aufgaben 7 - 9 (lins) zu lösen. Diese sind eher mittel - schwer. Gebt trotzdem nicht gleich auf, sondern geht systematisch vor, wie wir es in den letzten Einheiten immer geübt haben:
- Überlegt zunächst welche Größe gesucht ist!
- Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. NA immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u ma(X) sich jederzeit aus dem Periodensystem "ablesen" lassen)
- Wenn ihr eine passende Gleichung gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um!
- Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich über die chemische Gleichung das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B).
Arbeitsauftrag 27.04.
Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.