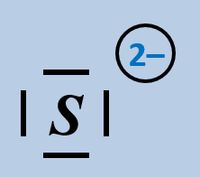Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
(AA f 25.05. angefangen) Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 19: | Zeile 19: | ||
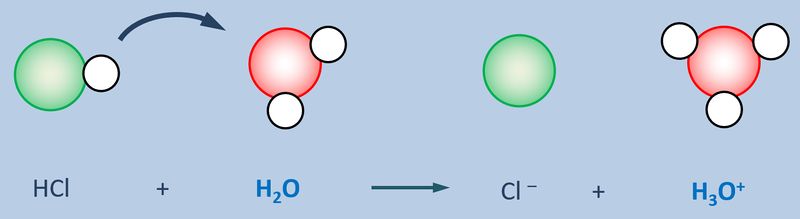
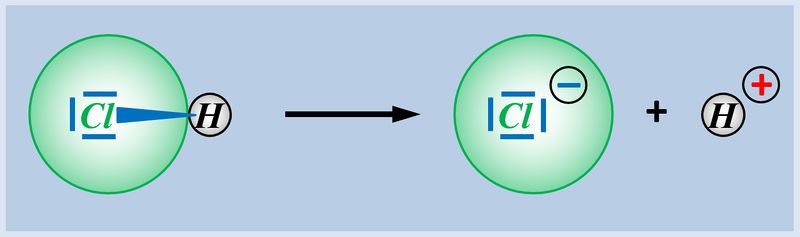
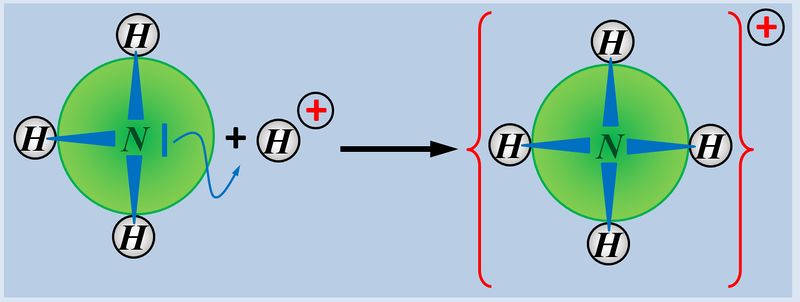
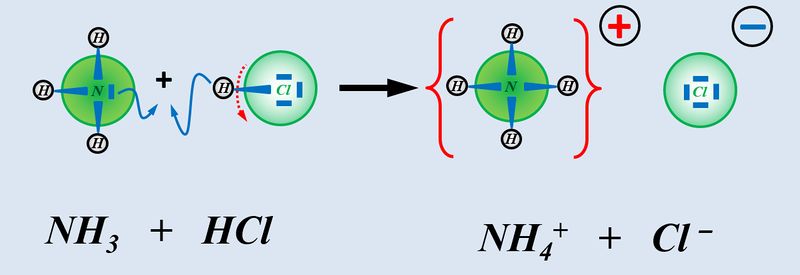
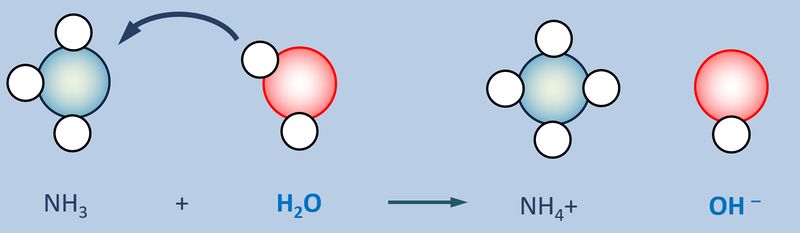
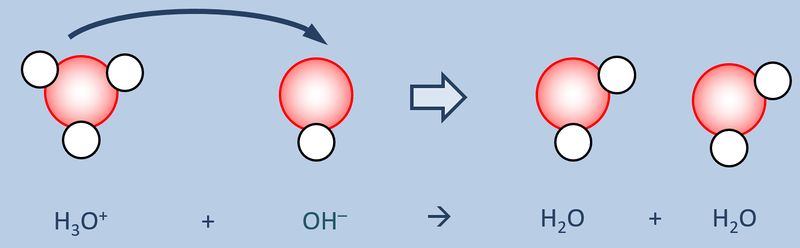
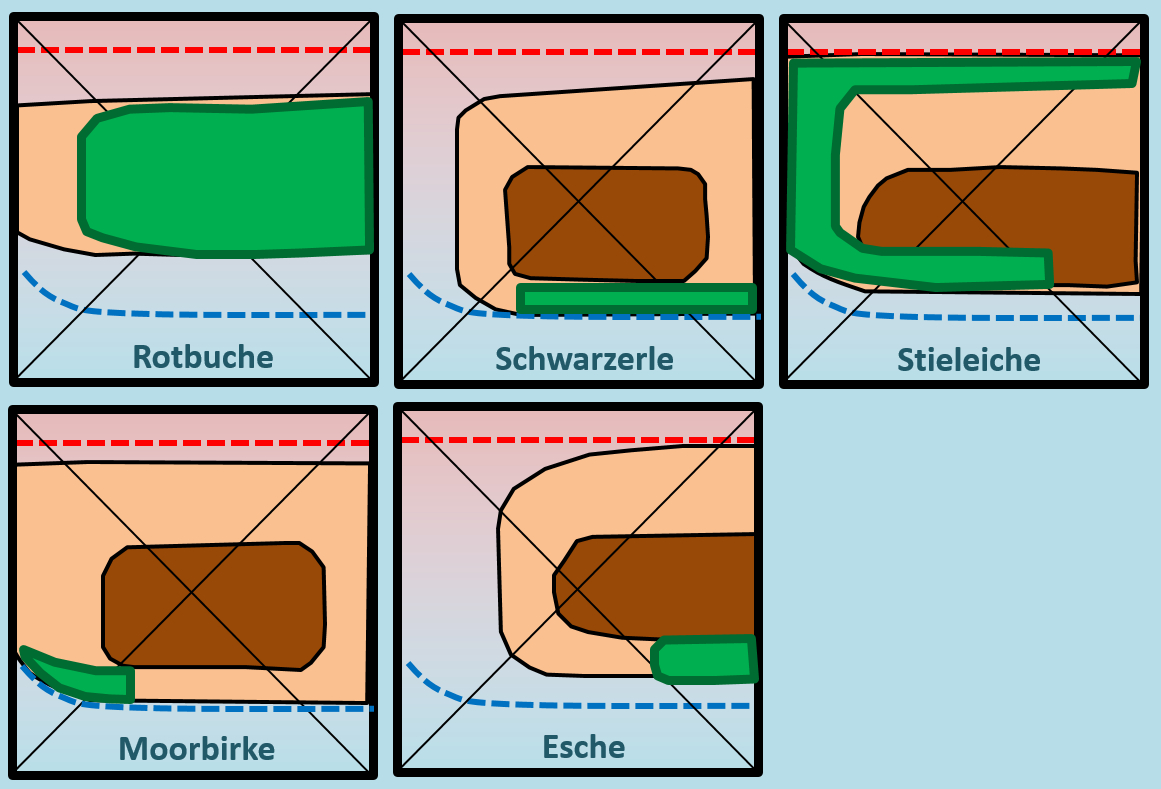
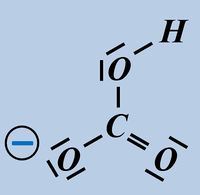
Nun zählt man die Elektronen, die jedem Atom auf diese Weise zugeordnet wurden und vergleicht diese Anzahl mit der Anzahl an Valenzelektronen, die dieses Atom laut PSE haben sollte. Liegen mehr Elektronen vor als "normal" entspricht die überschüssige Anzahl einer negativen Ladung, liegen weniger Elektronen vor, entspricht die fehlende Anzahl einer positiven Ladung. Man spricht allerdings nicht von einer "Ladung", sondern von der Oxidationszahl, die in der Schule üblicherweise als römische Ziffer angegeben wird (mit dem entsprechenden Vorzeichen). Bsp.: Sulfit-Ion<br> | Nun zählt man die Elektronen, die jedem Atom auf diese Weise zugeordnet wurden und vergleicht diese Anzahl mit der Anzahl an Valenzelektronen, die dieses Atom laut PSE haben sollte. Liegen mehr Elektronen vor als "normal" entspricht die überschüssige Anzahl einer negativen Ladung, liegen weniger Elektronen vor, entspricht die fehlende Anzahl einer positiven Ladung. Man spricht allerdings nicht von einer "Ladung", sondern von der Oxidationszahl, die in der Schule üblicherweise als römische Ziffer angegeben wird (mit dem entsprechenden Vorzeichen). Bsp.: Sulfit-Ion<br> | ||
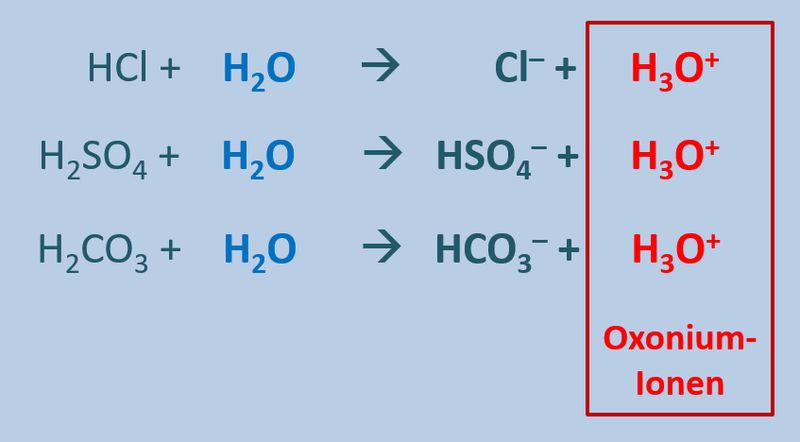
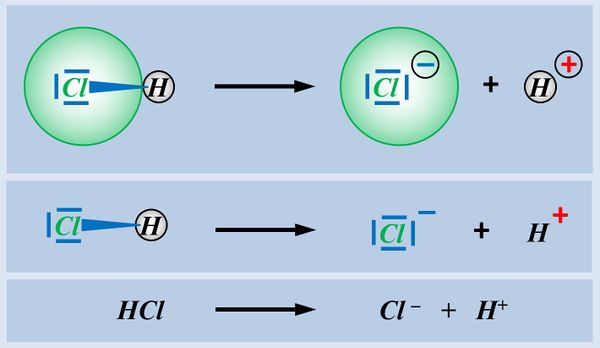
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | [[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | ||
Wendet dieses Verfahren auf das Sulfat-Teilchen an: | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | <br> | ||
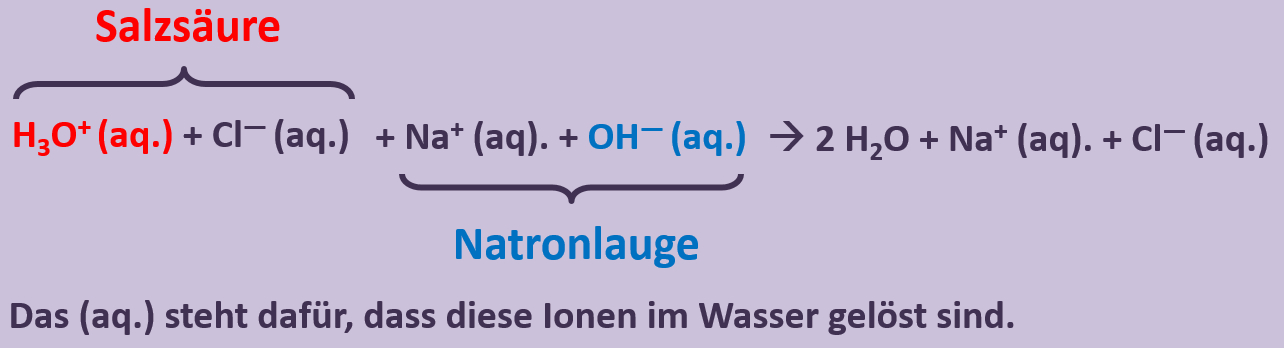
Vergleicht nun Sulfit mit Sulfat. Jetzt kann man besser erkennen, woher die Elektronen für die Reduktion von Mn<sup>7+</sup>-Ionen zu Mn<sup>6+</sup>-Ionen gekommen sind! | |||
<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
Manche von euch werden jetzt sagen: "Ja gut... aber woher kommt denn das vierte Sauerstoff-Atom beim Sulfat?<br> | |||
<br> | |||
Sehr gute Frage! - Das ist aber eine andere Baustelle. Wir bleiben heute nur bei dem Problem: Woran erkennt man, wie viele Elektronen bei der Reaktion von Molekülen frei werden (Oxidation) oder aufgenommen werden (Reduktion).<br> | |||
Wendet das heute gelernte Verfahren auf folgende Reaktion an und gebt an, wie viele Elektronen hier frei werden oder aufgenommen werden! <br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 67: | Zeile 47: | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
In eurem Buch ist die Bestimmung der Oxidationszahlen völlig anders erklärt. Das hat Gründe. Ich möchte, dass ihr die Seiten 74 - 75 lest und die Aufgabe 1 a+b und die Aufgabe 2 a+c löst. Schickt mir eure Lösung bitte über den Schulmanager! | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
== Arbeitsauftrag Chemie für den 11.05. == | == Arbeitsauftrag Chemie für den 11.05. == | ||