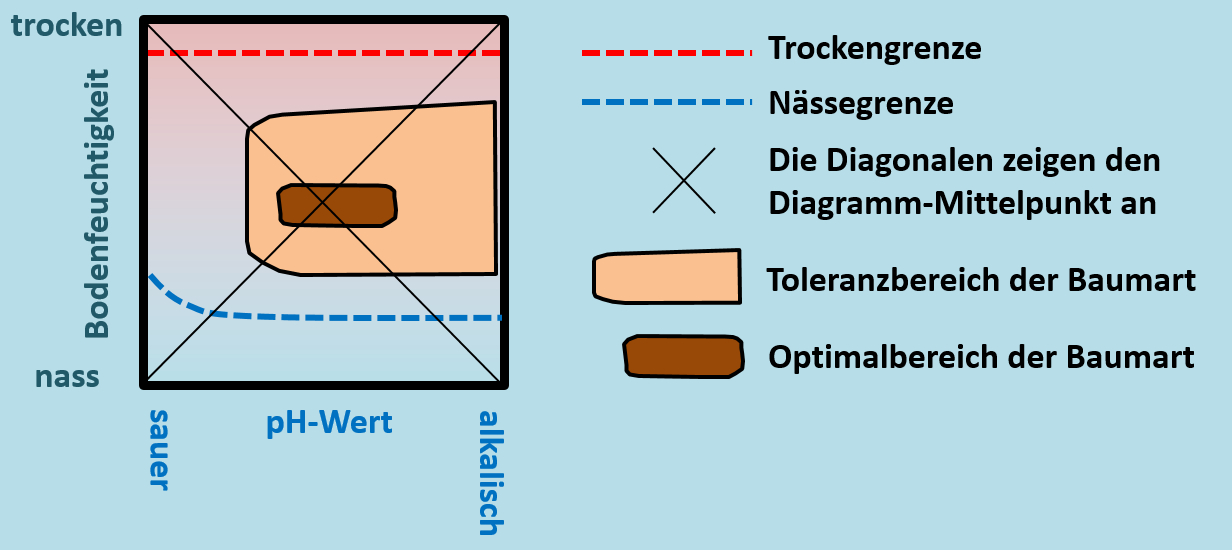
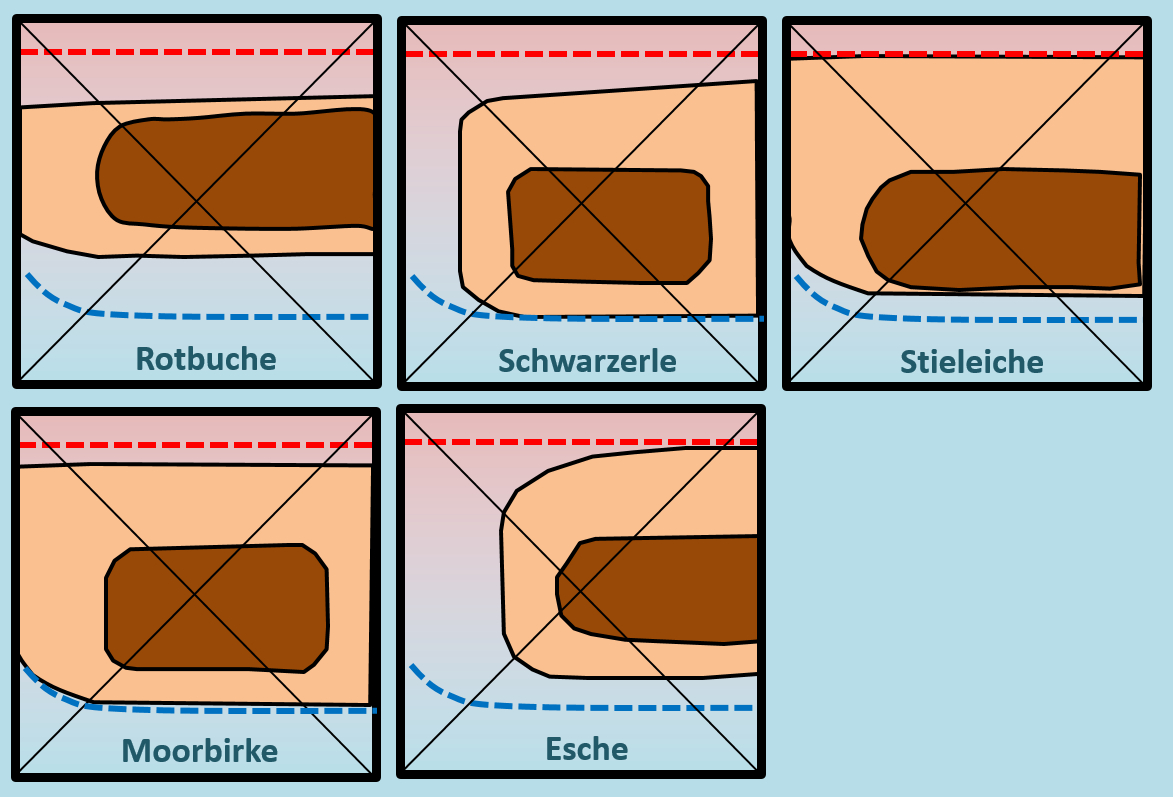
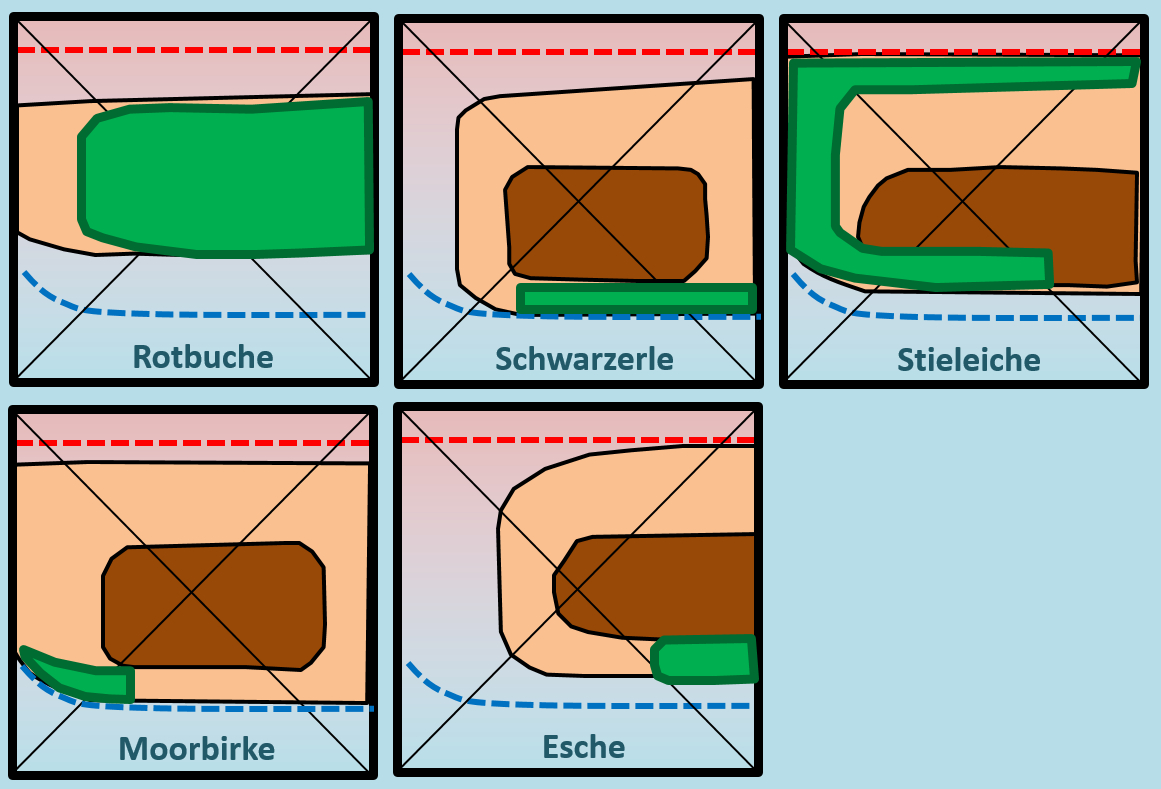
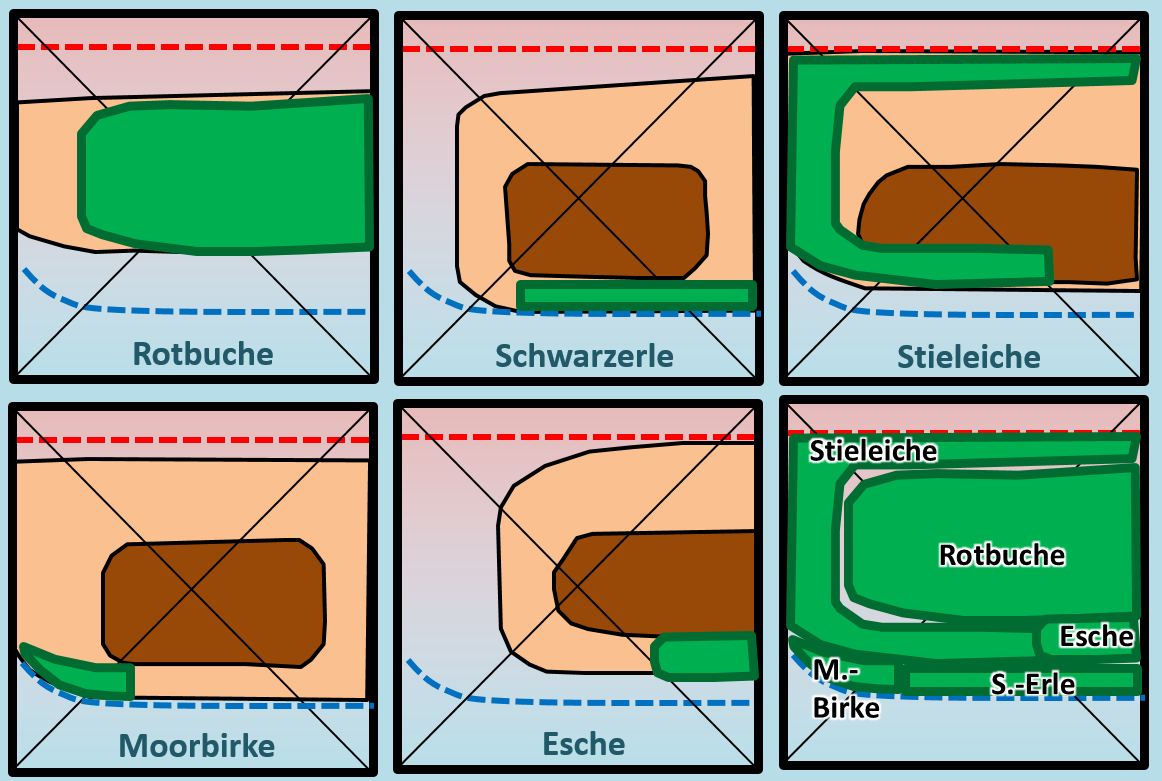
Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
(weiter) Markierung: Quelltext-Bearbeitung 2017 |
(weiter) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 56: | Zeile 56: | ||
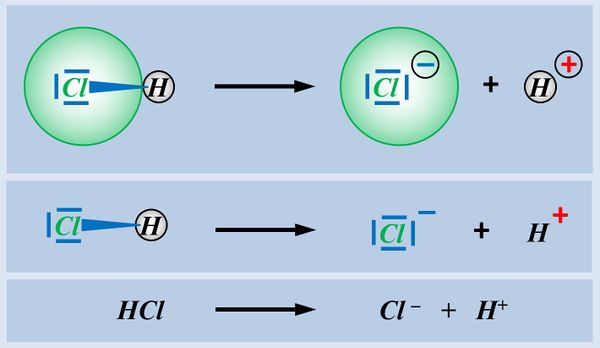
Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''. | Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''. | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 63: | Zeile 64: | ||
<br> | <br> | ||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Der Einfluss des Wassers'''</span> | |||
|Inhalt= | |||
Diese Eigenschaft von Wasser führt dazu, dass beim Zugeben von '''Säuren '''(egal welcher) zu Wasser '''saure Lösungen''' entstehen, die alle eine Gemeinsamkeit haben: Sie enthalten das Oxonium-Ion H<sub>3</sub>O<sup>+</sup>:<br> | |||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | |||
<br> | |||
Ähnliches gilt für Basen. Egal welche Basen man in Wasser gibt, es entstehen immer eine basische Lösungen, die das Hydroxid-Ion enthalten OH<sup>-</sup>:<br> | |||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | |||
<br> | |||
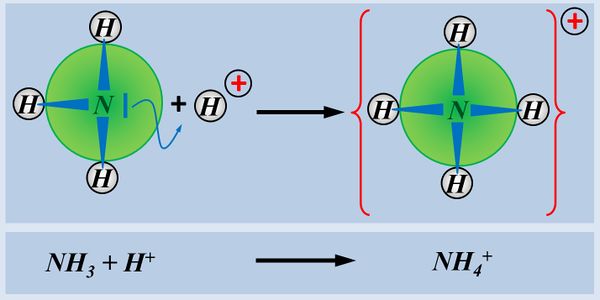
Allerdings gibt es noch eine andere Stoffgruppe, die zu basischen Lösungen führt, in denen OH<sup>-</sup>-Ionen enthalten sind: Nämlich Hydroxid-Salze, wie z.B. NaOH oder KOH oder Ca(OH)<sub>2</sub>. All diese Salze lösen sich in Wasser und setzen dabei Hydroxid-Ionen frei, ohne dass eine chemische Reaktion mit Wasser stattfinden müsste. Das Ergebnis ist aber ein ähnliches wie mit NH<sub>3</sub>, es entsteht eine basische Lösung, die Hydroxid-Ionen enthält:<br> | |||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | |||
<br> | |||
Schüttet man nun eine saure Lösung und eine basische Lösung zusammen, so reagieren eigentlich nicht die Säure und die Base direkt miteinander, sondern die bereits vorher durch den Kontakt mit Wasser gebildeten Oxonium-Ionen H<sub>3</sub>O<sup>+</sup> mit den Hydroxid-Ionen OH<sup>-</sup>:<br> | |||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | |||
<br> | |||
Diese Reaktion führ zu einer Verringerung der Oxonium- bzw. Hydroxid-Ionen, die für den sauren bzw. basischen Charakter verantwortlich waren. Die entstehende Lösung ist also weder sauer noch basisch sondern neutral. '''Man kann also sagen, Säuren und Basen neutralisieren sich gegenseitig.''' | |||
{{Lösung versteckt| | |||
Es hat ein Proton aufgenommen. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Basen. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Jetzt zur unteren Gleichung: Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton abgegeben. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Säuren. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
== Arbeitsauftrag Bio9 == | == Arbeitsauftrag Bio9 == | ||