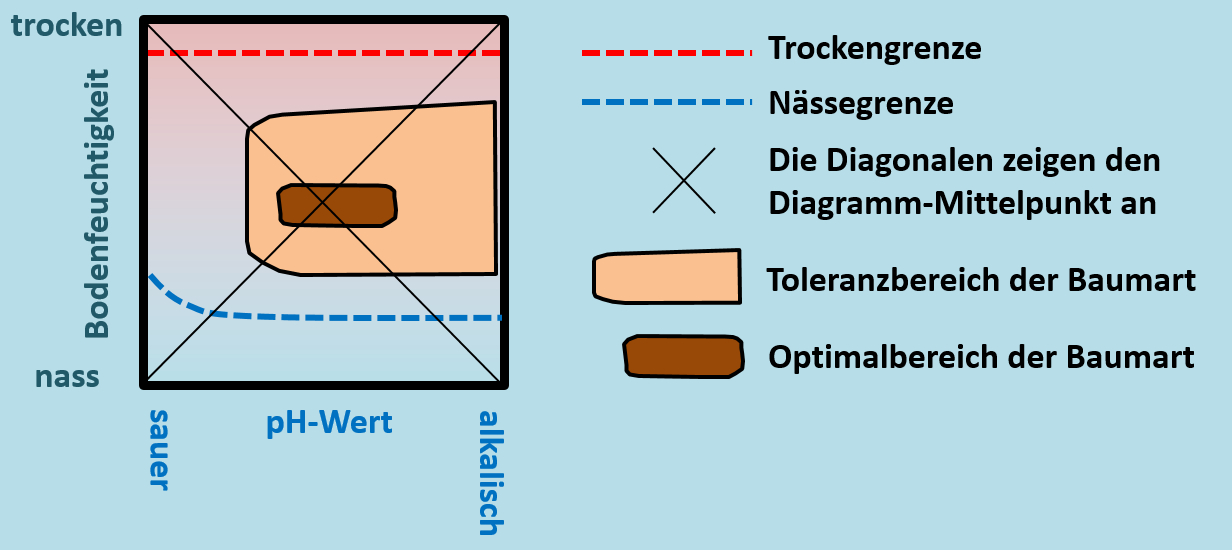
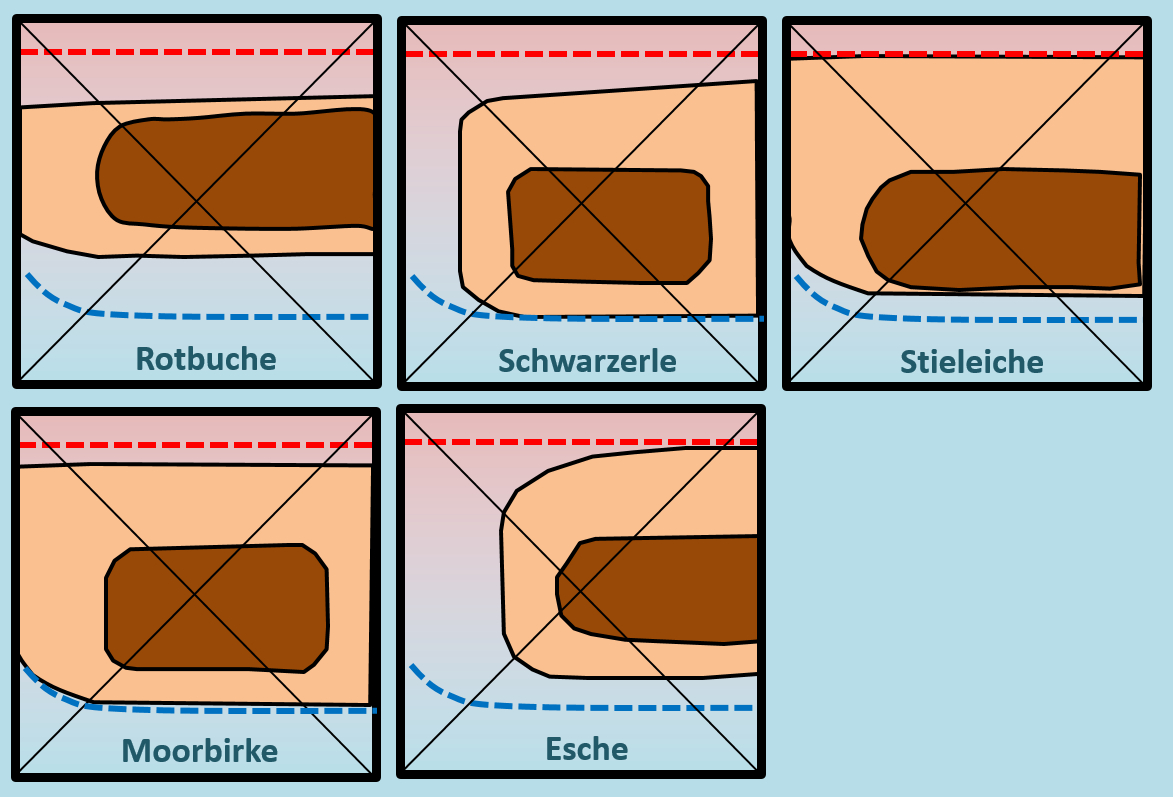
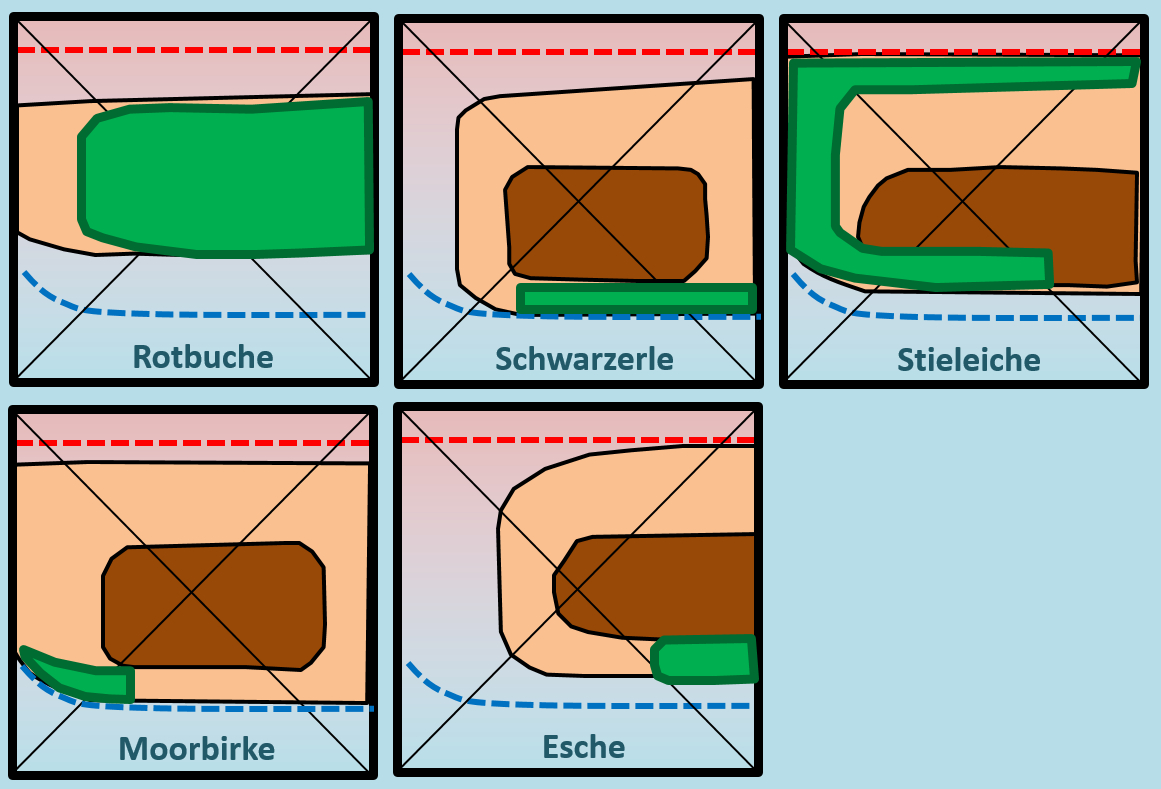
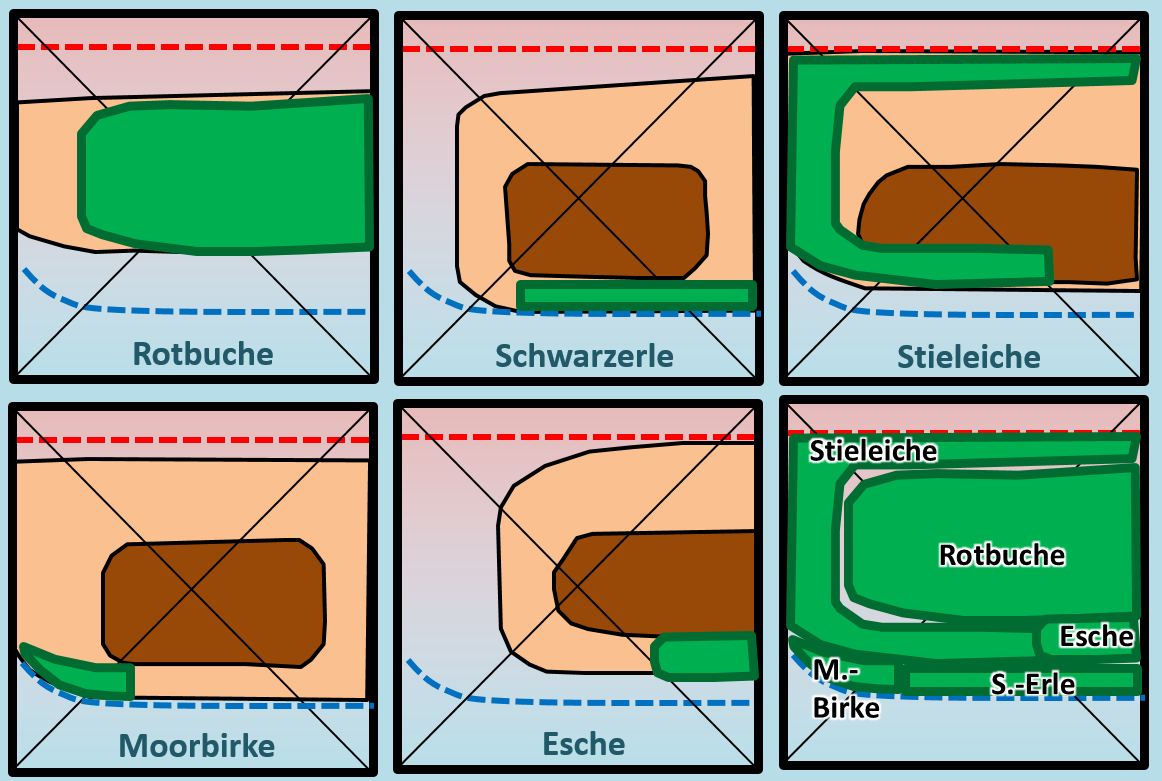
Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
(AA C(EK) f. 11.05. begonnen) Markierung: Quelltext-Bearbeitung 2017 |
(weiter) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 12: | Zeile 12: | ||
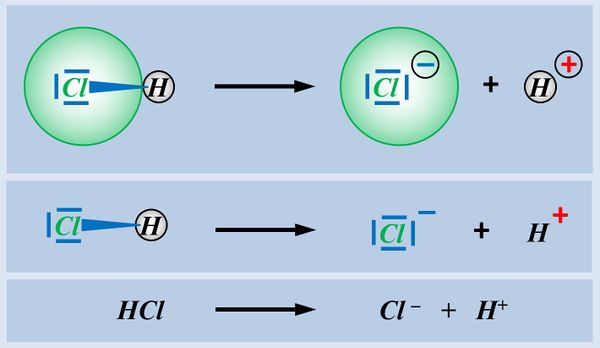
Protonen können aber weder von Säuren einfach so "ins Freie" abgegeben werden, noch fliegen Protonen einfach so in der Gegend herum und können von Basen beliebig aufgenommen werden. Dazu ist immer ein Reaktionspartner nötig, der diese Protonen aufnimmt oder hergibt.<br> | Protonen können aber weder von Säuren einfach so "ins Freie" abgegeben werden, noch fliegen Protonen einfach so in der Gegend herum und können von Basen beliebig aufgenommen werden. Dazu ist immer ein Reaktionspartner nötig, der diese Protonen aufnimmt oder hergibt.<br> | ||
Insofern sind '''Säuren und Basen''' hervorragende '''Reaktionspartner''' und reagieren in einer typischen '''"Säure-Base-Reaktion"''' miteinander:<br> | Insofern sind '''Säuren und Basen''' hervorragende '''Reaktionspartner''' und reagieren in einer typischen '''"Säure-Base-Reaktion"''' miteinander:<br> | ||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]] | [[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | ||
<br> | <br> | ||
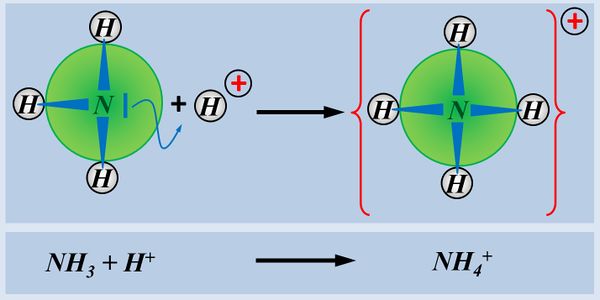
Wie ihr sehen könnt, entsteht bei dieser Reaktion ein Salz. Also ein Stoff, der aus positiv geladenen Teilchen (hier NH<sub>4</sub><sup>+</sup>) und negativ geladenen Teilchen (hier: Cl<sup>-</sup>) aufgebaut ist. Salze entstehen auch bei der Reaktion von Metallen mit Nichtmetallen, z.B. von Natrium mit Chlor. | |||
* Vergleicht diese beiden Reaktionstypen miteinander! "Vergleichen" heißt: Gemeinsamkeiten und Unterschiede herausstellen. | |||
{{Lösung versteckt| | |||
* Bei der Salzbildung aus '''Metall und Nichtmetall''' gibt das Metall '''Elektronen '''ab, das Nichtmetall nimmt Elektronen auf. | |||
* Bei der Salzbildung aus '''Säure und Base''' gibt die Säure ein '''Proton '''ab, die Base nimmt ein Proton auf. | |||
* Gemeinsamkeit: In beiden Fällen entstehen unterschiedlich geladene Ionen, die das Salz bilden. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | <br> | ||
Die direkte Reaktion einer Säure mit einer Base betrachtet man an dieser Stelle im Unterricht eher selten. Einfach deswegen, weil viele Säure-Base-Reaktionen im Wasser ablaufen. Und Wasser hat ein besondere Eigenschaft. <br> | |||
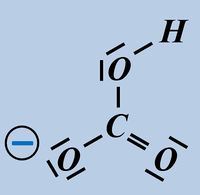
Betrachtet zunächst die dargestellte Reaktion, die beim Einleiten von HCl-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Ein HCl-Molekül gibt ein Proton an ein Wassermolekül ab. Es entsteht ein Chlorid-Ion und ein Oxonium-Ion (den Namen wusstet ihr wahrscheinlich noch nicht, auch "H<sub>3</sub>O<sup>+</sup>-Teilchen" wäre o.k. gewesen. | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | |||
Betrachtet nun die dargestellte Reaktion, die beim Einleiten von NH<sub>3</sub>-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:ÖkoNische2_Baumdiagramm_leer.jpg]]<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es | Ein Ammoniak-Molekül entreißt einem Wasser-Molekül ein Proton. Es entsteht ein Ammonium-Ion (NH<sub>4</sub><sup>+</sup>-Teilchen) und ein Hydroxid-Ion (OH<sup>-</sup>-Teilchen) | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | <br> | ||