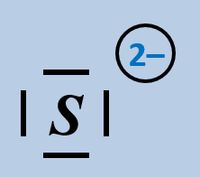Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 207: | Zeile 207: | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie10 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Verbesserung der Hausaufgabe</span> | |||
|Inhalt= | |||
'''Pflicht''': Sucht bei euch zu Hause drei völlig verschiedene '''Lebensmittel''', die '''sauer '''sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen"). <br> | |||
'''Freiwillig:''' Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist! | |||
* z.B.: Essig - Essigsäure (CH<sub>3</sub>-COOH) | |||
* z.B.: Zitronen (allgemein Früchte) - Zitronensäure (C<sub>6</sub>H<sub>8</sub>O<sub>7</sub>) | |||
* z.B.: Joghurt (allgemein Sauermilchprodukte) - Milchsäure (C<sub>3</sub>H<sub>6</sub>O<sub>3</sub>) | |||
* z.B.: Limo (allgemein sprudelnde Getränke) - Kohlensäure (H<sub>2</sub>CO<sub>3</sub>) | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Die "Gegenspieler" der Säuren'''</span> | |||
|Inhalt= | |||
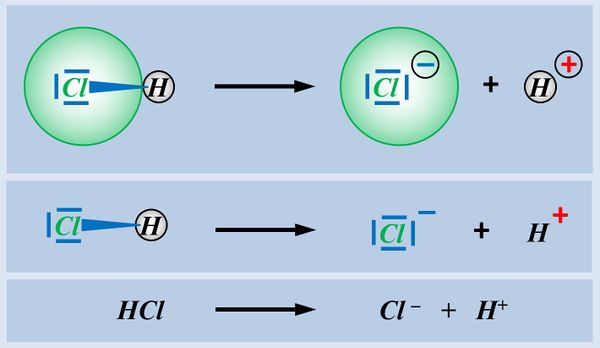
In der letzten Einheit habt ihr gesehen, dass es Moleküle mit einer '''polaren Atombindung''' zwischen einem elektronegativen Atom und einem Wasserstoff-Atom gibt, die '''heterolytisch ein Proton abspalten''' können. Hier noch einmal verschiedene Darstellungsformen am Beispiel von Hydrogenchlorid (HCl).<br> | |||
[[Datei:SäBa2_Heterolyse_divDarstellungen.jpg|600px]]<br> | |||
<br> | |||
<br> | |||
Moleküle, bei denen eine derartige Reaktion möglich ist, nennt man '''Säuren'''. Typische '''Eigenschaften '''von Säuren sind z.B. der '''"saure Geschmack"''' oder '''"greifen unedle Metalle an"'''. Diese Eigenschaften sind auf das abspaltbare Proton zurückzuführen.<br> | |||
Sicher können sich diejenigen, die Chemie schon länger in der Schule hatten erinnern, dass es zu Säuren einen '''"Gegenspieler"''' gibt. Wie heißen diese Gegenspieler? | |||
{{Lösung versteckt| | |||
Basen oder Laugen (als Lauge bezeichnet man in der Regel eine wässrige Lösung einer Base) | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Diese Gegenspieler sind in der Lage, die saure Wirkung von Säuren zu neutralisieren, also aufzuheben. Dazu gleich ein Versuch. Vorher noch etwas Theorie: Wenn die saure Wirkung einer Säure darauf beruht, dass die Säure-Teilchen ein Proton abgeben, welche Fähigkeit muss dann ein solches Gegenspieler-Teilchen besitzen, wenn es diese Wirkung aufzuheben vermag? | |||
{{Lösung versteckt| | |||
Es muss in der Lage sein, ein Proton aufzunehmen | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Beispiel'''</span> | |||
|Inhalt= | |||
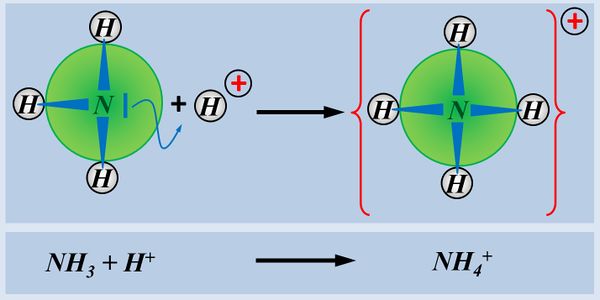
Ein einfaches Molekül, dass in der Lage ist, ein Proton aufzunehmen ist NH<sub>3</sub> (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen:<br> | |||
[[Datei:SäBa2_NH3_AufnahmeProton.jpg|600px]]<br> | |||
<br> | |||
{{Lösung versteckt| | |||
Das Ammoniak-Molekül NH<sub>3</sub> stellt sein freies Elektronen-Paar für eine Atombindung mit einem Proton zur Verfügung | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Was ist der Unterschied zwischen dieser neu gebildeten Atombindung im Vergleich zu einer "normalen" Atombindung, wie ihr sie früher kennengelernt habt? | |||
<br> | |||
{{Lösung versteckt| | |||
Bei der Bildung einer Atombindung sind wir in den vorangegangenen Einheiten davon ausgegangen, dass jeder Partner ein Elektron zur Verfügung stellt. Hier stammen aber beide Elektronen der Atombindung nur vom Stickstoff-Atom. Das Proton hat kein Elektron zur Bindung beigetragen. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Versuch'''</span> | |||
|Inhalt= | |||
Ein freiwilliger Versuch. '''Ihr benötigt dazu:''' | |||
* Zitrone(nsaft) | |||
* Bullrichsalz (Tabletten oder Pulver), falls nicht verfügbar ist auch Backpulver möglich. | |||
* 2 kleine Gläschen (z.B. Schnapsgläser) | |||
<br> | |||
'''Durchführung''': | |||
* Füllt die zwei Schnapsgläser zur Hälfte mit Leitungswasser. In ein Glas gebt ihr eine Tablette Bullrich-Salz (oder einen halben Teelöffel Pulver oder einen halben Teelöffel Backpulver. | |||
* Anschließend tropft ihr in beide Gläschen die gleiche Menge Zitronensaft (ich habe es mit jeweils 50 Tropfen Z.-Saft ausprobiert) und rührt ca. 1 Minute lang um. | |||
* Probiert von jeder Lösung einen Teelöffel voll (Ihr könnt das noch einmal wiederholen, dann aber bitte keine größeren Mengen mehr von der Backpulver-Lsg. schlucken. Backpulver kann im Magen zur Bildung großer Mengen Gas führen. | |||
<br> | |||
Beschreibt das '''Ergebnis''' in Form eurer Geschmacks-Empfindung | |||
{{Lösung versteckt| | |||
Die Lösung mit Bullrich-Salz / Backpulver sollte deutlich weniger sauer schmecken. Es kommt aber ein bisschen auf die Zitrone an. Die muss sehr sauer sein, damit der Versuch gut klappt. <br> | |||
Nur kurz zur Erklärung: Bullrichsalz enthält Natriumhydrogencarbonat. In Wasser gelöst entstehen Hydrogencarbonat-Ionen. Diese sind in der Lage Protonen aufzunehmen. Sie fungieren also als Base.<br> | |||
Die sauere Wirkung von Zitronensaft beruht auf der Zitronensäure, die ein (bzw. auch mehrere) Proton(en) abgeben kann. Nachdem diese jedoch von den Hydrogencarbonat-Ionen "abgefangen" werden, entsteht auf der Zunge kein sauerer Eindruck. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Hausaufgabe</span> | |||
|Inhalt= | |||
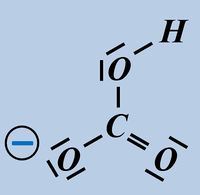
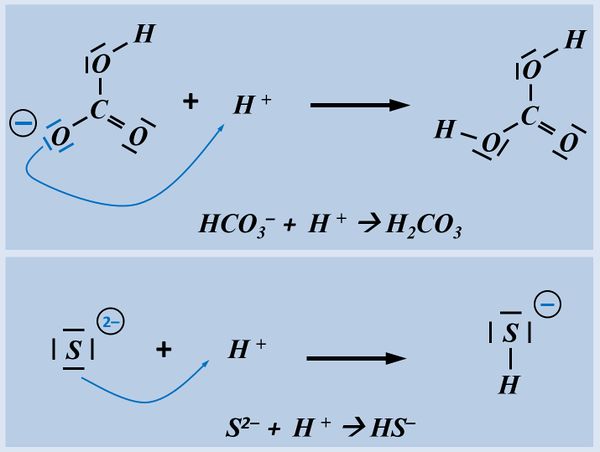
Formuliert die Aufnahme '''eines Protons''' auf Teilchen-Ebene von folgenden Basen: | |||
* Hydrogencarbonat-Ion | |||
* Sulfid-Ion | |||
[[Datei:SäBa2_HCO3minus_VSF.jpg|200px]] [[Datei:SäBa2_S2minus_VSF.jpg|200px]]<br> | |||
Bitte wirklich erst auf "Lösung" klicken, wenn ihr diesen chemischen Vorgang auf ein Stück Papier gezeichnet habt! | |||
{{Lösung versteckt| | |||
Hast Du wirklich die Lösung schon gezeichnet? | |||
{{Lösung versteckt| | |||
[[Datei:SäBa2_HA_ML.jpg|600px]]<br> | |||
Beim Hydrogencarbonat-Ion könnte es sein, dass ihr ein anderes freies Elektronenpaar für die Bindung zum Proton verwendet habt. Das ist aber falsch! Das Proton wird immer über eines der drei freie Elektronenpaare gebunden, die am Sauerstoff mit der negativen Ladung sitzen (im Bild blau markiert). Schon allein aufgrund der elektrischen Ladung dort, wird das positiv geladene Proton dort hin gezogen.<br> | |||
Beim Sulfid-Ion ist egal, welches Elektronenpaar verwendet wird, das Ergebnis ist faktisch immer das selbe. | |||
|Ja!|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
Version vom 1. Mai 2020, 16:15 Uhr
neuer Test
Arbeitsauftrag Chemie10
Arbeitsauftrag für den 04.05.