Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(AA C8) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
== Arbeitsauftrag 8 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Ergebnisse der Hausaufgabe'''</span> | |||
|Inhalt= | |||
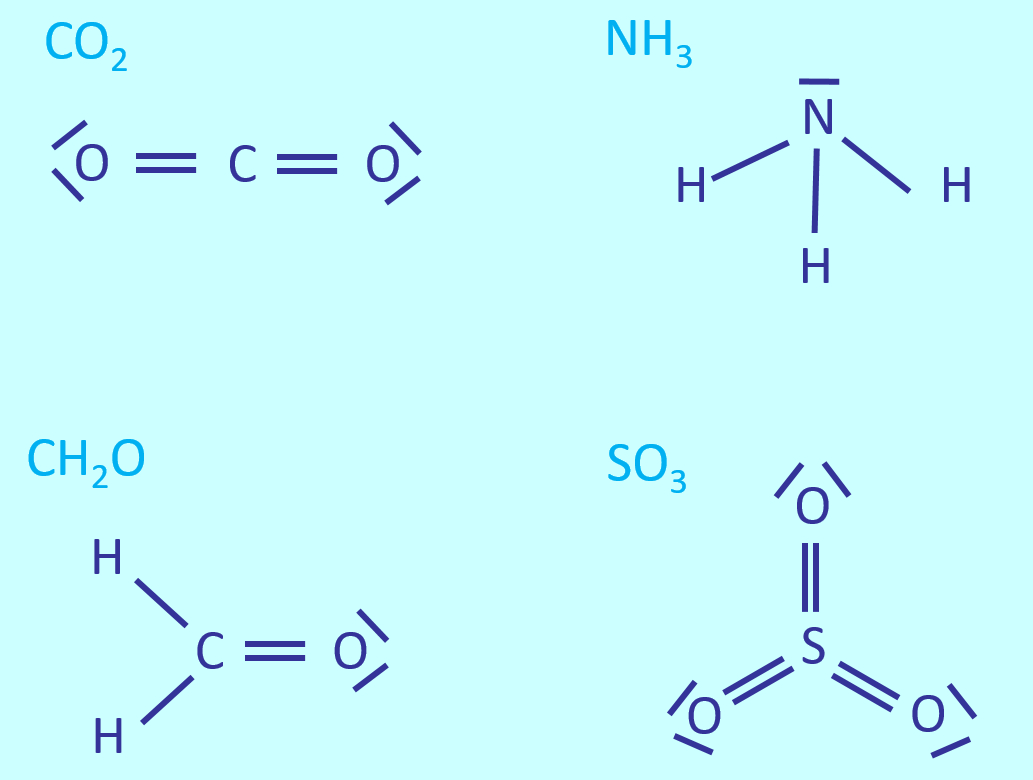
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner. <br> | |||
Ihr solltet euch Gedanken machen, warum manche Gegenstände aus Metall sind und kein anderes Material zur Herstellung verwendet wurde. Eine Eigenschaft wurde sehr häufig hervorgehoben, auch wenn ihr es teilweise unterschiedlich ausgedrückt habt: Die "Stabilität" von Metallen. In dieser und der nächsten Einheit, möchte ich mit euch versuchen zu klären, woher diese "Stabilität" kommt.<br> | |||
<span style="color:#60F">Achtung: "Stabilität" steht im Moment noch in Anführungszeichen, weil dieser Begriff eigentlich ziemlich ungenau ist: Wenn ihr einen Eisennagel und ein Stück Plastik im Garten vergrabt, werdet ihr nach einem Jahr den Nagel ziemlich verrostet wiederfinden, während das Stück Plastik sich kaum verändert hat. '''Chemisch''' betrachtet sind viele Metalle nämlich überhaupt nicht stabil.</span> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
Das, was wir gerade besprechen, ist übrigens ein Haupt-Anliegen der Wissenschaft "Chemie": Sie versucht Zusammenhänge herzustellen zwischen dem '''Aufbau von Stoffen''' und den '''Eigenschaften''', die diese Stoffe haben.<br> | |||
Einen solchen wichtigen Zusammenhang habt ihr nun schon oft gehört und in der letzten Einheit vor den Osterferien noch einmal intensiv besprochen: Es gibt einen Zusammenhang zwischen dem Aggregatszustand eines Stoffes und den Anziehungskräften der im Stoff enthaltenen Teilchen. Die Anziehungskräfte wiederum hängen eng mit dem Aufbau der Teilchen zusammen. Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest kleine, wie z.B. O<sub>2</sub> gasförmig) | |||
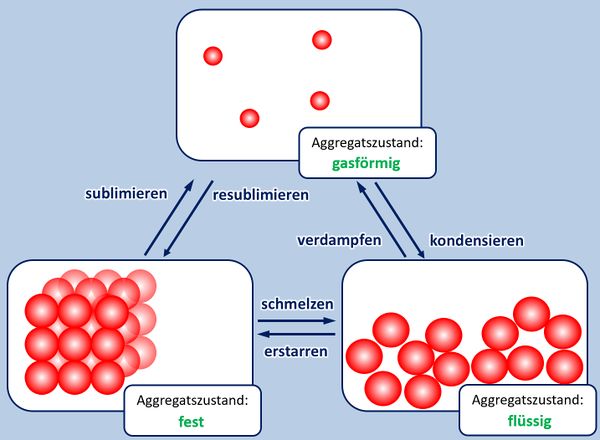
* Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:A5_Aggregatszustände_ML.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
* Erkläre, warum Salze so hohe Schmelz- und Siedetemperaturen besitzen! Gehe bei Deiner Erklärung auch darauf ein, wie sich Salze aus den Elementen bilden. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg2_Salzgleichungen.jpg]] | |||
Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Nachdem die meisten Metalle bei Raumtemperatur ebenfalls fest sind, könnte man zunächst ja vermuten, dass ein ähnlicher Grund wie bei den Salzen zur starken Anziehung der Metallteilchen untereinander führt.<br> | |||
Man stößt allerdings sehr schnell auf Probleme, wenn man versucht das Bindungs-Prinzip von Salzen auf ein Stück Metall zu übertragen. Versucht zu begründen, warum in einem Stück Magnesium-Metall die Bindung der Mg-Atome aneinander keinesfalls auf den gleichen Gründen beruhen kann, wie bei einem Salzkristall. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg2_Salzgleichungen.jpg]] | |||
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, '''Elektronen abzugeben''', um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese '''Elektronen aufnehmen''' können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.<br> | |||
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Gut. Beziehungsweise: schlecht. Schauen wir noch einmal kurz auf die andere Art der Bindung, die wir bereits kennengelernt haben: Die Atombindung. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Lösung versteckt| | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Das war es schon für heute</span> | |||
|Inhalt= | |||
Falls ihr Schwierigkeiten mit den Aufgaben hattet, meldet euch bitte bei mir. | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<div class="grid"> | <div class="grid"> | ||
<div class="width-1-3"> | <div class="width-1-3"> | ||
Version vom 26. April 2020, 07:43 Uhr
Arbeitsauftrag 8
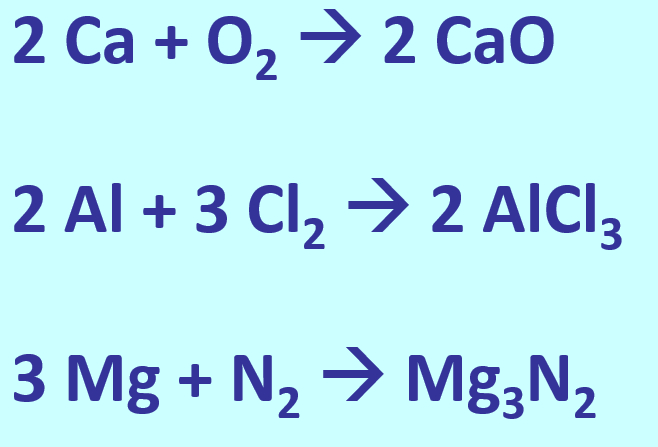 Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
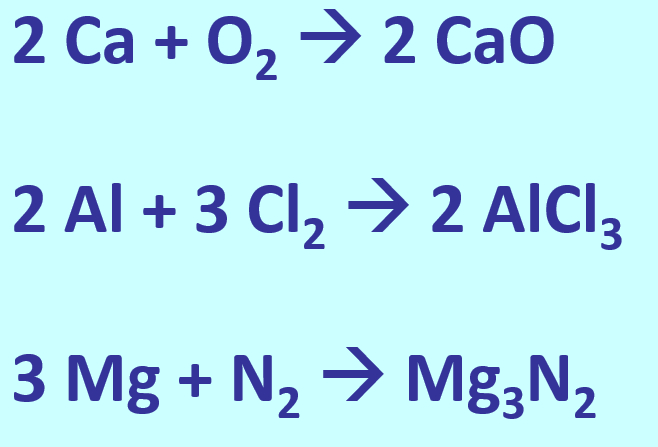 In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden