Corona-Arbeitsaufträge (Chemie) LUX: Unterschied zwischen den Versionen
Aus RMG-Wiki
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(Arbeitsauftrag 3 ergänzt) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
== | == Arbeitsauftrag Chemie1 == | ||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie1 '''</span> | |||
|Inhalt= | |||
Züchtet einen Salzkristall: | |||
* Dokumentiert jeden der folgenden Schritte mit einem Foto, damit ihr daraus später eine schöne Anleitung am PC erstellen könnt! | |||
* Füllt ein Glas mit heißem Wasser. Ihr braucht es nicht extra erhitzen, nehmt einfach das heißeste Wasser, was ihr aus eurer Leitung bekommen könnt. | |||
* Gebt löffelweise '''Spülmaschinen-Salz''' dazu und rührt um. Minutenlang! (Wenn ihr kein Spülmaschinen-Salz habt, geht auch normales Speisesalz) | |||
* Irgendwann wird sich das Salz im Glas nicht mehr auflösen. Lasst den Ansatz dann noch 5 Minuten stehen. | |||
* Filtriert das Salzwasser durch einen Kaffee-Filter und fangt das Wasser in einem zweiten Glas auf | |||
* Schüttet etwas von dem Filtrat in eine Untertasse (am besten eine, die nicht weiß ist) und stellt es an einen sonnigen Platz auf das Fensterbrett, wo der Ansatz bis Montag stehen bleiben kann ohne dass er stört. Er sollte nicht bewegt werden. | |||
* Macht alle 24 Stunden ein Foto. | |||
* Am Montag, 23.03. geht es weiter | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Lösung versteckt| | |||
<gallery mode="packed"> | |||
SalzkristallZüchten_V1_LsgiGlas.jpg|Gesättigte Salzlösung | |||
SalzkristallZüchten_V1_LsgiUTasse.jpg|Klare Salzlösung in Untertasse | |||
SalzkristallZüchten_V1_LsgiUTasse2.jpg|nach 12 Stunden | |||
SalzkristallZüchten_V1_LsgiUTasse3.jpg|nach 24 Stunden | |||
SalzkristallZüchten_V1_LsgiUTasse4.jpg|nach 36 Stunden | |||
</gallery> | |||
|Lösung Chemie1|Lösung ausblenden}} | |||
{{Box-spezial | {{Box-spezial | ||
| Zeile 15: | Zeile 43: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
== Arbeitsauftrag Chemie2 (verpflichtend) == | |||
{{Box-spezial | {{Box-spezial | ||
| Zeile 114: | Zeile 145: | ||
}} | }} | ||
== Arbeitsauftrag Chemie3 (verpflichtende) == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Arbeitsauftrag | |Titel=<span style="color:#607">'''Arbeitsauftrag Chemie3 (verpflichtend) '''</span> | ||
|Inhalt= | |Inhalt= | ||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel und einen Stift. Und Ruhe. Voraussetzung für die Bearbeitung ist, dass ihr Arbeitsauftrag '''Chemie2''' erledigt habt (vom Mo, 23.03.). Am Ende erhaltet ihr einen Hefteintrag sowohl für die Einheit Chemie2 als auch Chemie3. Den könnt ihr abschreiben (bitte nur im Notfall) oder ausdrucken und einkleben.</span><br> | |||
* | <span style="color:#607">'''Bitte klickt erst auf "Lösung", wenn ihr die Aufgabe wirklich versucht habt zu lösen.'''</span><br> | ||
* | <br> | ||
* | '''Verbesserung der Hausaufgabe'''<br> | ||
* Buch S. 107, A1 | |||
{{Lösung versteckt| | |||
* Macht | [[Datei:A2_HA_S107_A1.jpg]]<br> | ||
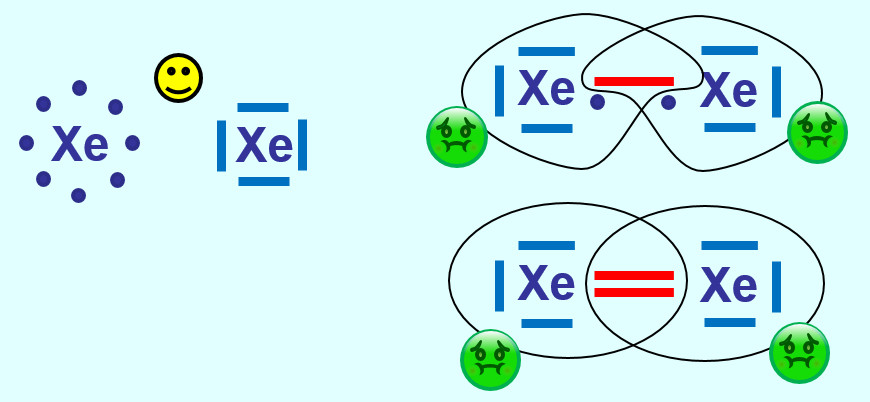
* | Xenon hat bereit Edelgaskonfiguration (8 VE auf der äußersten Schale). Durch eine (oder mehr) Atombindung(en) mit einem weiteren Xenon-Atom würde dieser energiearme Zustand zerstört werden. Alle Edelgase kommen als einatomige Gase vor, im Gegensatz zu den anderen elementaren Gasen (wie z.B. Sauerstoff, Stickstoff, Wasserstoff...) | ||
|Hausaufgabe 1|Lösung ausblenden}} | |||
* Buch S. 107, A3 | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_S107_A3.jpg]]<br> | |||
Ein Natrium-Atom könnte mit seinem '''einen Valenzelektron''' lediglich '''eine Atombindung''' aufbauen. Dadurch käme eine Konfiguration zustanden, bei der dem Atom zwei Elektronen zugeordnet werden können. Das ist weit entfernt von einer Edelgaskonfiguration un daher auch nicht stabil. | |||
|Hausaufgabe 2|Lösung ausblenden}} | |||
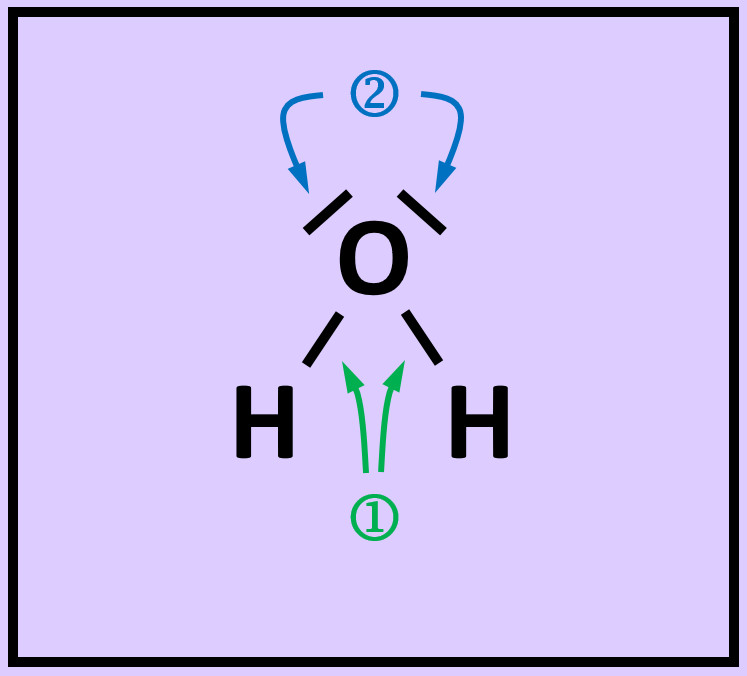
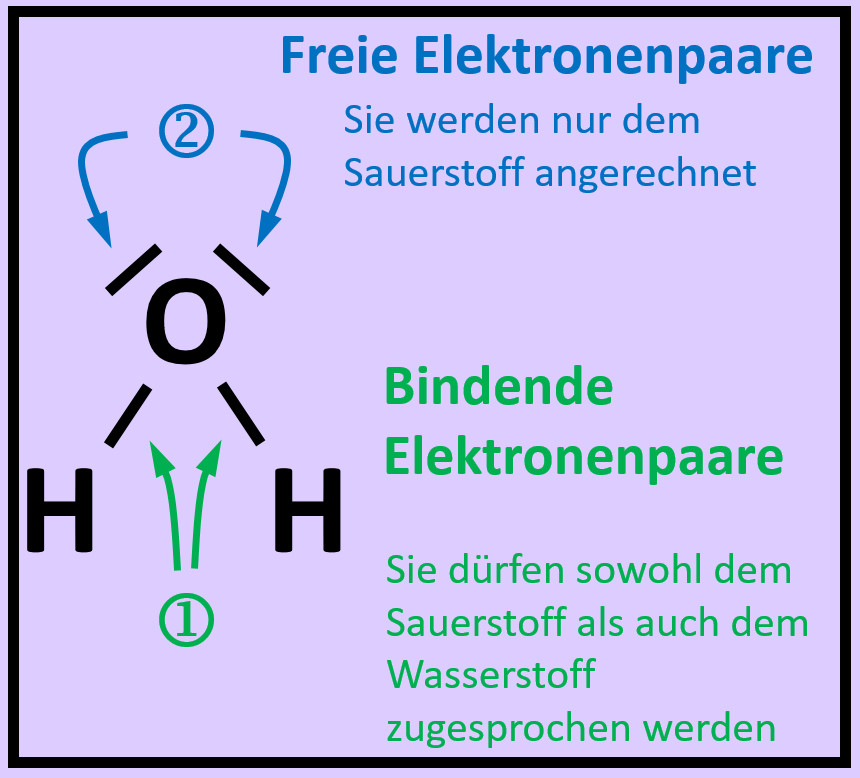
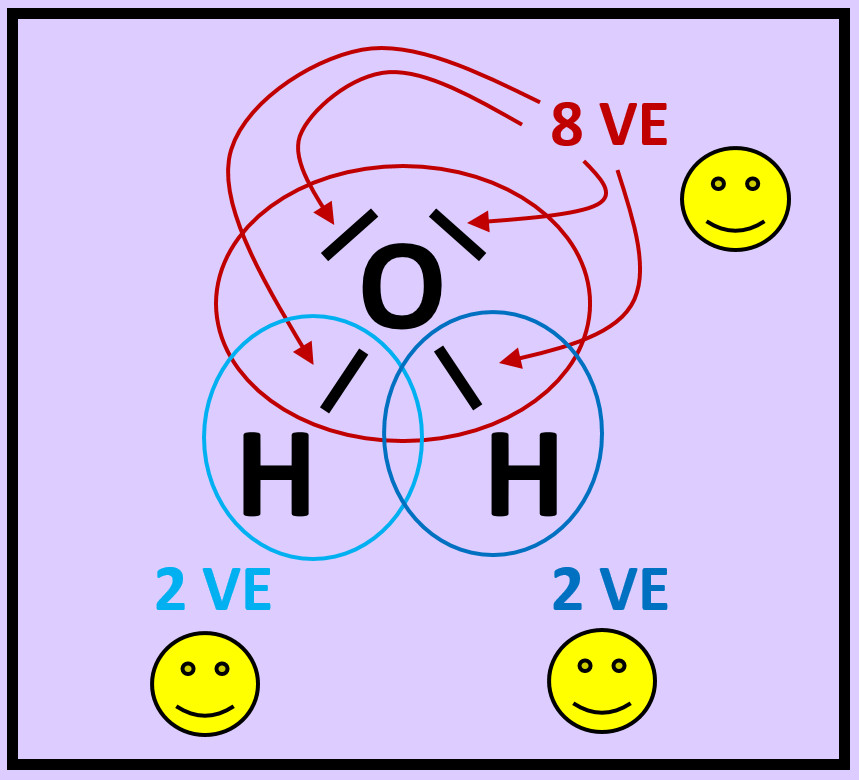
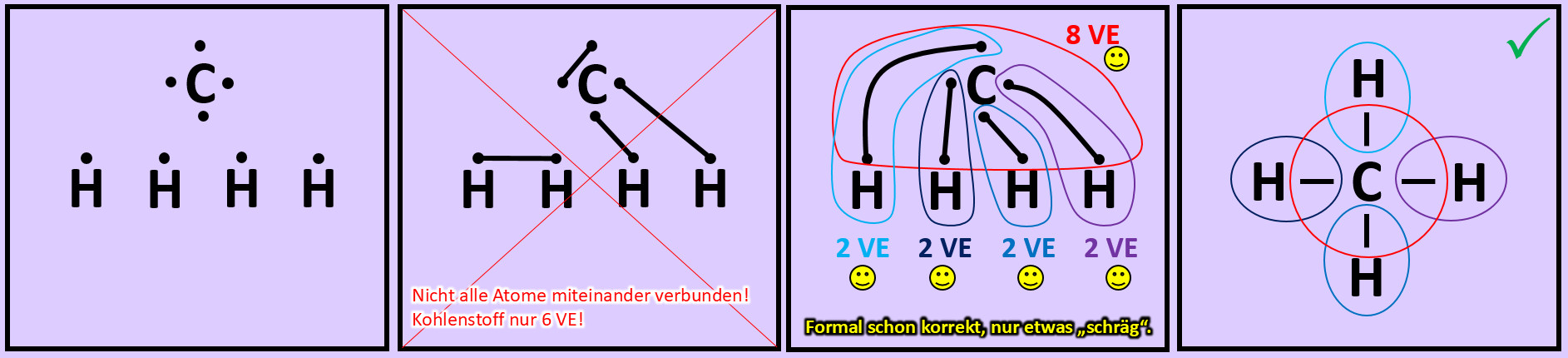
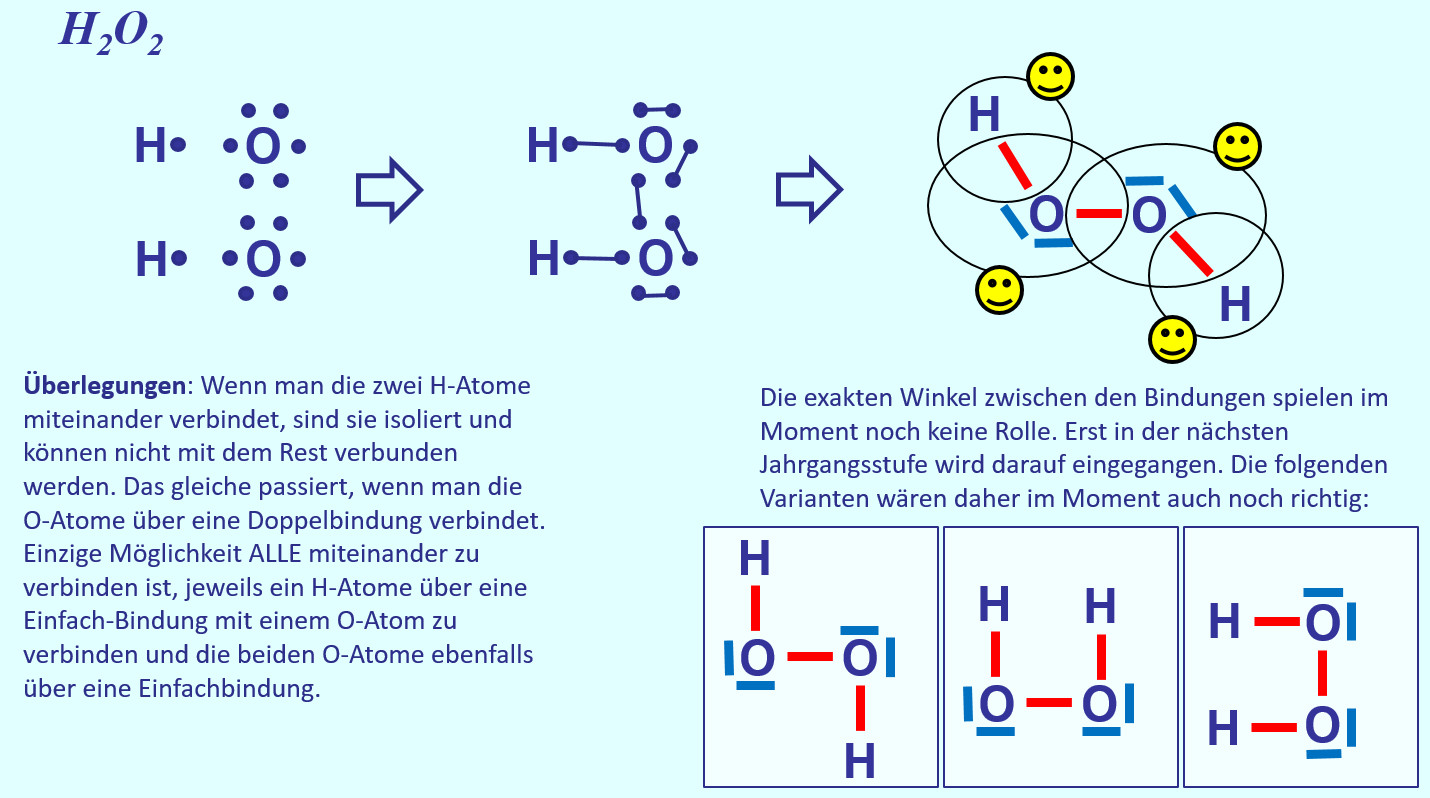
* Zeichne die Valenzstrichformel für Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_H2O2.jpg]]<br> | |||
|Hausaufgabe 3|Lösung ausblenden}} | |||
Neu: '''Unterschiede zwischen Salzen und Molekülen''' <br> | |||
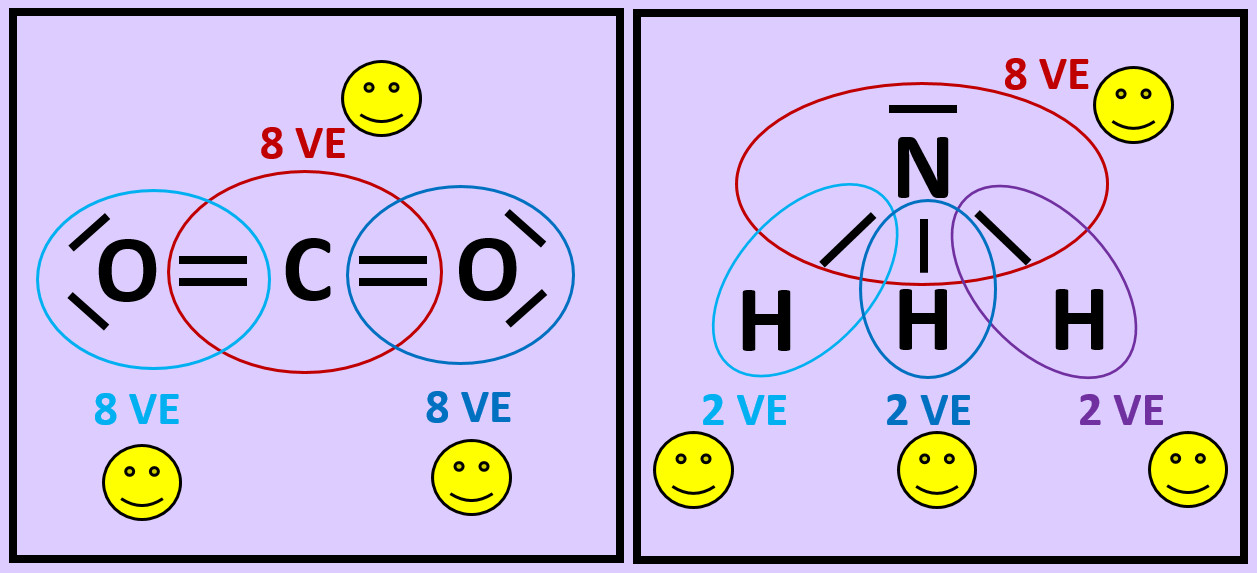
Bevor wir uns einige Spezialfälle beim Aufstellen von Valenzstrichformeln anschauen, soll hier zunächst noch einmal der Unterschied zwischen Salzen und Molekülen etwas genauer beleuchtet werden: Die chemischen Formeln '''CaF<sub>2</sub>''' und '''CO<sub>2</sub>''' sehen sich auf den ersten Blick recht ähnlich: Beide enthalten drei Atome, eines davon kommt doppelt vor. Auf Teilchen-Ebene betrachtet bedeuten sie jedoch etwas völlig anderes. <br> | |||
<br> | |||
'''Zunächst zum Calciumfluorid (CaF<sub>2</sub>)''': Es gibt kein einzelnes CaF<sub>2</sub>-Teilchen. CaF<sub>2</sub> ist ein Salz und besteht aus sehr vielen Ca<sup>2+</sup>- und sehr vielen F<sup>-</sup>-Ionen. Alle ziehen aufgrund der unterschiedlichen Ladungen an ihren entgegen gesetzt geladenen Nachbarn, in alle Richtungen. Es entstehen riesige Gebilde, die Salzkristalle. Insgesamt ist das Verhältnis der vorliegenden Ionen in einem solchen Salzkristall aber immer 1 : 2. Nur so können sich die Ladungen exakt neutralisieren und es entsteht ein ungeladener Stoff (wären Salze geladen, würde man z.B. beim Berühren eine elektrischen Schlag bekommen). Das folgende Bild zeigt den Ausschnitt aus einem CaF<sub>2</sub>-Kristall. Weiß dargestellt sind die Ca<sup>2+</sup>-Ionen, die F<sup>-</sup>-Ionen grün. Man kann erkennen, dass Calcium-Ionen jeweils von acht Fluorid-Ionen als direkte Nachbarn umgeben sind (der graue Würfel links in der Abbildung), während Fluorid-Ionen jeweils nur von vier Calcium-Ionen als direkte Nachbarn umgeben sind (die graue pyramidenähnliche Figur rechts in der Abbildung). Pro Fluorid-Ion sind also doppelt so viele Calcium-Ionen vorhanden. | |||
[[Datei:CaF2_polyhedra.png|300px]]<br> | |||
<br> | |||
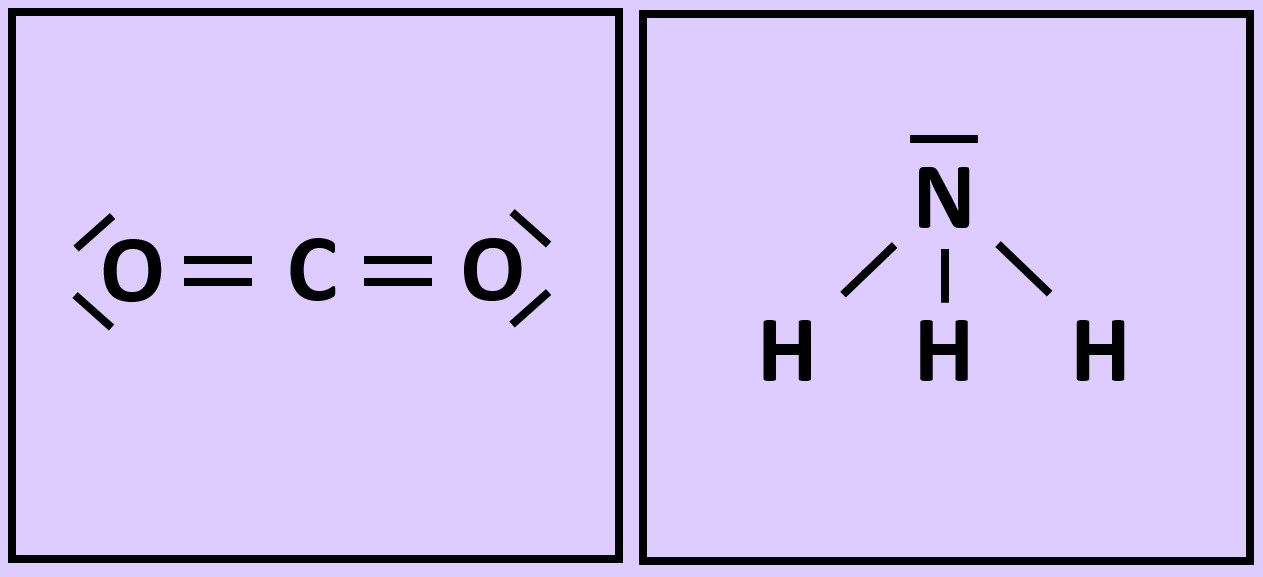
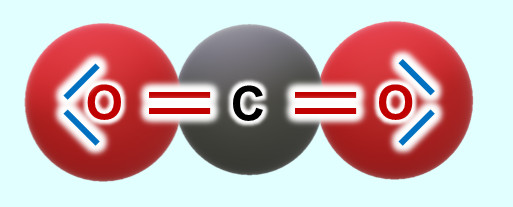
'''Nun zum Kohlenstoffdioxid (CO<sub>2</sub>)''': Hier gibt es tatsächlich einzelne CO<sub>2</sub>Teilchen. Jeweils eine Doppelbindung verbindet genau ein Sauerstoffatom mit dem zentralen Kohlenstoffatom. Diese drei Atome bilden eine Einheit, eben das Molekül. Mit anderen Teilchen tritt zunächst keine Wechselwirkung auf (später werden wir sehen, dass dies nicht korrekt ist, für den Moment bleiben wir aber bei dieser Annahme).<br> | |||
[[Datei:A3_CO2_Einzelmolekül.jpg]]<br> | |||
<br> | |||
Woran erkennt man nun, ob ein Salz oder ein Molekül vorliegt? Im Moment ist auch das noch recht einfach: '''Salze '''liegen vor, wenn es sich um eine Verbindung aus '''einem Metall und einem Nichtmetall''' handelt. '''Moleküle '''liegen vor, wenn es sich um eine Verbindung '''aus Nichtmetallen untereinander''' handelt. <br> | |||
* Entscheidet, ob es sich bei den folgenden Verbindungen um ein Salz oder einen molekularen Stoff handelt (Im PSE in eurem Buch auf der letzten Seite kann man erkennen, ob ein Element zu den Metallen oder Nichtmetallen gezählt wird): NO<sub>2</sub>, K<sub>2</sub>O, Al<sub>2</sub>O<sub>3</sub>, N<sub>2</sub>O<sub>3</sub> | |||
{{Lösung versteckt| | |||
* NO<sub>2</sub>: Stickstoff(N) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: NO<sub>2</sub> ist ein '''molekularer Stoff''' | |||
* K<sub>2</sub>O: Kalium (K) ist ein Metall, Sauerstoff (O) ein Nichtmetall, das bedeutet: K<sub>2</sub>O ist ein '''Salz''' | |||
* Al<sub>2</sub>S<sub>3</sub>: Aluminium (Al) ist ein Metall, Schwefel (S) ein Nichtmetall, das bedeutet: Al<sub>2</sub>S<sub>3</sub> ist ein '''Salz''' | |||
* SO<sub>3</sub>: Schwefel (S) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: SO<sub>3</sub> ist ein '''molekularer Stoff''' | |||
|Lösung 1|Lösung ausblenden}} | |||
'''Zurück zu den Valenzstrichformeln für Moleküle:''' <br> | |||
In der letzten Unterrichtseinheit habt ihr gesehen, wie man die Valenzstrichformel für Moleküle aufstellt. In eurem Buch ist ein mathematisches Verfahren dazu beschrieben. Ich persönlich finde es etwas umständlich und glaube, das man auch ohne dieses Verfahren auskommt. Einfach indem man sich ein paar sinnvolle Gedanken macht und etwas herumprobiert. Ihr dürft aber gerne das mathematische Verfahren anwenden. | |||
* Versucht nun eine Valenzstrichformel für das Molekül Schwefeldioxid (SO<sub>2</sub>) aufzustellen! | |||
{{Lösung versteckt| | |||
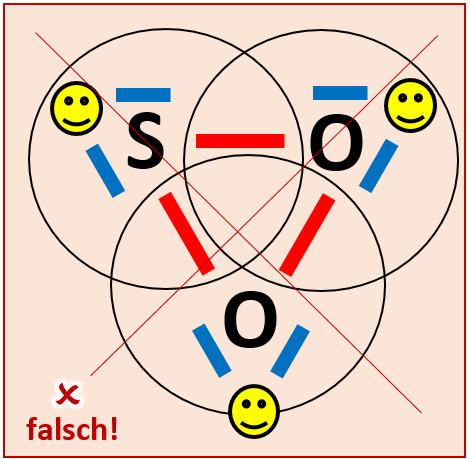
Wenn ihr etwas Geduld aufgebracht habt, kommt ihr vielleicht zu der folgenden Lösung: <br> | |||
[[Datei:A3_SO2_falsch.jpg]]<br> | |||
Obwohl hier alle drei Atome Edelgaskonfiguration aufweisen würden, bildet sich dieses Molekül nicht! Diese Lösung ist daher leider falsch. Aber woran liegt das? | |||
|Lösung 2|Lösung ausblenden}} | |||
Das Problem ist die Geometrie. Ein Effekt, den ich euch im Moment nicht näher erläutern kann, führt dazu, dass '''Dreiecks- und Vierecks-Verbindungen''' so gut wie nie stabil sind und sich daher auch (fast) nicht bilden. Die oben abgebildete Variante eines SO<sub>2</sub>-Moleküls wäre eine Dreiecks-Verbindung. <br> | |||
Wenn ihr weiter versucht, eine Lösung zu finden, werdet ihr vermutlich verzweifeln. Es fehlt euch nämlich noch eine wichtige Zusatzinformation. Zunächst zeige ich euch aber die richtige Strukturformel. Klickt auf "Anzeigen", schaut euch das Molekül an und erklärt, warum diese Variante nach eurem bisherigen Wissenstand falsch sein sollte: | |||
{{Lösung versteckt| | |||
[[Datei:A3_SO2_richtig.jpg]] | |||
|Anzeigen|Lösung ausblenden}} | |||
{{Lösung versteckt| | |||
Dem Schwefel-Atom werden in dieser Anordnung '''zehn Valenzelektronen''' zugeordnet. Das ist kein Edelgaszustand. | |||
|Lösung 3|Lösung ausblenden}} | |||
Dennoch ist dieser Zustand stabiler als die Dreiecksverbindung. Man darf allerdings nicht jedem Atom in Molekülen mehr als acht Valenzelektronen zuordnen! Das ist nur möglich, wenn es sich um Elemente der 3. Periode oder noch höher handelt. Für Elemente der 2. Periode gilt die '''Oktettregel '''streng (ohne Ausnahme):<br> | |||
<br> | |||
''Atome besitzen in Verbindungen oft eine Elektronenkonfiguration, bei der auf der äußersten Schale '''acht Elektronen''' sitzen.''<br> | |||
<br> | |||
Nachdem Schwefel ein Element der 3. Periode ist, kann im SO<sub>2</sub> das '''Oktett '''(also 8 VE) überschritten werden. | |||
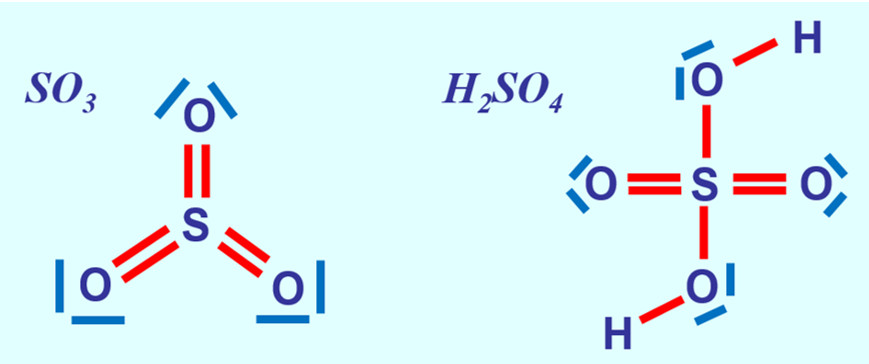
* Wendet dieses neue Wissen jetzt an und stellt die Valenzstrichformeln für Schwefeltrioxid SO<sub>3</sub> (leicht) und Schwefelsäure H<sub>2</sub>SO<sub>4</sub> (schwer) auf! | |||
{{Lösung versteckt| | |||
[[Datei:A3_SO3_H2SO4.jpg]] | |||
|Lösung 4|Lösung ausblenden}} | |||
Ihr könnt euch nun die Hefteinträge für die letzten beiden Einheiten herunterladen: | |||
* [[Spezial:FilePath/A2_Atombdg_Hefteintrag1.pdf| Einheit 1]] | |||
* [[Spezial:FilePath/A2_Atombdg_Hefteintrag2.pdf| Einheit 2]] | |||
Hier findet ihr noch ein Übungsblatt mit vielen Molekülen, zu denen ihr die Valenzstrichformeln aufstellen könnt. '''Meine Empfehlung:''' Macht ab heute jeden Tag als Hausaufgabe drei von der linken und zwei von der rechten Seite. Übung macht den Meister! | |||
* [[Spezial:FilePath/A3_ÜAufg_Valenzstrich_AA.pdf| Übungsaufgaben]] | |||
* [[Spezial:FilePath/A3_ÜAufg_Valenzstrich_ML.pdf| Lösungen]] | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 133: | Zeile 239: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||