|
|
| Zeile 25: |
Zeile 25: |
| }} | | }} |
|
| |
|
| === Distanzunterricht Montag, 01.02.=== | | === Distanzunterricht Mittwoch, 03.02.=== |
| Ihr benötigt euer Buch auf der S. 42. Geht zum Lösen der Aufgabe systematisch vor, wie wir es in den letzten Einheiten immer geübt haben:
| | In der folgenden Einheit geht es um die Frage, ob man generell alle Alkohole oxidieren kann. Schaut zunächst das Video (ca. 19min.) und bearbeitet dann die folgenden Aufgaben! |
| * Überlegt zunächst welche Größe '''gesucht '''ist!
| | |
| * Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. N<sub>A</sub> immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u m<sub>a</sub>(X) sich jederzeit aus dem Periodensystem "ablesen" lassen)
| |
| * Wenn ihr eine '''passende Gleichung''' gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um!
| |
| * Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich '''über die chemische Gleichung''' das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B).
| |
| * Klickt erst auf "Lösung, wenn ihr tatsächlich den Tipp umgesetzt habt und etwas auf dem Papier stehen habt"
| |
| <br>
| |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Tipps zur Lösung'''</span> | | |Titel=<span style="color:#607">'''Oxidation verschiedener Alkoholtypen'''</span> |
| |Inhalt= | | |Inhalt= |
| '''Aufgabe 2:'''<br>
| | {{#ev:youtube|NYtXRS1S8i4}}<br> |
| <br> | | <br> |
| '''Tipp 1:''' Legt fest, welche Größe gesucht ist, welche Größen euch gegeben sind, und stellt die chemische Gleichung auf! | | Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgaben: <br> |
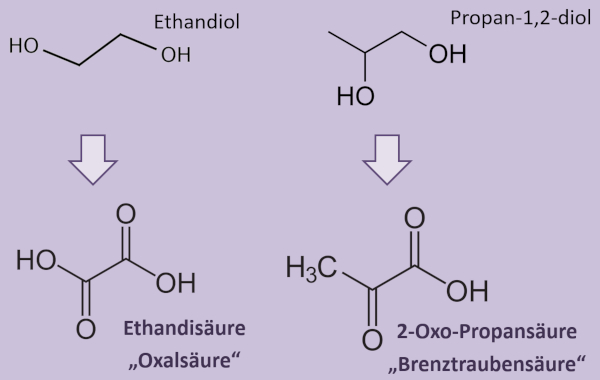
| | * Buch, S. 87 Aufgabe 2: Es sind die Alkohole '''Ethandiol''' und '''Propan-1,2-diol''' gegeben. Beide sollen getrennt voneinander mit saurer Permanganatlösung oxidiert werden. Gesucht sind die Strukturformelen der entstehenden Produkte! (Nicht mehr! - Keine Gleichungen o.ä.) |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_chemR_A422_ML_S1.jpg]]<br> | | [[Datei:C10NTG_S87A2_ML.jpg]] |
| |Lösung|Lösung ausblenden}}<br> | | |Lösung|Lösung ausblenden}}<br> |
| <br>'''Tipp 2:''' Findet eine Gleichung, in der die gesuchte Größe vorkommt und löst sie nach dieser Größe auf! Ihr solltet erkennen, dass in dieser Gleichung eine weitere Größe auftaucht, die nicht gegeben ist. Findet auch für diese Größe eine Gleichung und löst sie entsprechend auf!
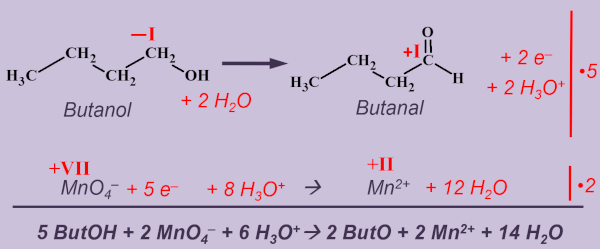
| | * Formuliert sowohl die Teilgleichungen als auch die Gesamtgleichung für die Redoxreaktion von Butan-1-ol zu Butanal mit saurer Permanganatlösung. (Aufgabe steht auch unter dem Hefteintrag) |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_chemR_A422_ML_S2.jpg]] | | [[Datei:C10NTG_Redox_Butanol_al_MnO4_sauer.jpg]] |
| |Lösung|Lösung ausblenden}}<br> | | |Lösung|Lösung ausblenden}}<br> |
| <br>'''Tipp 3:''' Ein letztes Problem muss noch gelöst werden. Ihr könntet jetzt schon die Stoffmenge von Aluminium n(Al) ausrechnen, ihr braucht aber die Stoffmenge von n(O<sub>2</sub>). Den Zusammenhang zwischen diesen beiden Größen leitet man aus der chemischen Gleichung ab. Bisher war das immer '''sehr einfach''', bei dieser Gleichung ist es nur '''einfach''': Es funktioniert über '''die Verwendung eines Bruchs'''. Beispiel: Wenn ihr 1000 Kirschen erntet, dann braucht ihr noch 3 Zitronen und daraus kann Oma dann 9 Gläser Kirschmarmelade machen. Daraus lassen sich folgende Verhältnisse ableiten:<br>
| | * Ladet euch jetzt den Hefteintrag herunter : [[Spezial:FilePath/Kunststoffe_Alternativen_AA_Tab.pdf| pdf-Datei]]<br> |
| [[Datei:C9NTG_chemR_A422_ML_S3z.jpg]]<br> | | |
| Findet nach genau dem selben Muster nun anhand der chemischen Gleichung einen Zusammenhang zwischen n(Al) und n(O<sub>2</sub>)!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A422_ML_S3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br> | |
| <br>
| |
| <br>'''Tipp 4:''' Man kann nun die Stoffmenge von Aluminium ausrechnen ('''2. Gleichung'''), dann in die '''3. Gleichung''' einsetzen, um n(O<sub>2</sub>) auszurechnen und dieses Ergebnis schließlich in '''Gleichung 1''' einsetzen. Voilà! (wie der Franzose sagt... Habt ihr Französisch? - Ich nicht.)
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A422_ML_S4.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Aufgabe 3:'''<br>
| |
| <br>
| |
| '''Tipp 1:''' Legt fest, welche Größe gesucht ist, welche Größen euch gegeben sind, und stellt die chemische Gleichung auf!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S1.jpg]]<br>
| |
| Es sind hier zwei Größen verlangt, also auch zwei Rechnungen. Beginnt zunächst mit der Berechnung von m(NaCl)
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Ihr benötigt wieder eine Gleichung, in der die gesuchte Größe steckt und alle anderen gegeben oder berechenbar sind. Beachtet: Auch wenn die Stoffmenge von dem gesuchten Stoff nicht gegeben ist, kann man über das Stoffmengenverhältnis der chemischen Gleichung immer eine Beziehung herstellen!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 3:''' Eigentlich habt ihr alles, was ihr braucht! Berechnet zunächst n(Na). Über das Stoffmengenverhältnis gelangt ihr zu n(NaCl) und über die erste Gleichung zur gesuchten Masse m(NaCl)<br>
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| <br>'''Tipp 4:''' Zur zweiten gesuchten Größe: Findet eine Formel, in der die gesuchte Größe vorkommt und alle anderen Größen gegeben sind. Beachtet, dass ihr bei den vorangegangenen Rechnungen eine wichtige Größe bereits berechnet habt. Die dürft ihr jetzt natürlich verwenden und müsst sie nicht neu ausrechnen!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S4.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Aufgabe 9:'''<br>
| |
| <br>
| |
| '''Tipp 1:''' Diesmal etwas weniger kleinschrittig: Gesuchte Größe? Gegebene Größen? Chemische Gleichung? Gleichungen?
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A429_ML_S1.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Ausrechnen, Einsetzen, Einsetzen, Ausrechnen!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A429_ML_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| Ich hoffe, die Tipps haben geholfen, die Aufgaben zu lösen. Macht jetzt die '''Aufgabe 6''' ohne Tipps (einer vielleicht: Eisen(III)-chlorid hat die chemische Formel FeCl<sub>3</sub>). - Eure Lösung müsst ihr morgen (Dienstag, 02.02.) einem Partner schicken und korrigieren lassen (ähnlich wie letzte Woche). Eine Musterlösung dazu wird morgen hier erscheinen. Ihr selbst müsst dann wieder die Korrektur überprüfen und von der doppelt korrigierten Version schickt ihr mir ein Foto oder eine pdf-Datei.
| |
|
| |
|
| |Farbe= #607 | | |Farbe= #607 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DCF'''Fett''' |
| |Hintergrund= #DCF | | |Hintergrund= #DCF |
| }} | | }} |