Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(richtige Bild-Links erzeugt) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
== Arbeitsauftrag Chemie für den 25.05. == | ==Arbeitsauftrag Chemie für den 25.05.== | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 7: | Zeile 7: | ||
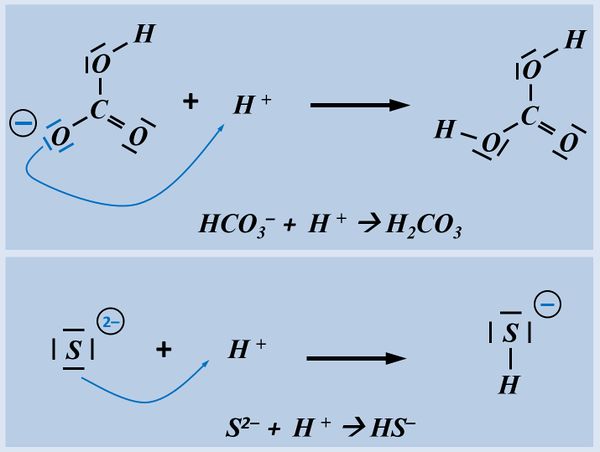
Zur Vereinfachung ist es aber tatsächlich üblich, beide Teilreaktionen getrennt voneinander zu betrachten, mit Elektronen die bei der Oxidation "herauskommen" und Elektronen, die bei der Reduktion "irgendwoher" aufgenommen werden.<br> | Zur Vereinfachung ist es aber tatsächlich üblich, beide Teilreaktionen getrennt voneinander zu betrachten, mit Elektronen die bei der Oxidation "herauskommen" und Elektronen, die bei der Reduktion "irgendwoher" aufgenommen werden.<br> | ||
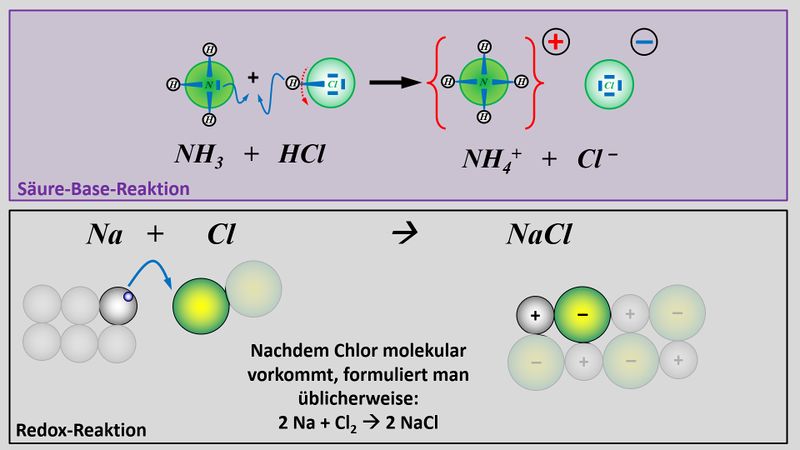
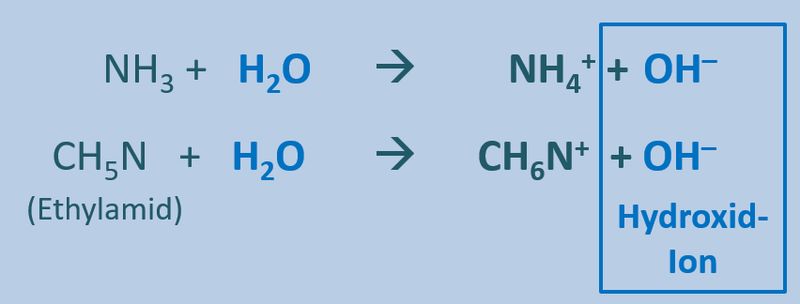
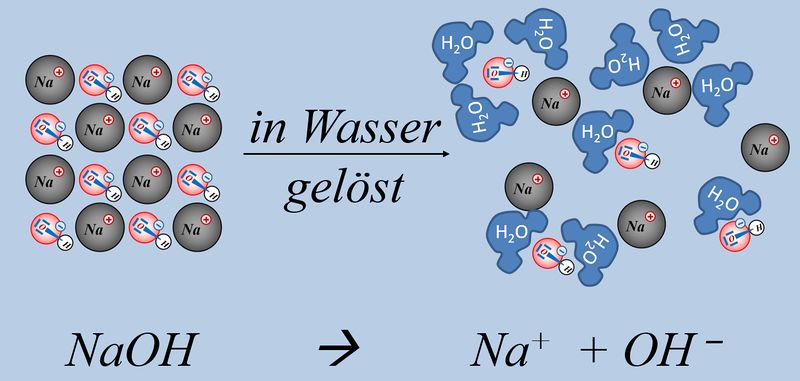
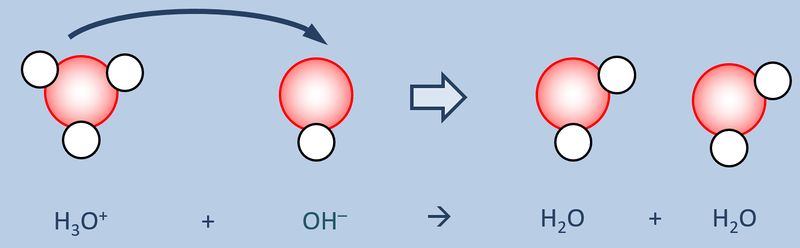
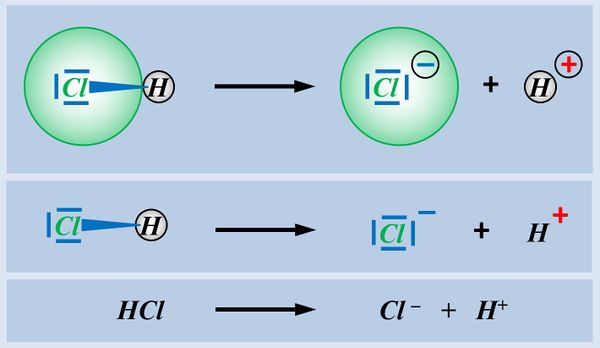
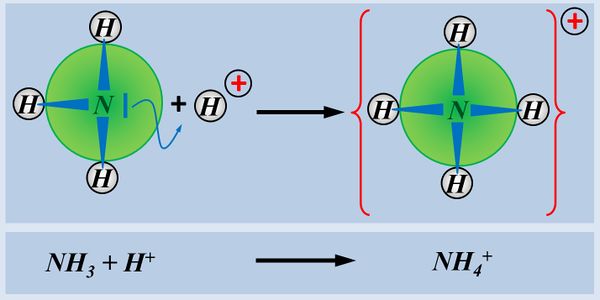
Zum Vergleich hier noch einmal eine Säure-Base-Reaktion und eine Redoxreaktion in bildlicher Darstellung:<br> | Zum Vergleich hier noch einmal eine Säure-Base-Reaktion und eine Redoxreaktion in bildlicher Darstellung:<br> | ||
[[Datei: | [[Datei:Redox1_VGL_SäBa_Redox.jpg|800px]]<br> | ||
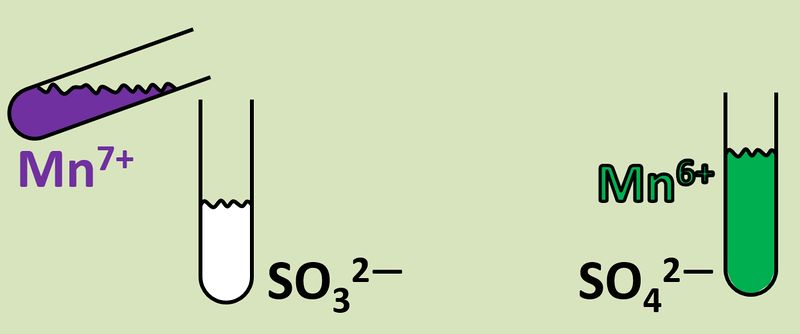
Im oberen Beispiel ist bei der Bildung von Natriumchlorid sehr einfach zu erkennen, wer die Elektronen abgibt (das Na-Atom) und wer sie aufnimmt (das Cl-Atom). Im folgenden Beispiel ist das nicht so einfach: Eine violette Permanganat-Lsg. (die vereinfacht Mn<sup>7+</sup>-Ionen enthält), die man in eine bestimmte Sulfit-Lsg. tropft, färbt sich grün (was auf Mn<sup>6+</sup>-Ionen zurückzuführen ist). Gleichzeitig tauchen im Reagenzglas Sulfat-Ionen auf: <br> | Im oberen Beispiel ist bei der Bildung von Natriumchlorid sehr einfach zu erkennen, wer die Elektronen abgibt (das Na-Atom) und wer sie aufnimmt (das Cl-Atom). Im folgenden Beispiel ist das nicht so einfach: Eine violette Permanganat-Lsg. (die vereinfacht Mn<sup>7+</sup>-Ionen enthält), die man in eine bestimmte Sulfit-Lsg. tropft, färbt sich grün (was auf Mn<sup>6+</sup>-Ionen zurückzuführen ist). Gleichzeitig tauchen im Reagenzglas Sulfat-Ionen auf: <br> | ||
[[Datei: | [[Datei:Redox1_VMn7zuMn6.jpg|800px]]<br> | ||
Dass die Mn<sup>7+</sup>-Ionen offensichtlich ein Elektron aufgenommen haben (also eine Reduktion vorliegt), ist leicht an der Ladung zu erkennen. Aber woher kommt dieses Elektronen?<br> | Dass die Mn<sup>7+</sup>-Ionen offensichtlich ein Elektron aufgenommen haben (also eine Reduktion vorliegt), ist leicht an der Ladung zu erkennen. Aber woher kommt dieses Elektronen?<br> | ||
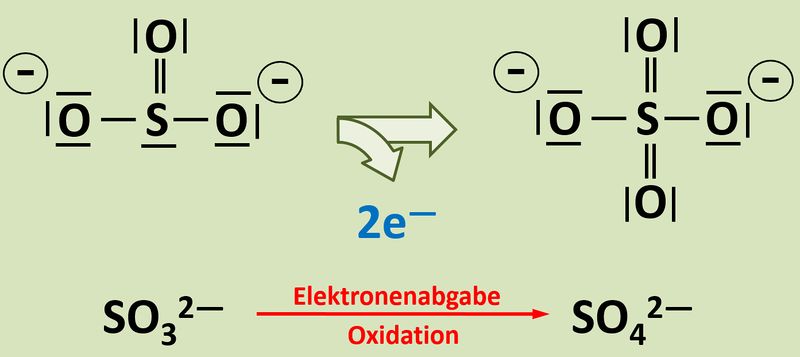
Zunächst einmal: In dem dargestellten Versuch sind noch eine Reihe weiterer Teilchen beteiligt, aber die spielen hier keine Rolle. Das Elektron stammt tatsächlich aus der Reaktion vom Sulfit zum Sulfat. <br> | Zunächst einmal: In dem dargestellten Versuch sind noch eine Reihe weiterer Teilchen beteiligt, aber die spielen hier keine Rolle. Das Elektron stammt tatsächlich aus der Reaktion vom Sulfit zum Sulfat. <br> | ||
[[Datei: | [[Datei:Redox1_So3zuSo4_Blanc.jpg|800px]]<br> | ||
Woher soll man erkennen, dass diese Reaktion Elektronen liefert, also eine Oxidation stattfindet?<br> | Woher soll man erkennen, dass diese Reaktion Elektronen liefert, also eine Oxidation stattfindet?<br> | ||
Der Trick besteht nun darin auch Moleküle formal (also "nicht in echt") in Ionen zu zerlegen. Denn bei Ionen zeigt eine sich verändernde Ladung sehr klar an, ob Elektronen aufgenommen oder abgegeben wurden.<br> | Der Trick besteht nun darin auch Moleküle formal (also "nicht in echt") in Ionen zu zerlegen. Denn bei Ionen zeigt eine sich verändernde Ladung sehr klar an, ob Elektronen aufgenommen oder abgegeben wurden.<br> | ||
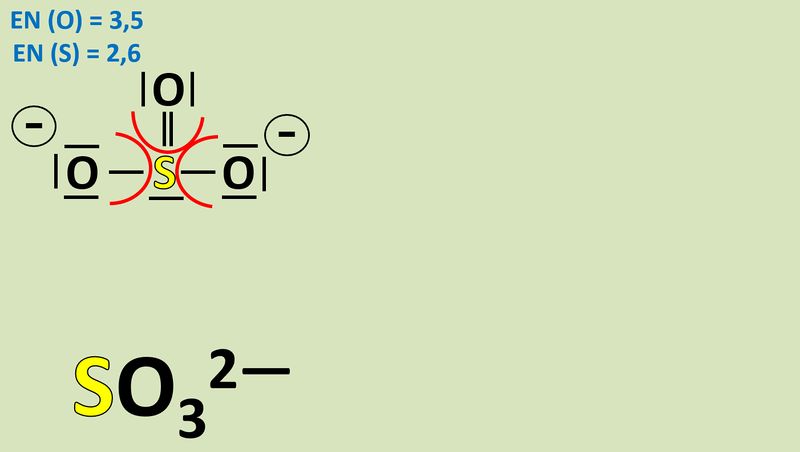
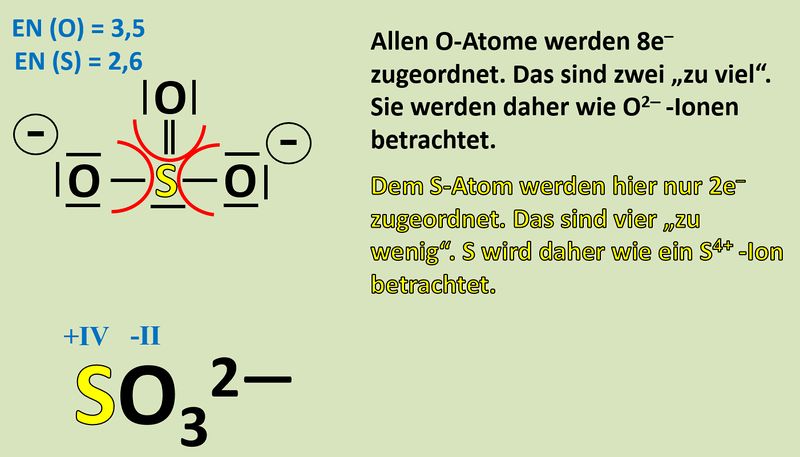
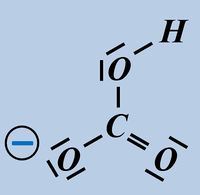
Um diese Zerlegung vorzunehmen, betrachtet man alle bindenden Elektronenpaare in einem Molekül und teilt sie formal demjenigen Bindungspartner zu, der die höhere Elektonegativität (EN) hat. Nur bei exakt gleichen Partnern bekommt jeder ein Elektron des Paares zugeordnet. Bsp.: Sulfit-Ion<br> | Um diese Zerlegung vorzunehmen, betrachtet man alle bindenden Elektronenpaare in einem Molekül und teilt sie formal demjenigen Bindungspartner zu, der die höhere Elektonegativität (EN) hat. Nur bei exakt gleichen Partnern bekommt jeder ein Elektron des Paares zugeordnet. Bsp.: Sulfit-Ion<br> | ||
[[Datei: | [[Datei:Redox1_Sulfit_OZbestimmen_1.jpg|800px]]<br> | ||
Nun zählt man die Elektronen, die jedem Atom auf diese Weise zugeordnet wurden und vergleicht diese Anzahl mit der Anzahl an Valenzelektronen, die dieses Atom laut PSE haben sollte. Liegen mehr Elektronen vor als "normal" entspricht die überschüssige Anzahl einer negativen Ladung, liegen weniger Elektronen vor, entspricht die fehlende Anzahl einer positiven Ladung. Man spricht allerdings nicht von einer "Ladung", sondern von der Oxidationszahl, die in der Schule üblicherweise als römische Ziffer angegeben wird (mit dem entsprechenden Vorzeichen). Bsp.: Sulfit-Ion<br> | Nun zählt man die Elektronen, die jedem Atom auf diese Weise zugeordnet wurden und vergleicht diese Anzahl mit der Anzahl an Valenzelektronen, die dieses Atom laut PSE haben sollte. Liegen mehr Elektronen vor als "normal" entspricht die überschüssige Anzahl einer negativen Ladung, liegen weniger Elektronen vor, entspricht die fehlende Anzahl einer positiven Ladung. Man spricht allerdings nicht von einer "Ladung", sondern von der Oxidationszahl, die in der Schule üblicherweise als römische Ziffer angegeben wird (mit dem entsprechenden Vorzeichen). Bsp.: Sulfit-Ion<br> | ||
[[Datei: | [[Datei:Redox1_Sulfit_OZbestimmen_2.jpg|800px]]<br> | ||
<br> | <br> | ||
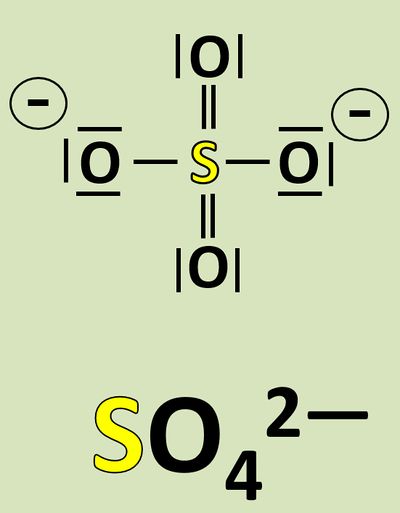
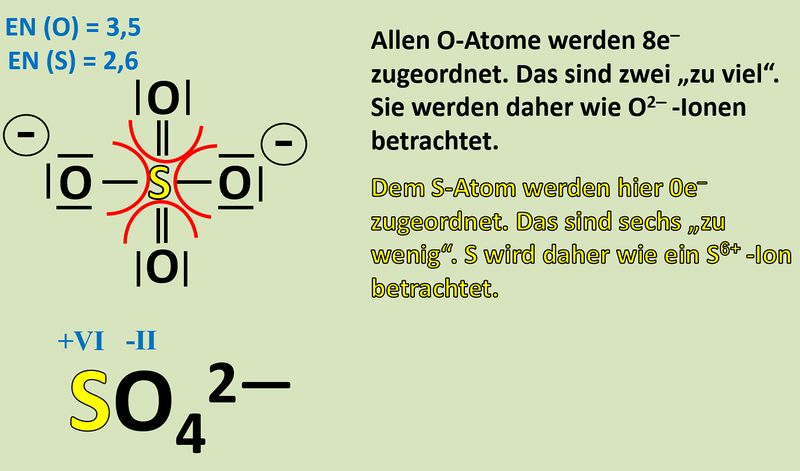
Wendet dieses Verfahren auf das Sulfat-Teilchen an:<br> | Wendet dieses Verfahren auf das Sulfat-Teilchen an:<br> | ||
[[Datei: | [[Datei:Redox1_Sulfat_OZbestimmen_0.jpg|400px]]<br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
| Zeile 30: | Zeile 30: | ||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Redox1_Sulfat_OZbestimmen.jpg|800px]]<br> | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
| Zeile 37: | Zeile 37: | ||
Sehr gute Frage! - Das ist aber eine andere Baustelle. Wir bleiben heute nur bei dem Problem: Woran erkennt man, wie viele Elektronen bei der Reaktion von Molekülen frei werden (Oxidation) oder aufgenommen werden (Reduktion).<br> | Sehr gute Frage! - Das ist aber eine andere Baustelle. Wir bleiben heute nur bei dem Problem: Woran erkennt man, wie viele Elektronen bei der Reaktion von Molekülen frei werden (Oxidation) oder aufgenommen werden (Reduktion).<br> | ||
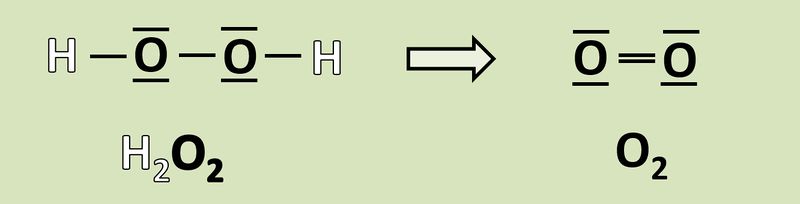
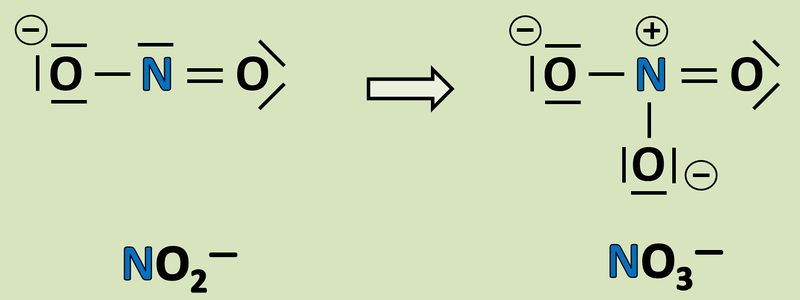
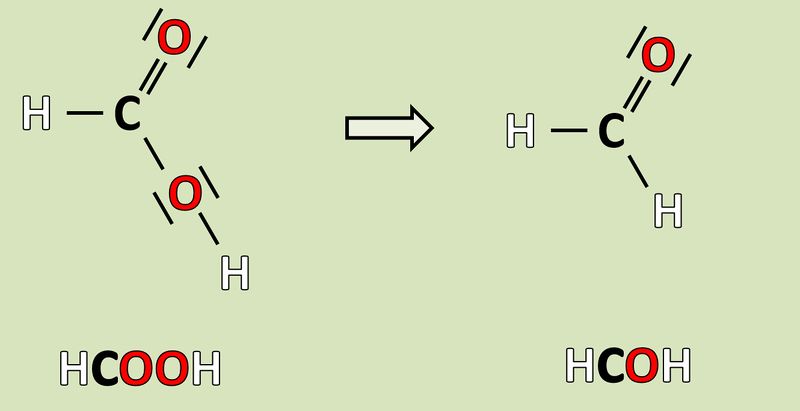
Wendet das heute gelernte Verfahren auf folgende Reaktion an und gebt an, wie viele Elektronen hier frei werden oder aufgenommen werden! <br> | Wendet das heute gelernte Verfahren auf folgende Reaktion an und gebt an, wie viele Elektronen hier frei werden oder aufgenommen werden! <br> | ||
[[Datei: | [[Datei:Redox1_AA1_H2O2_O2.jpg|800px]]<br> | ||
[[Datei:Redox1_AA1_NO2_NO3.jpg|800px]]<br> | |||
[[Datei:Redox1_AA1_HCOOH_HCOH.jpg|800px]]<br> | |||
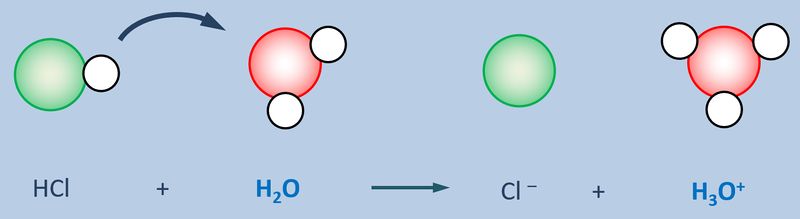
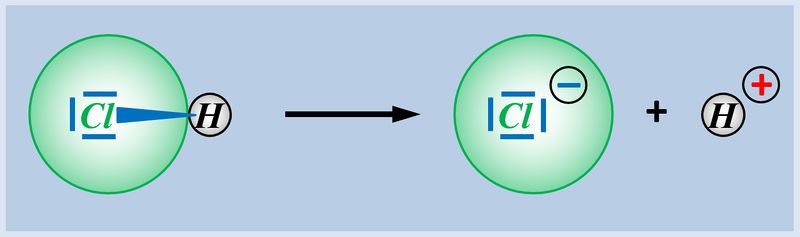
{{Lösung versteckt| | {{Lösung versteckt| | ||
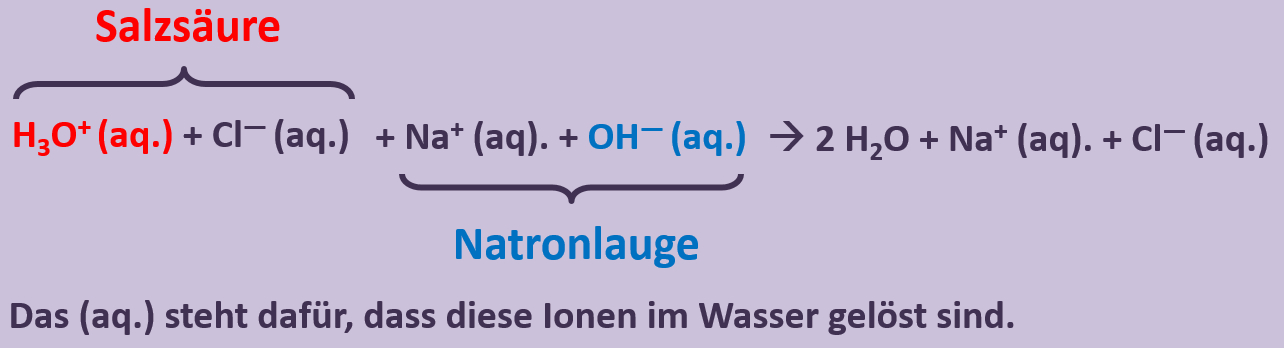
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | [[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | ||
| Zeile 60: | Zeile 63: | ||
}} | }} | ||
== Arbeitsauftrag Chemie für den 11.05. == | ==Arbeitsauftrag Chemie für den 11.05.== | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 178: | Zeile 181: | ||
|Hintergrund= #DFB | |Hintergrund= #DFB | ||
}} | }} | ||
== Arbeitsauftrag Bio9 == | ==Arbeitsauftrag Bio9== | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 260: | Zeile 263: | ||
<br> | <br> | ||
== Musterlösung == | ==Musterlösung== | ||
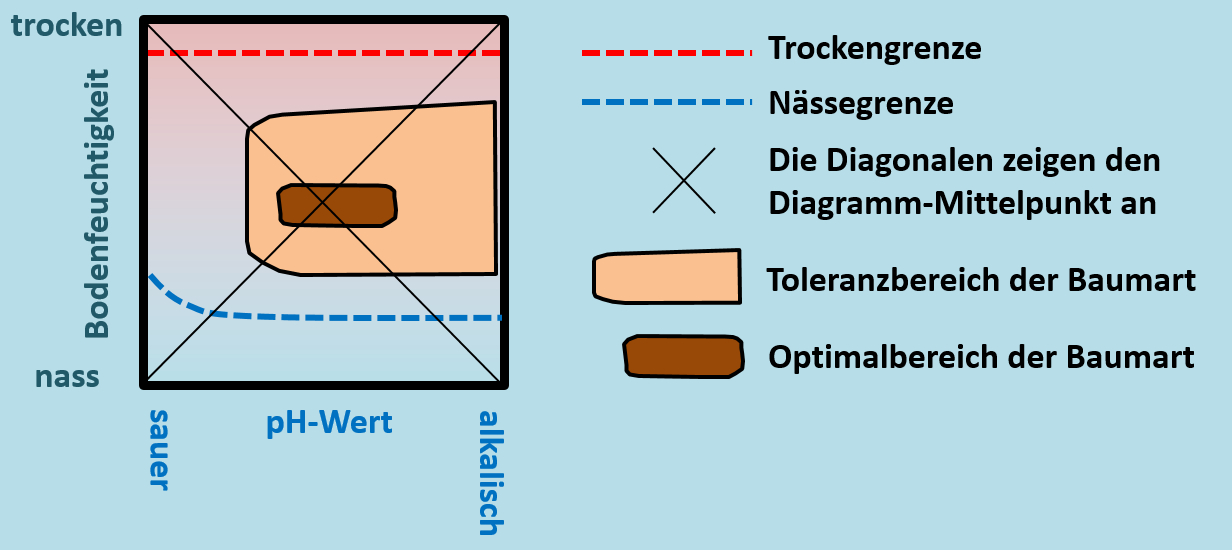
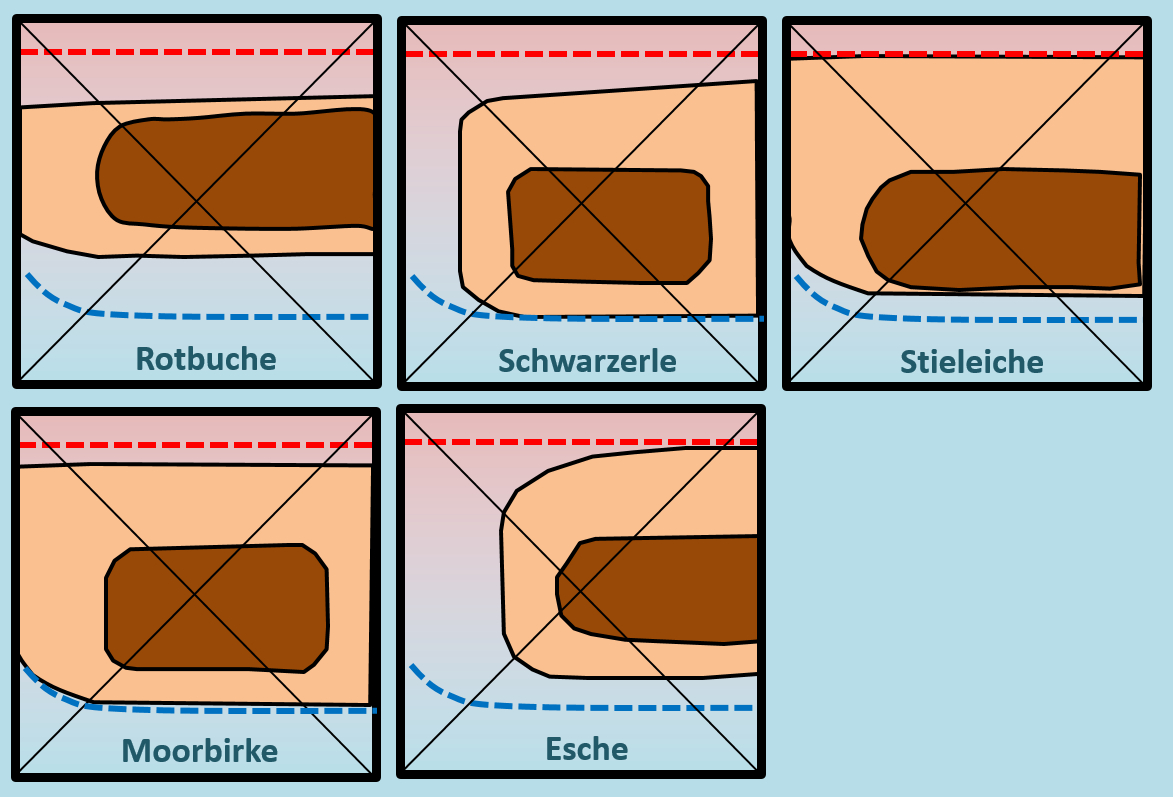
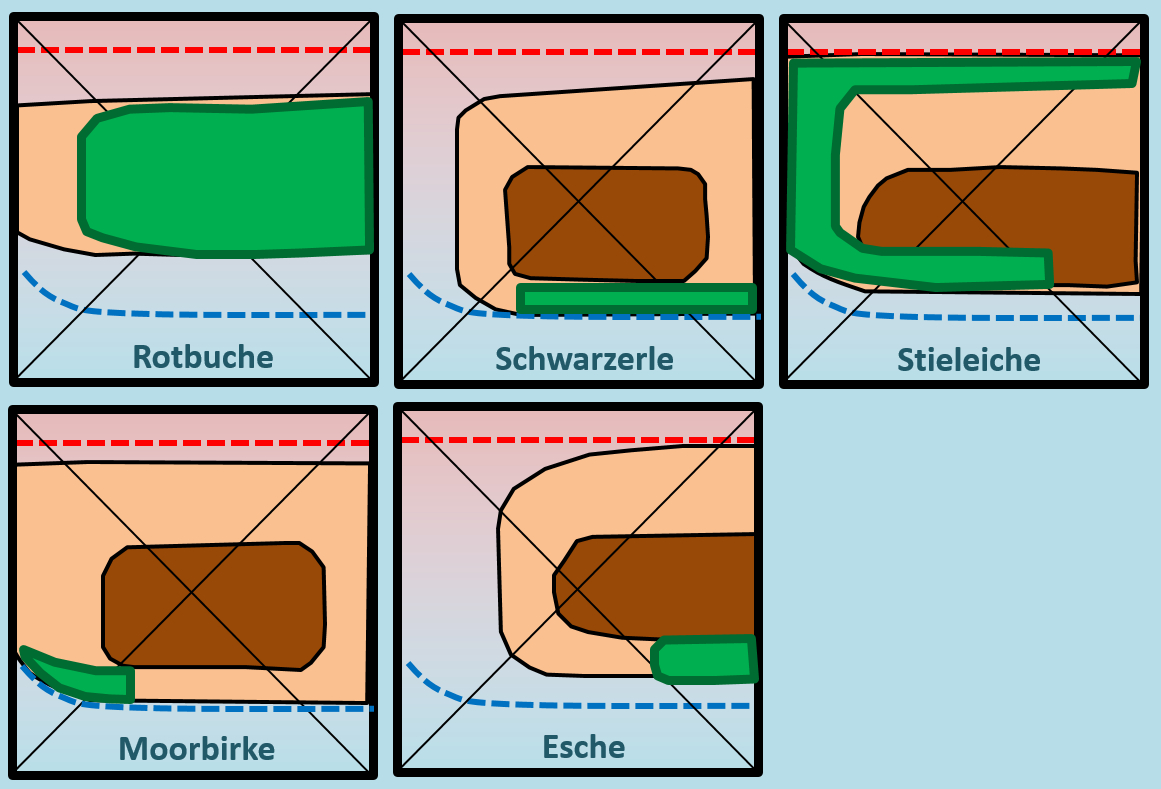
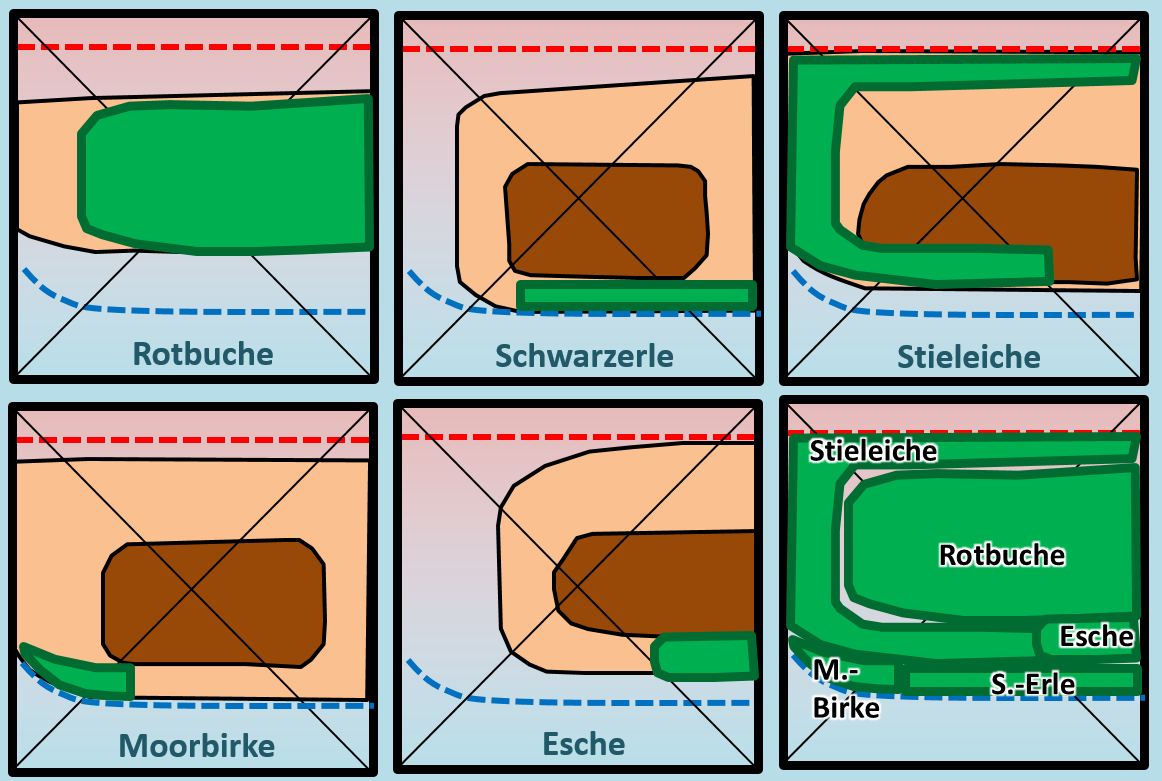
[[Datei:ÖkoNische2_Baumdiagramm_HA_ML.jpg]]<br> | [[Datei:ÖkoNische2_Baumdiagramm_HA_ML.jpg]]<br> | ||
== Arbeitsauftrag Chemie11 == | ==Arbeitsauftrag Chemie11== | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 295: | Zeile 298: | ||
== Arbeitsauftrag Chemie (EK) für den 04.05. == | ==Arbeitsauftrag Chemie (EK) für den 04.05.== | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 422: | Zeile 425: | ||
<br> | <br> | ||
== Startseiten-Struktur-Test == | ==Startseiten-Struktur-Test== | ||
<div class="grid"> | <div class="grid"> | ||
| Zeile 616: | Zeile 619: | ||
</div> | </div> | ||
== Verschachtelte Verstecke? == | ==Verschachtelte Verstecke?== | ||
{{Box-spezial | {{Box-spezial | ||