Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(AA f 25.05. angefangen) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
== Arbeitsauftrag Chemie für den 25.05. == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Redox-Reaktionen'''</span> | |||
|Inhalt= | |||
In der letzten Einheit habt ihr einen typischen Reaktionstyp kennengelernt: Die Säure-Base-Reaktion. Dabei wird ein Proton von einem Teilchen auf ein anderes übertragen. Heute soll es um einen Reaktionstyp gehen, bei dem Elektronen von einem Teilchen auf ein anderes übertragen werden. Ihr kennt solche Reaktionen bereits von der Bildung von Salzen aus den Elementen. Dabei gibt ein Teilchen Elektronen ab. Diese Teilreaktion wird als Oxidation bezeichnet. Das andere Teilchen nimmt die Elektronen auf. Diese Teilreaktion wird als Reduktion bezeichnet. Beide Teilreaktionen können ähnlich wie bei Säure-Base-Reaktionen nur gemeinsam ablaufen. Die Elektronen können nicht irgendwo hin ins Nirvana abgegeben werden oder irgendwoher "aus der Luft" aufgenommen werden. Beide Teilreaktionen zusammen werden als Redox-Reaktion bezeichnet. <br> | |||
Zur Vereinfachung ist es aber tatsächlich üblich, beide Teilreaktionen getrennt voneinander zu betrachten, mit Elektronen die bei der Oxidation "herauskommen" und Elektronen, die bei der Reduktion "irgendwoher" aufgenommen werden.<br> | |||
Zum Vergleich hier noch einmal eine Säure-Base-Reaktion und eine Redoxreaktion in bildlicher Darstellung:<br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
Im oberen Beispiel ist bei der Bildung von Natriumchlorid sehr einfach zu erkennen, wer die Elektronen abgibt (das Na-Atom) und wer sie aufnimmt (das Cl-Atom). Im folgenden Beispiel ist das nicht so einfach: Eine violette Permanganat-Lsg. (die vereinfacht Mn<sup>7+</sup>-Ionen enthält), die man in eine bestimmte Sulfit-Lsg. tropft, färbt sich grün (was auf Mn<sup>6+</sup>-Ionen zurückzuführen ist). Gleichzeitig tauchen im Reagenzglas Sulfat-Ionen auf: <br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
Dass die Mn<sup>7+</sup>-Ionen offensichtlich ein Elektron aufgenommen haben (also eine Reduktion vorliegt), ist leicht an der Ladung zu erkennen. Aber woher kommt dieses Elektronen?<br> | |||
Zunächst einmal: In dem dargestellten Versuch sind noch eine Reihe weiterer Teilchen beteiligt, aber die spielen hier keine Rolle. Das Elektron stammt tatsächlich aus der Reaktion vom Sulfit zum Sulfat. <br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
Wie soll man erkennen, dass diese Reaktion Elektronen liefert, also eine Oxidation stattfindet?<br> | |||
Der Trick besteht nun darin auch Moleküle formal (also "nicht in echt") in Ionen zu zerlegen. Denn bei Ionen zeigt eine sich verändernde Ladung sehr klar an, ob Elektronen aufgenommen oder abgegeben wurden.<br> | |||
Um diese Zerlegung vorzunehmen, betrachtet man alle bindenden Elektronenpaare in einem Molekül und teilt sie formal demjenigen Bindungspartner zu, der die höhere Elektonegativität (EN) hat. Nur bei exakt gleichen Partnern bekommt jeder ein Elektron des Paares zugeordnet. Bsp.: Sulfit-Ion<br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
Nun zählt man die Elektronen, die jedem Atom auf diese Weise zugeordnet wurden und vergleicht diese Anzahl mit der Anzahl an Valenzelektronen, die dieses Atom laut PSE haben sollte. Liegen mehr Elektronen vor als "normal" entspricht die überschüssige Anzahl einer negativen Ladung, liegen weniger Elektronen vor, entspricht die fehlende Anzahl einer positiven Ladung. Man spricht allerdings nicht von einer "Ladung", sondern von der Oxidationszahl, die in der Schule üblicherweise als römische Ziffer angegeben wird (mit dem entsprechenden Vorzeichen). Bsp.: Sulfit-Ion<br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
* Bei der Salzbildung aus '''Metall und Nichtmetall''' gibt das Metall '''Elektronen '''ab, das Nichtmetall nimmt Elektronen auf. | |||
* Bei der Salzbildung aus '''Säure und Base''' gibt die Säure ein '''Proton '''ab, die Base nimmt ein Proton auf. | |||
* Gemeinsamkeit: In beiden Fällen entstehen unterschiedlich geladene Ionen, die das Salz bilden. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Die direkte Reaktion einer Säure mit einer Base betrachtet man an dieser Stelle im Unterricht eher selten. Einfach deswegen, weil viele Säure-Base-Reaktionen im Wasser ablaufen. Und Wasser hat ein besondere Eigenschaft. <br> | |||
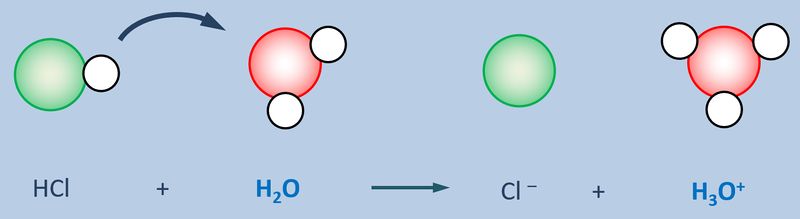
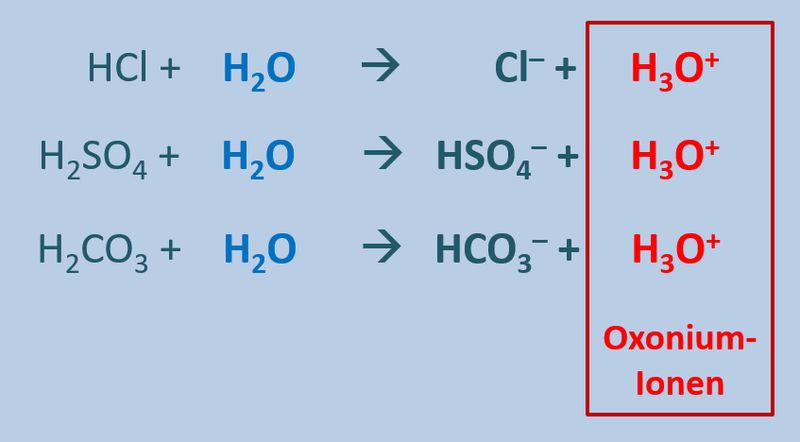
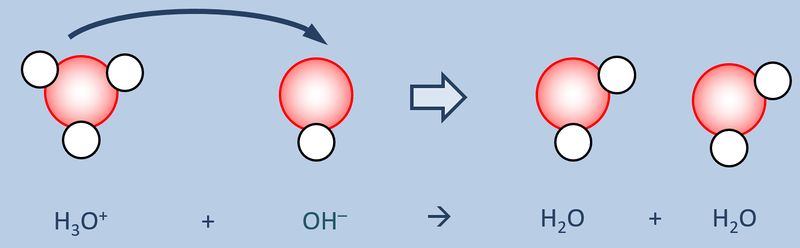
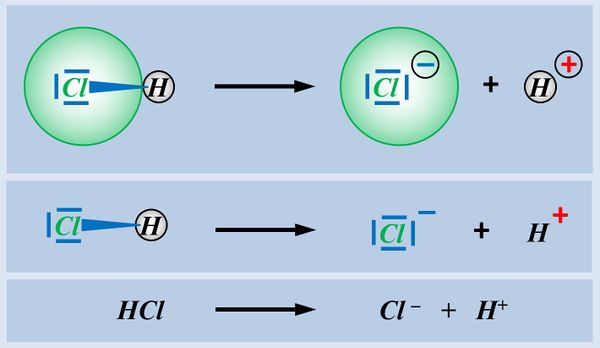
Betrachtet zunächst die hier stark vereinfacht dargestellte Reaktion, die beim Einleiten von HCl-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Ein HCl-Molekül gibt ein Proton an ein Wassermolekül ab. Es entsteht ein Chlorid-Ion und ein Oxonium-Ion (den Namen wusstet ihr wahrscheinlich noch nicht, auch "H<sub>3</sub>O<sup>+</sup>-Teilchen" wäre o.k. gewesen. | |||
|Lösung|Lösung ausblenden}} | |||
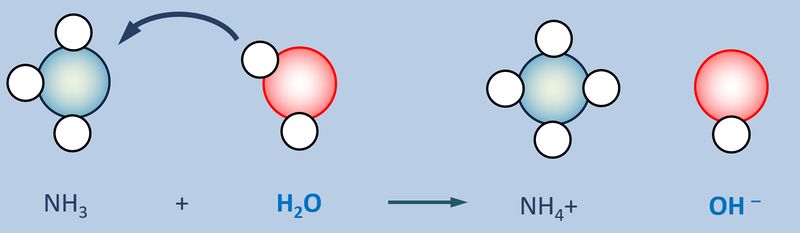
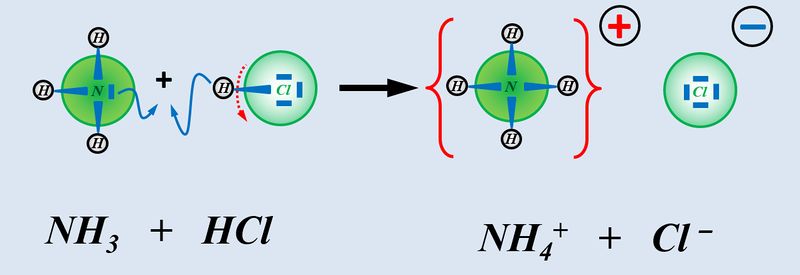
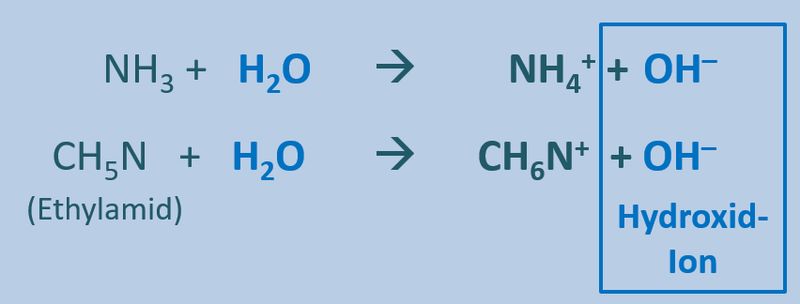
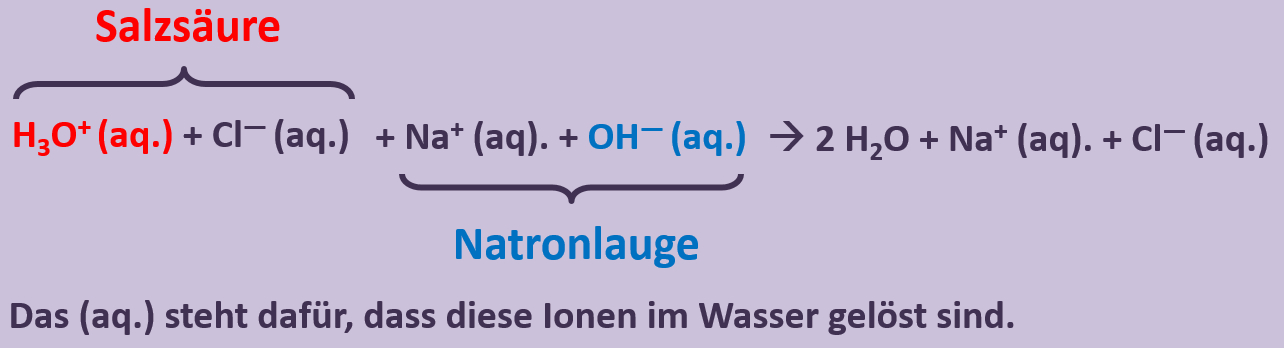
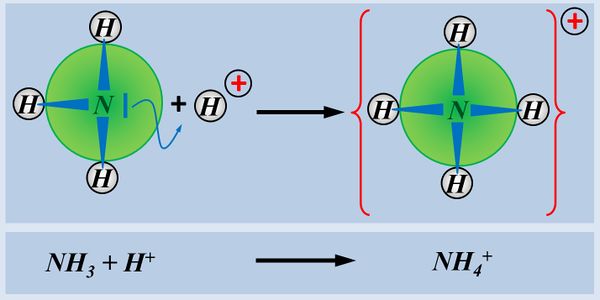
Betrachtet nun die stark vereinfacht dargestellte Reaktion, die beim Einleiten von NH<sub>3</sub>-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:SäBa3_NH3_und_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Ein Ammoniak-Molekül entreißt einem Wasser-Molekül ein Proton. Es entsteht ein Ammonium-Ion (NH<sub>4</sub><sup>+</sup>-Teilchen) und ein Hydroxid-Ion (OH<sup>-</sup>-Teilchen) | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Legt nun den Fokus eurer Betrachtung auf das Wassermolekül. Zunächst zur oberen Gleichung: Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton aufgenommen. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Basen. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Jetzt zur unteren Gleichung: Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton abgegeben. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Säuren. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie für den 11.05. == | == Arbeitsauftrag Chemie für den 11.05. == | ||