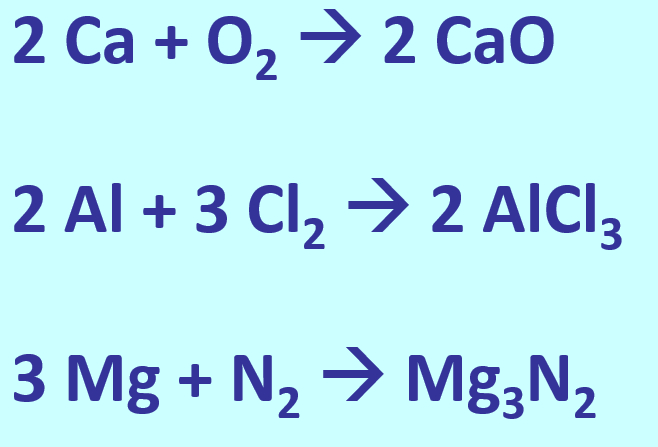Corona-Arbeitsaufträge (Chemie) LUX: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(Reihenfolge geändert: Aktuellste Einheit jetzt oben) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#900">'''geänderte Reihenfolge'''</span> | ||
|Inhalt= | |Inhalt= | ||
Die Reihenfolge der Arbeitsaufträge auf dieser Seite wurde geändert. Die neuesten Arbeitsaufträge sind jetzt immer oben. | |||
|Farbe= #900 | |||
|Farbe= # | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #FCA | ||
|Hintergrund= # | |Hintergrund= #FCA | ||
}} | }} | ||
<br> | |||
== Arbeitsauftrag Chemie10 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Wiederholung'''</span> | ||
|Inhalt= | |Inhalt= | ||
In der letzten Einheit habt ihr die '''Metallbindung '''kennengelernt und ein Video geschaut. Zunächst zur Wiederholung: Beschreibt mit Worten, warum ein Metall bei Raumtemperatur in der Regel ein Feststoff ist, was die Metall-Atome also zusammenhält! | |||
* | |||
{{Lösung versteckt| | |||
In eurer Beschreibung sollten folgenden Fachbegriffe auftauchen: | |||
* dichteste Kugelpackung | |||
* positiv geladene Atomrümpfe | |||
* negativ geladenes Elektronengas | |||
Die Begriffe sollten in "schöne", zusammenhängende Sätze eingebettet sein. Vor allem sollte klar werden, dass die Anziehungskräfte der am aufbau beteiligten Teilchen durch die unterschiedlichen Ladungen zustande kommen. Und, dass diese starken Anziehungskräfte für den Aggregatszustand (fest) verantwortlich sind<br> | |||
Eine Möglichkeit, zu testen, ob eure Antwort gut war: Lest Sie z. B. euren Eltern vor. Wenn Sie euch sagen, dass es gut war, dann entweder weil es wirklich gut war, oder weil sie euch einfach lieb haben oder beides. (Ich gehe davon aus, dass euch eure Eltern immer lieb haben, aber das sollte nicht der Grund dafür sein, zu sagen, eure Antwort auf die Frage war gut.) Wenn ihr euch nicht sicher seid, schickt mir eure Lösung über den Schulmanager. Von mir bekommt ihr ein rein fachliches Feedback. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 43: | Zeile 32: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Zusammenhang zwischen Aufbau und Eigenschaften bei Metallen'''</span> | ||
|Inhalt= | |Inhalt= | ||
Im Video wurde bereits gezeigt, dass viele typischen Eigenschaften von Metallen (elektrische Leitfähigkeit, Wärmeleitfähigkeit, Verformbarkeit) mit dem Aufbau zusammenhängen. In eurem Buch sind diese Zusammenhänge etwas ausführlicher und relativ gut erklärt. Ihr habt zwei Möglichkeiten: | |||
* Lest im Buch S. 128 - 129 (Abs. 1, 2 u. 3) | |||
* Schaut noch einmal das Video (ich empfehle aber das Buch - im Video kommt dieser Aspekt etwas kurz) | |||
<br> | |||
Schließt jetzt das Buch und legt es weg! - Zeichnet dann aussagekräftige Skizzen, welche die folgenden Eigenschaften von Metallen gut verdeutlichen (möglichst kein Text, höchstens Beschriftungen)! | |||
* elektrische Leitfähigkeit | |||
* Wärmeleitfähigkeit | |||
* Verformbarkeit | |||
<br> | <br> | ||
Klickt bitte wirklich erst auf "Lösung" wenn ihr für jede Eigenschaft mindestens eine schöne Skizze habt! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Hast Du wirklich mind. 3 Skizzen vor Dir liegen??? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Met2_ZH_BauEigenschaft_MLSkizzen.jpg|600px]]<br> | |||
| | Deine Skizzen sollten auf keinen Fall "schlechter" sein, als die hier! Das ist die niedrigste Qualität, die ich erlaube :)<br> | ||
|Ja!|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
''' | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Versuch'''</span> | |||
|Inhalt= | |||
Ein freiwilliger Versuch. '''Ihr benötigt dazu:''' | |||
* heißes Wasser | |||
* einen Metall-Löffel | |||
* einen Holz- oder Plastiklöffel (es muss kein Löffel sein, irgendein länglicher Gegenstand ist o.k. er sollte nur ungefähr genauso groß wie der Metall-Löffel sein) | |||
<br> | <br> | ||
'''Durchführung''': | |||
* Bringt in einem kleinen Topf Wasser zum Kochen (solltet ihr das noch nie gemacht haben, fragt einen Erwachsenen, er euch hilft) | |||
* Wenn das Wasser kocht, reduziert die Hitze des Herdes stark. Das Wasser soll nicht stark sprudeln sondern nur leicht vor sich hin köcheln. | |||
* Nehmt den Metall-Löffel mit der rechte und den Plastik-/Holzlöffel mit der linken Hand gleichzeitig zwischen Daumen und Zeigefinger. | |||
* Taucht beide Löffel gleichzeitig in das heiße Wasser. Sobald ein Löffel zu heiß wird, lasst los! | |||
<br> | |||
Beschreibt das '''Ergebnis''' und liefert eine '''Erklärung'''. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Wenn ihr nicht zu den Menschen gehört, bei denen das Schmerz-Empfinden gestört ist, dann solltet ihr den Metall-Löffel deutlich früher losgelassen haben.<br> | |||
Begründung: Metalle sind sehr gute Wärmeleiter. Ein heißer Gegenstand auf Teilchen-Ebene betrachtet bedeutet nichts anderes als schnell hin und her schwingende Teilchen. Im Metall sind frei bewegliche Elektronen vorhanden, die sehr leicht Schwingnen aufnehmen und weitergeben können. Auch die positiv geladenen Atomrümpfe sind nicht sehr starr an ihren Platz gebunden und können gut schwingen.<br> | |||
Entlang des Metall-Löffels breitet sich die Hitze des kochenden Wassers also viel schneller aus, als im Holz oder Plastik. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
| | |Rahmenfarbe= #DCF | ||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Das war es für heute</span> | |||
|Inhalt= | |||
Am Mittwoch gibt es eine Zusammenfassung von allem, was wir in diesem Schuljahr gemacht haben. | |||
<br> | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
==Arbeitsauftrag Chemie9== | |||
{{ | {{Box-spezial | ||
|Titel=<span style="color:#070">'''Verbesserung der Hausaufgabe'''</span> | |||
| | |Inhalt= | ||
* Das einzige bei Raumtemperatur flüssige Metall ist Quecksilber (kann man aus dem PSE ablesen, wenn man die Schmelzpukte auf der Rückseite anschaut: -39°C) | |||
* Ein Metall, das in der Hand schmilzt: Gallium (Smp.: 30°C). Wer möchte, kann das folgende Video schauen, in dem ein Mann mit Gallium herumspielt (Achtung: Gallium ist giftig uns sollte nicht angefasst werden. Ich schätze aber, das man in Deutschland sowieso nicht so einfach an reines Gallium kommt) | |||
{{#ev:youtube|4u6A40QTWVI}} | |||
* Eine Legierung ist eine stabile "Mischung" verschiedener Metalle. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
{{ | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
Mir ist aufgefallen, dass der letzte Arbeitsauftrag tatsächlich etwas anspruchsvoll war! - Deswegen heute nur ein kurzes Video von Mai. Die macht das super :) <br> | |||
* Einfach anschauen! | |||
* Wer beim letzten Arbeitsauftrag Schwierigkeiten hatte, nach dem Video einfach noch mal probieren! | |||
{{#ev:youtube|0bvldHVL_TU}} | |||
{{ | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 144: | Zeile 144: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''Das war es schon für heute'''</span> | |||
|Inhalt= | |||
Schönen 1. Mai! - Bis nächste Woche :) | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie8 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Ergebnisse der Hausaufgabe'''</span> | ||
|Inhalt= | |Inhalt= | ||
[[Datei:Met1_Kollage_MetalleImHaushalt.jpg]] | |||
<span style="color:# | Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner. <br> | ||
Ihr solltet euch zusätzlich zu den Bildern auch Gedanken dazu machen, warum manche Gegenstände aus Metall sind und kein anderes Material zur Herstellung verwendet wurde. Eine Eigenschaft wurde sehr häufig hervorgehoben, auch wenn ihr es teilweise unterschiedlich ausgedrückt habt: Die '''"Stabilität"''' von Metallen. In dieser und der nächsten Einheit, möchte ich mit euch versuchen zu klären, woher diese "Stabilität" kommt.<br> | |||
<span style="color:#60F">Achtung: "Stabilität" steht im Moment noch in Anführungszeichen, weil dieser Begriff eigentlich ziemlich ungenau ist: Wenn ihr einen Eisennagel und ein Stück Plastik im Garten vergrabt, werdet ihr nach einem Jahr den Nagel ziemlich verrostet wiederfinden, während das Stück Plastik sich kaum verändert hat. '''Chemisch''' betrachtet sind viele Metalle nämlich überhaupt nicht "stabil".</span> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
''' | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
Das, was wir gerade besprechen, ist übrigens ein Haupt-Anliegen der Wissenschaft "Chemie": Sie versucht Zusammenhänge herzustellen zwischen dem '''Aufbau von Stoffen''' und den '''Eigenschaften''', die diese Stoffe haben.<br> | |||
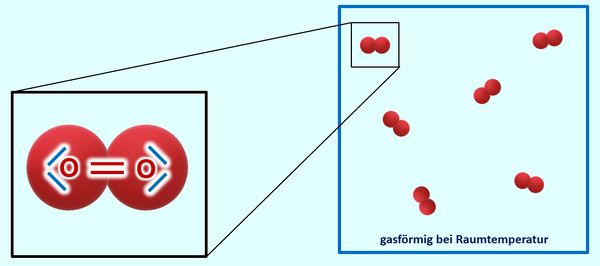
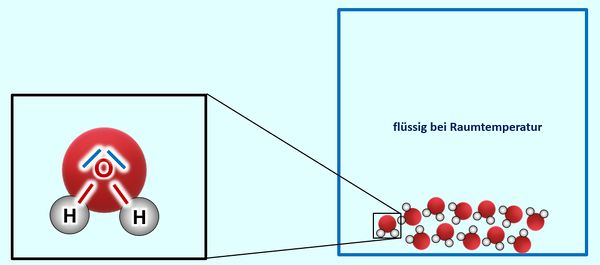
Einen solchen wichtigen Zusammenhang habt ihr nun schon oft gehört und in der letzten Einheit vor den Osterferien noch einmal intensiv besprochen: Es gibt einen Zusammenhang zwischen dem Aggregatszustand eines Stoffes (bei Raumtemperatur) und den Anziehungskräften der im Stoff enthaltenen Teilchen. Die Anziehungskräfte wiederum hängen eng mit dem Aufbau der Teilchen zusammen.<br> | |||
Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest die kleinen, wie z.B. O<sub>2</sub>, gasförmig) | |||
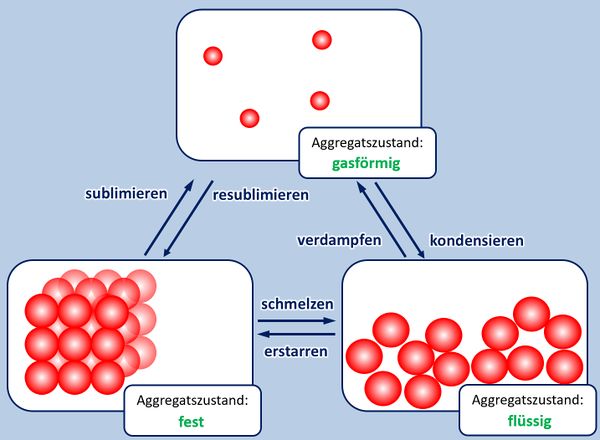
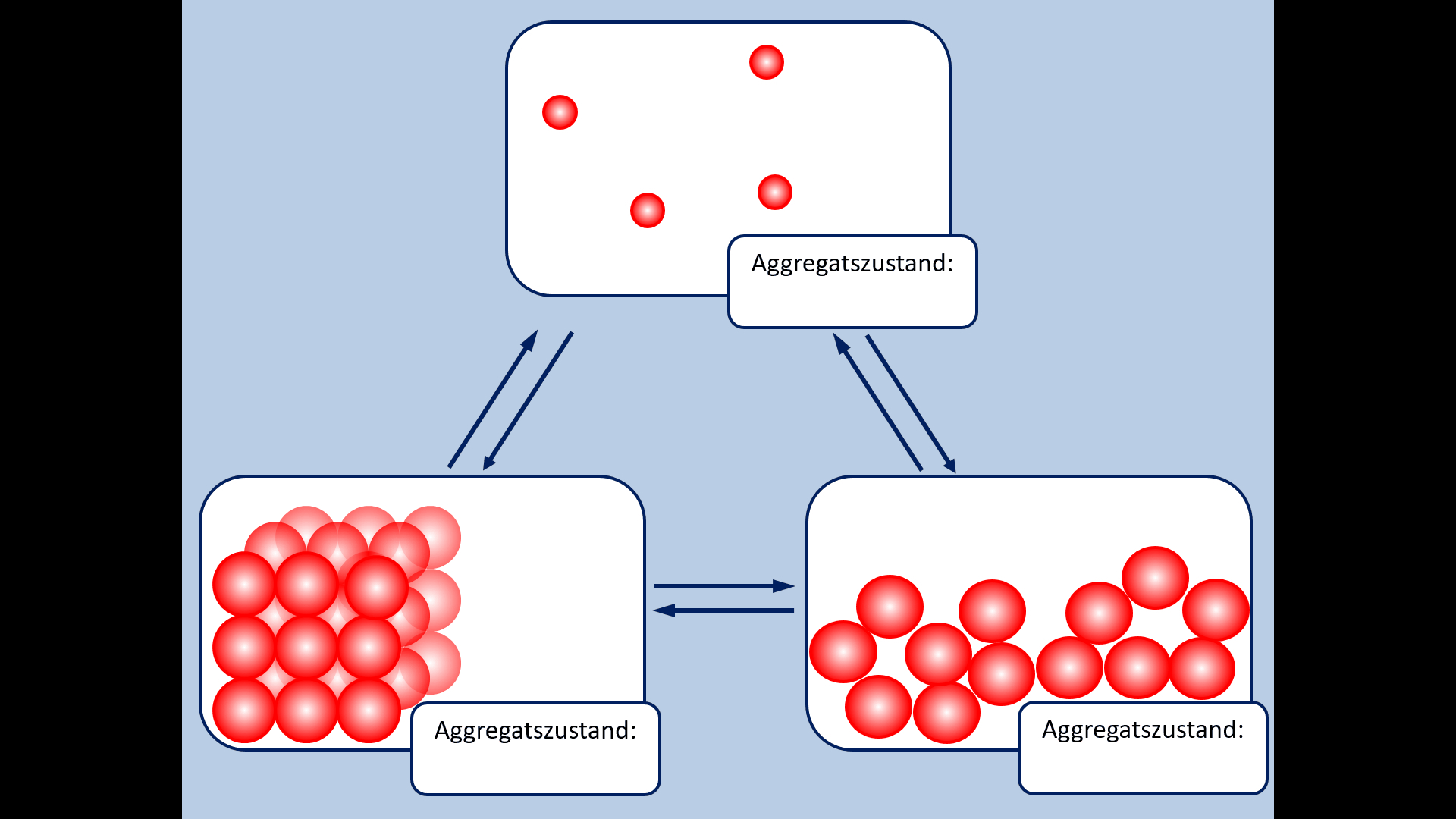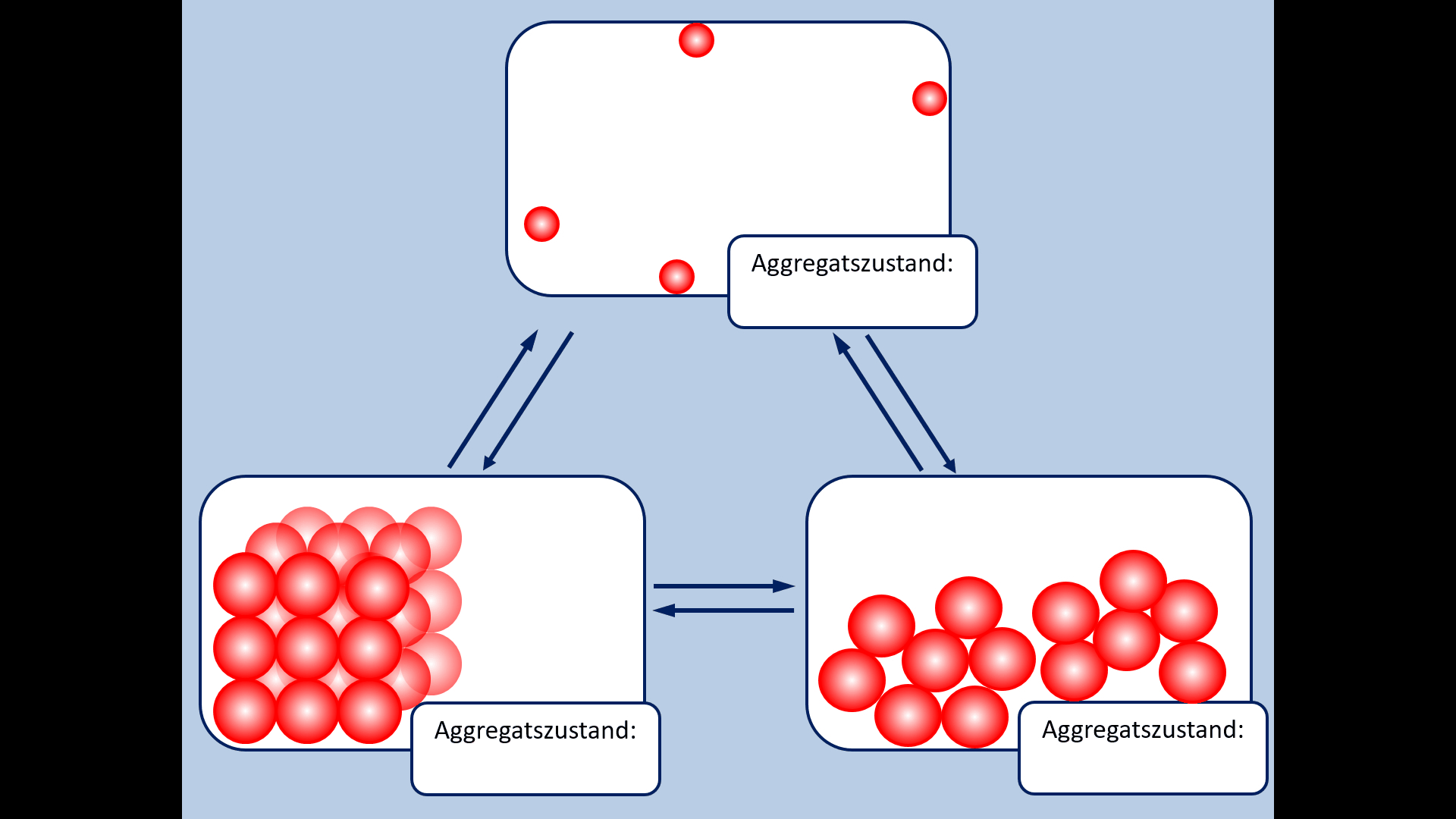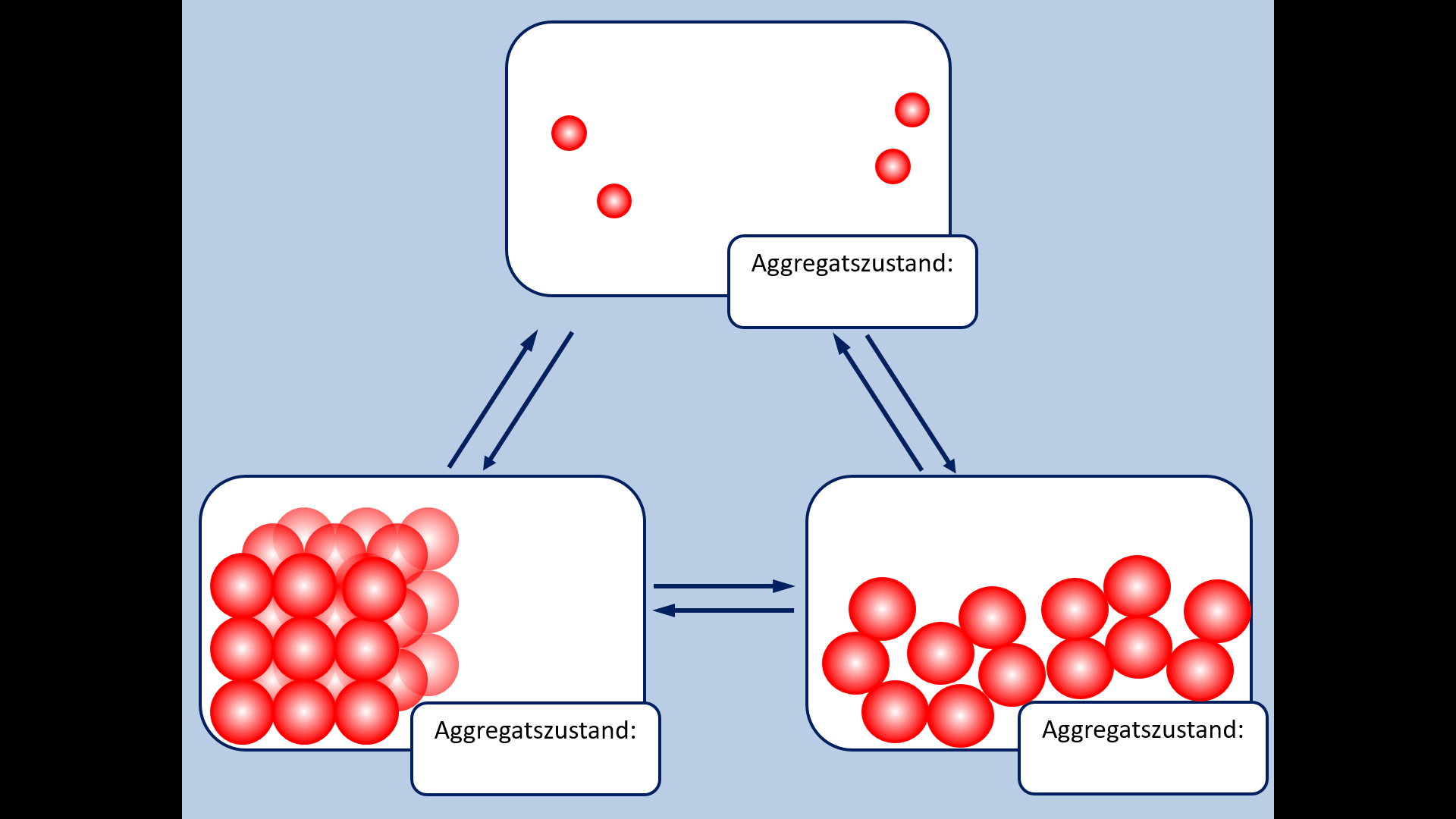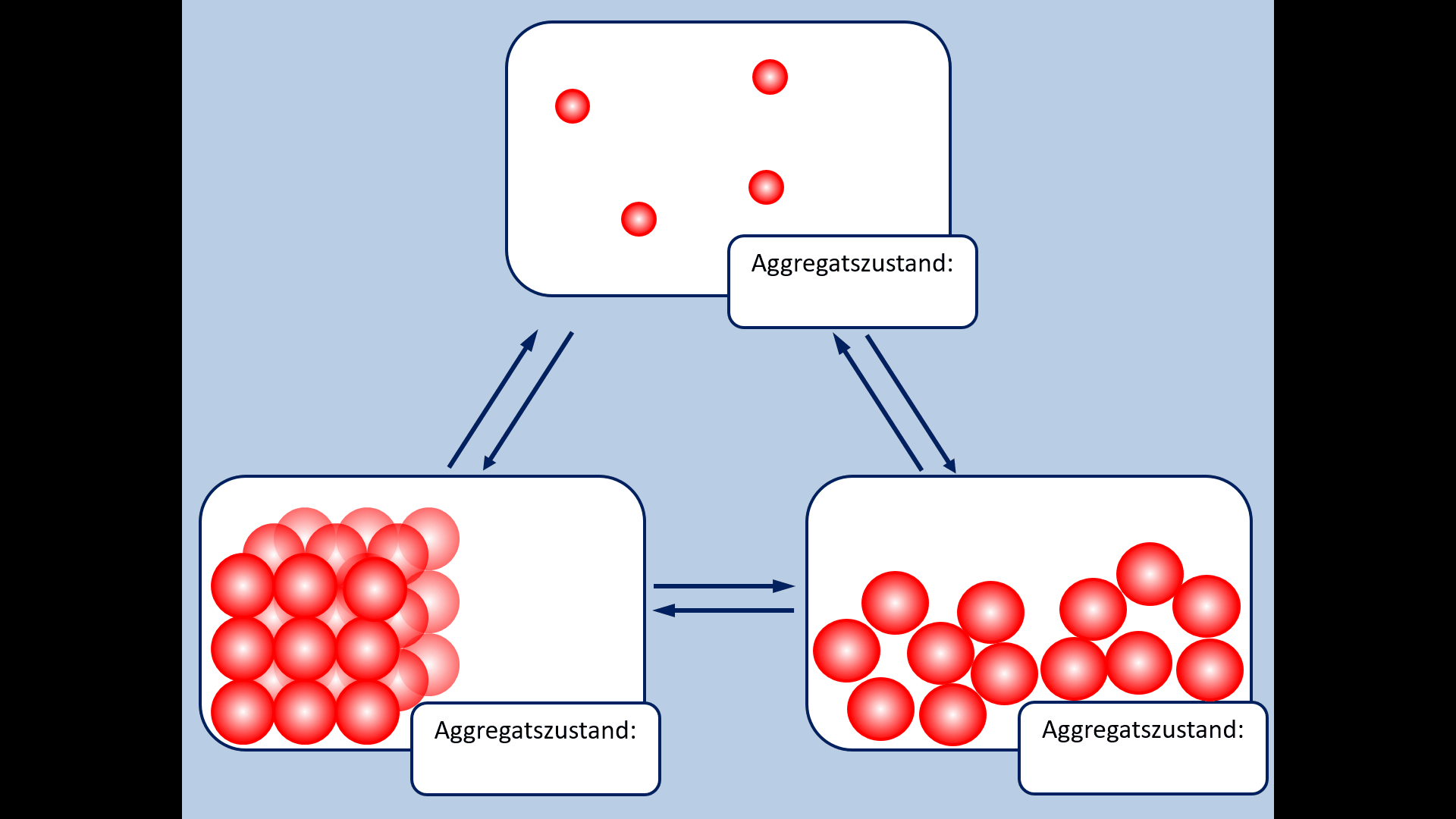
* Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A5_Aggregatszustände_ML.jpg|600px]] | ||
|Lösung|Lösung ausblenden}} | |||
| | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
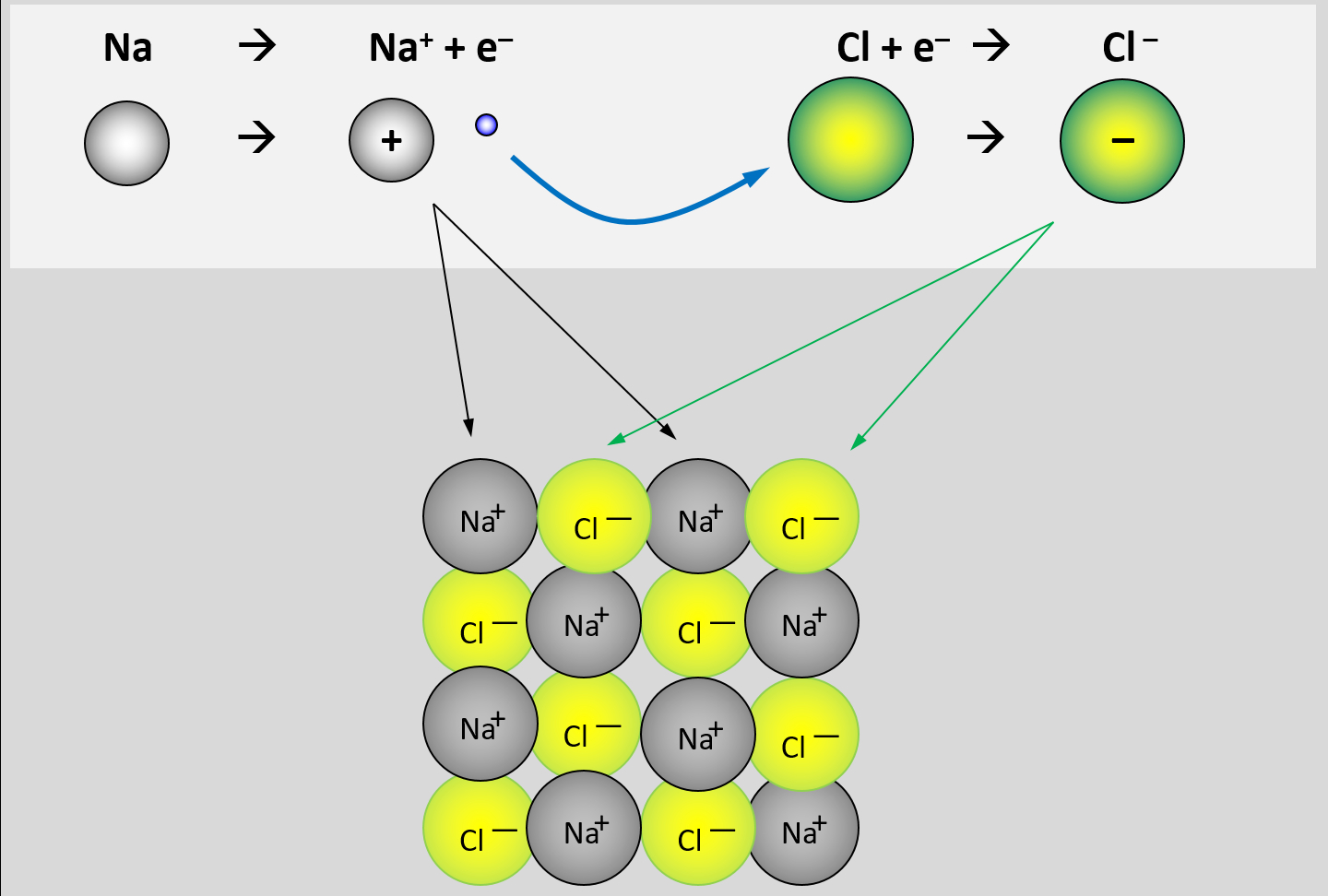
* Erkläre, warum Salze so hohe Schmelz- und Siedetemperaturen besitzen! Gehe bei Deiner Erklärung auch darauf ein, wie sich Salze aus den Elementen bilden. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Met1_IonenbildungBeiSalzen.jpg]] | ||
Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | |||
| | |Lösung|Lösung ausblenden}} | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Nachdem die meisten Metalle bei Raumtemperatur ebenfalls fest sind, könnte man zunächst ja vermuten, dass ein ähnlicher Grund wie bei den Salzen zur starken Anziehung der Metallteilchen untereinander führt.<br> | |||
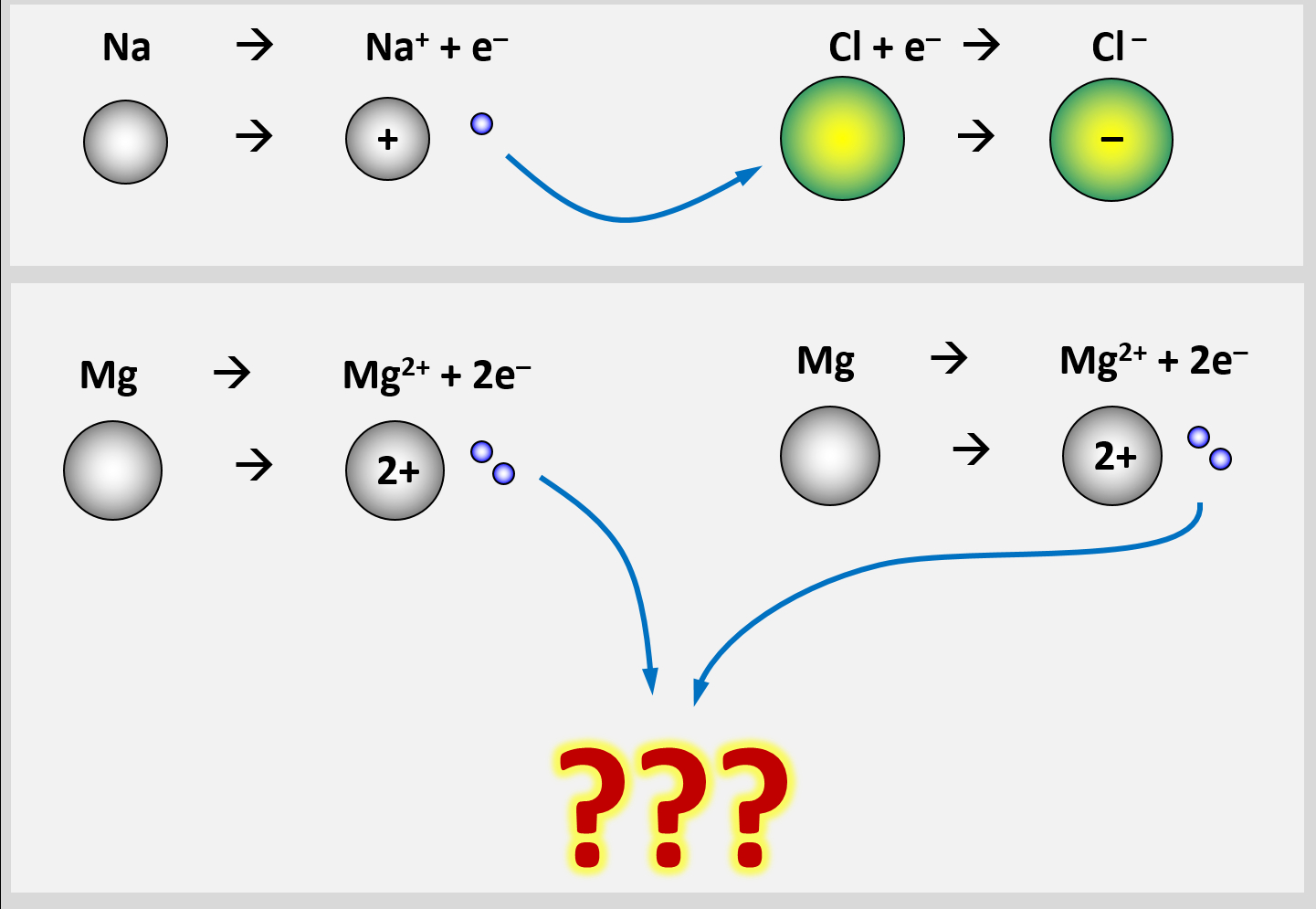
Man stößt allerdings sehr schnell auf Probleme, wenn man versucht das Bindungs-Prinzip von Salzen auf ein Stück Metall zu übertragen. Versucht zu begründen, warum in einem Stück Magnesium-Metall die Bindung der Mg-Atome aneinander keinesfalls auf den gleichen Gründen beruhen kann, wie bei einem Salzkristall. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Met1_IonenbildungUnmöglich.jpg]] | ||
| | In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, '''Elektronen abzugeben''', um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese '''Elektronen aufnehmen''' können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.<br> | ||
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
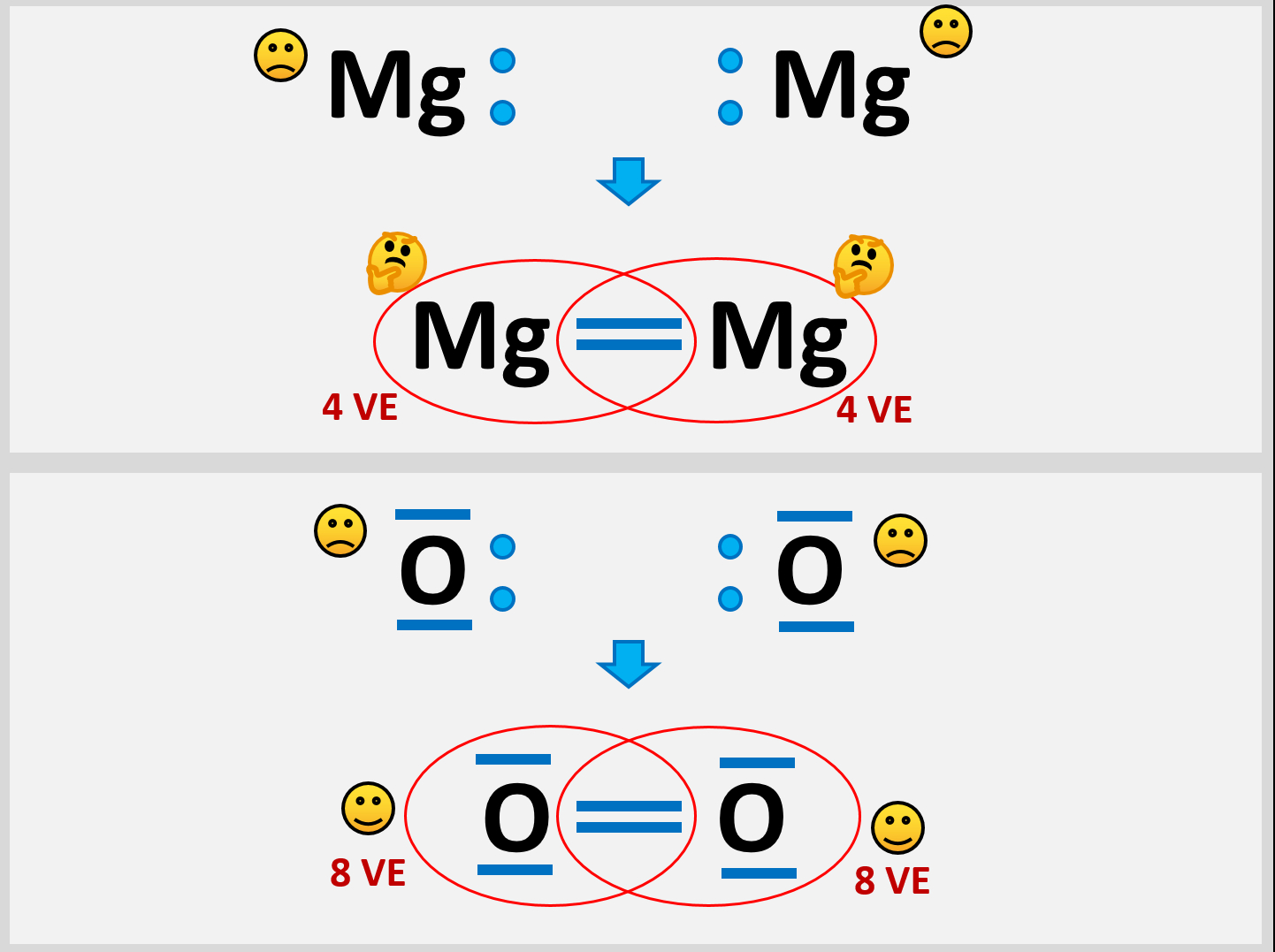
Gut. Beziehungsweise: schlecht. Schauen wir noch einmal kurz auf die andere Art der Bindung, die wir bereits kennengelernt haben: Die Atombindung. Auch die funktioniert hier nicht. | |||
* Versuche aus zwei Mg-Atomen ein Molekül zu bilden und beschreibe genau, die Probleme, die dabei auftauchen! | |||
* Vergleicht die Situation mit einem Sauerstoff-Molekül | |||
{{Lösung versteckt| | |||
[[Datei:Met1_AtombdgUnmöglich.jpg]] | |||
Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.<br> | |||
Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | <br> | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Die Lösung ist eigentlich simpel. Wenn man sie kennt. Von alleine darauf zu kommen ist schwierig (glaube ich). Trotzdem zeige ich euch mal ein Szenario aus der "Lebenswelt" auf und ihr versucht das auf Metall-Atome zu übertragen: Stellt euch vor, ihr wollt alle mit einem Ball spielen. Aber nicht jeder von euch hat einen. Sagen wir mal, nur jeder zweite. Was kann man tun, damit alle "zufrieden" sind? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Jeder sucht sich einen Partner, es bilden sich also Pärchen. Alle können so mit den zur Verfügung stehenden Bällen spielen. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Die oben genannte Situation könnte man mit der Situation bei Molekülen vergleichen, die ja aus Nichtmetallen aufgebaut sind: Bei Nichtmetall-Atomen sind viele Elektronen verfügbar (jedes Atom hat 6 VE). Die Elektronen entsprechen den Bällen. Wenn sich jedes Atom ein Elektron (auch zwei oder drei) Elektronen mit einem anderen Partner teilt, sind alle "zufrieden" (fachwissenschaftlich: Es entsteht ein energetisch günstiger Zustand). | |||
Bei Metallen funktioniert das nicht. Es sind einfach zu wenig Elektronen verfügbar. Wieder zurück zum Beispiel mit den Bällen: Alle (sagen wir z.B. mal 22 Schülerinnen und Schüler) wollen Ball spielen, aber es ist nur ein Ball da. Was kann man tun? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Man spielt Fußball! - Was hat das jetzt mit der Metall-Bindung zu tun? Ich gebe zu, das Beispiel ist jetzt nicht der Wahnsinn, aber soooo schlecht ist es auch nicht: Beim Fußball-Spielen teilen sich viele Menschen einen Ball. Weil alle spielen wollen, sorgt der Ball dafür, dass alle auf dem Spielfeld bleiben.<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung | |||
<br> | <br> | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
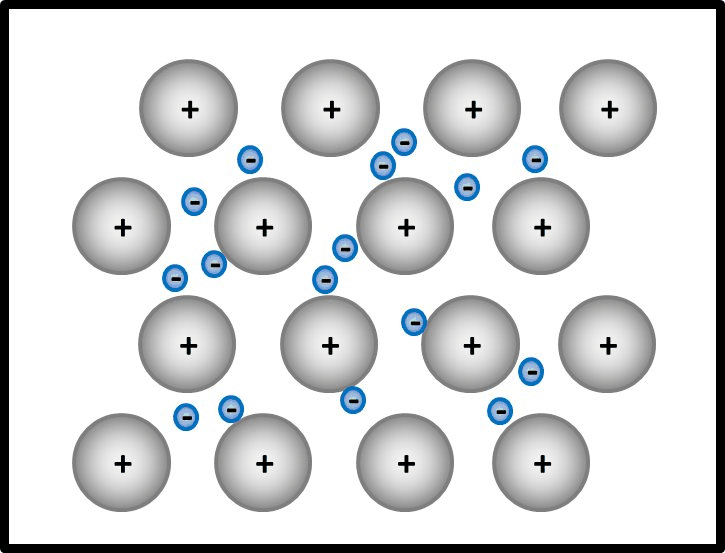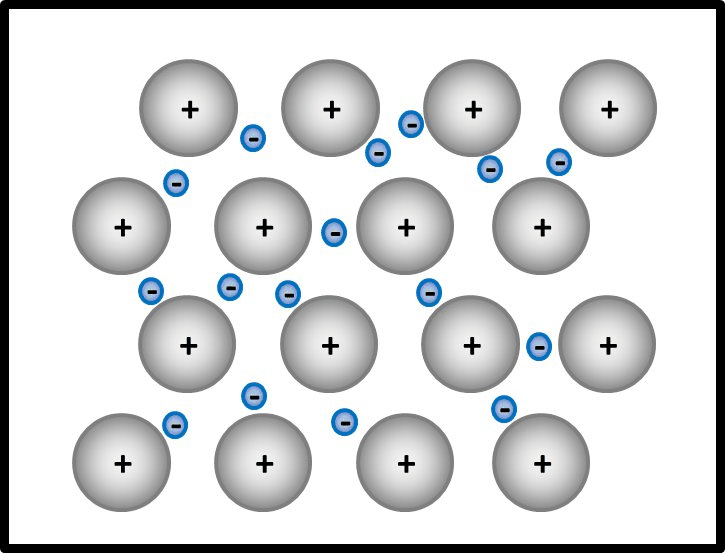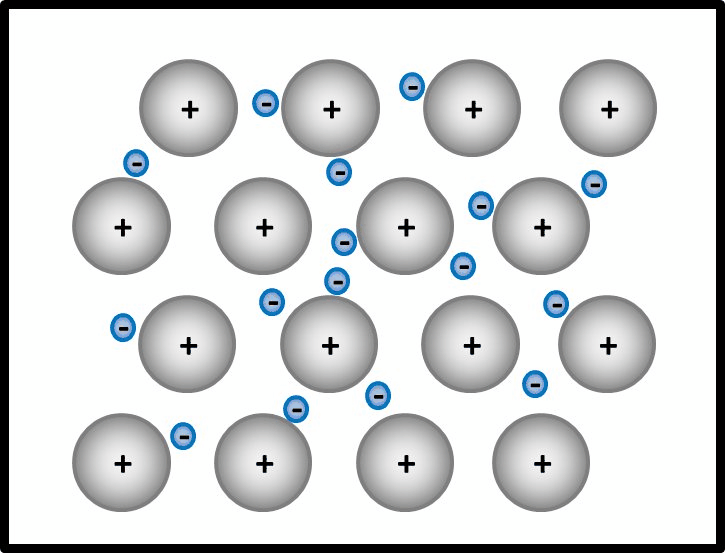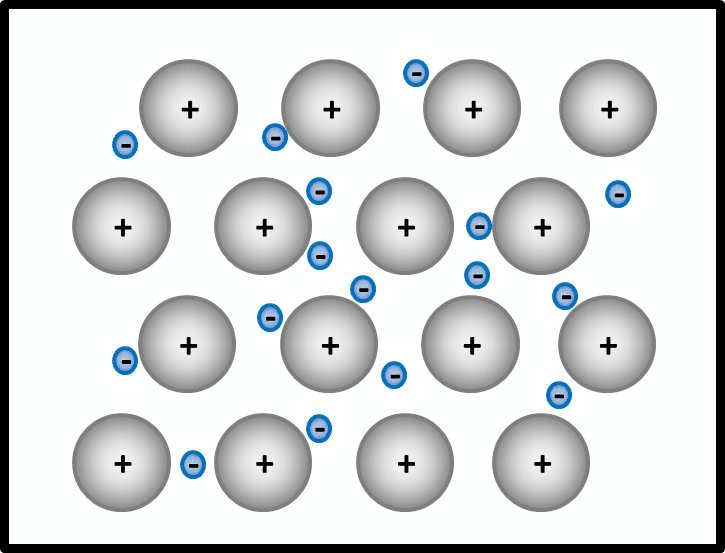
So ähnlich ist es auch bei Metallen: Alle Metall-Atome stellen ihre wenigen Valenzelektronen allen zur Verfügung. Es ist aber kein Partner da, der sie tatsächlich aufnimmt. Die Elektronen schwirren daher einfach zwischen den nun positiv geladenen Atomrümpfen herum und gehören irgendwie allen. Bildlich kann man sich das ungefähr so vorstellen: <br> | |||
[[Datei:Metallgitter_animiert_1.gif]]<br> | |||
Erklärt diese Vorstellung jetzt das Phänomen, warum Metalle in der Regel Feststoffe sind? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Ja! Metalle bestehen nach dieser Vorstellung aus '''positiv geladenen''' Teilchen: Den '''Atomrümpfen''', die durch die Abgabe von Valenzelektronen entstanden sind. Und aus '''negativ geladenen''' Teilchen: Den frei beweglichen Elektronen, auch '''Elektronengas '''genannt. Es sind hier also viele Ladungen im Spiel, die zu sehr hohen Anziehungskräften führen, ganz ähnlich wie bei den Salzen | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 239: | Zeile 295: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel= | ||
|Inhalt= | |Inhalt= | ||
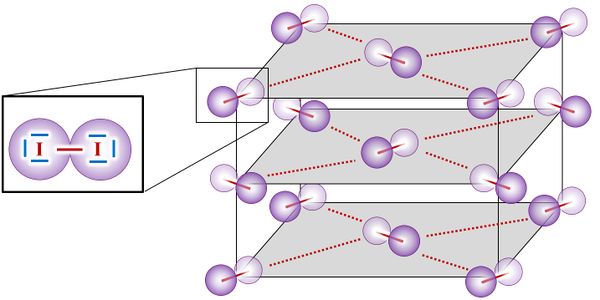
Noch ein Wort zu den positiv geladenen Atomrümpfen. In der animierten Abbildung seht, ihr dass eine Reihe von Atomrümpfen immer versetzt zur vorangegangen ist und das schön regelmäßig. In Wirklichkeit ist das ganze natürlich dreidimensional. Wenn man nur die Atomrümpfe betrachtet ohne das Elektronengas, sähe das dann so aus aus (man spricht von einer '''dichtesten Kugelpackung'''): <br> | |||
[[Datei:Dichtste_bolstapeling.gif]]<br> | |||
Ähnlich wie bei Salzen, die ja auch einen regelmäßigen Aufbau besitzen, sollten also Metalle ebenfalls Kristalle bilden können. Tatsächlich tun sie das auch, aber oft nur unter bestimmten Umständen. Das folgende Bild zeigt eine Metallplatte, die in flüssiges Zink getaucht wurde. Die unterschiedlich grauen Flächen, die scharf voneinander abgegrenzt sind, stellen solche Metall-Kristalle dar:<br> | |||
[[Datei:Feuerverzinkte_Oberfläche.jpg]]<br> | |||
[[Datei: | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 266: | Zeile 313: | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">Hausaufgabe</span> | ||
|Inhalt= | |Inhalt= | ||
Lest im Buch die S. 126 und von der S. 127 den 2. Absatz | |||
* Recherchiert (das geht auch ohne PC) das einzige Metall, das bei Raumtemperatur flüssig ist! | |||
|Farbe= # | * Recherchiert (auch das geht ohne PC) ein Metall, das in der Hand schmilzt! | ||
* Formuliert in einem Satz eine Antwort auf die Frage: Was ist eine Legierung? | |||
|Farbe= #080 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
== Arbeitsauftrag Chemie7 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel= '''Metalle''' | ||
|Inhalt= | |Inhalt= | ||
Zu vielen Stoffen eures Alltags könnt ihr aus chemischer Sicht jetzt schon etwas sagen: Die meisten Gegenstände, mit denen ihr in Berührung kommt sind aus '''Molekülen '''aufgebaut: Eure Kleidung, Kunststoffe, Nahrungsmittel. Ihr wisst inzwischen, dass hier Elektronen zwischen Atomen geteilt werden und dadurch eine Bindung entsteht. <br> | |||
Einige Stoffe in eurem Alltag gehören zu den '''Salzen''': z.B. Rohrreiniger (gut, den verwendet ihr jetzt wahrscheinlich nicht so oft), Kochsalz, aber auch keramische Werkstoffe (wie eine Tasse oder ein Teller) gehören hierher. Auch über den Aufbau von Salzen habt ihr schon einiges gelernt: Ihr kennt Ionen, also geladene Teilchen, die zu starken Anziehungskräften in Salzen führen. <br> | |||
Es gibt aber noch eine dritte große Gruppe von Stoffen, die besprochen werden muss: Die ''' Metalle'''! - Heute eine ganz einfache Aufgabe: Sucht in eurem Haushalt drei völlig verschiedene Gegenstände '''aus Metall'''. Legt diese auf ein Blatt Papier und schreibt stichpunktartig darunter, warum dieser Gegenstand wohl aus Metall und nicht aus einem anderen Material (z.B. Plastik) gefertigt worden ist. Macht ein Foto davon und schickt es mir an folgende E-Mail-Adresse: r m g . l u x [at] w e b . d e (ohne die Leerzeichen und das at in eckigen Klammern ist das „Klammeraffen“-Symbol. | |||
Wenn die Gegenstände zu groß sind und nicht auf ein Blatt Papier passen, macht erst Fotos davon, fügt die drei Bilder z.B. in eine PowerPoint-Präsentation ein und schreibt eure Stichpunkte dann darunter. Bitte schickt nicht die PowerPoint-Präsentation sondern wieder ein Foto davon! | |||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 315: | Zeile 344: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
== Arbeitsauftrag Chemie6 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#607">'''Wiederholung'''</span> | ||
|Inhalt= | |Inhalt= | ||
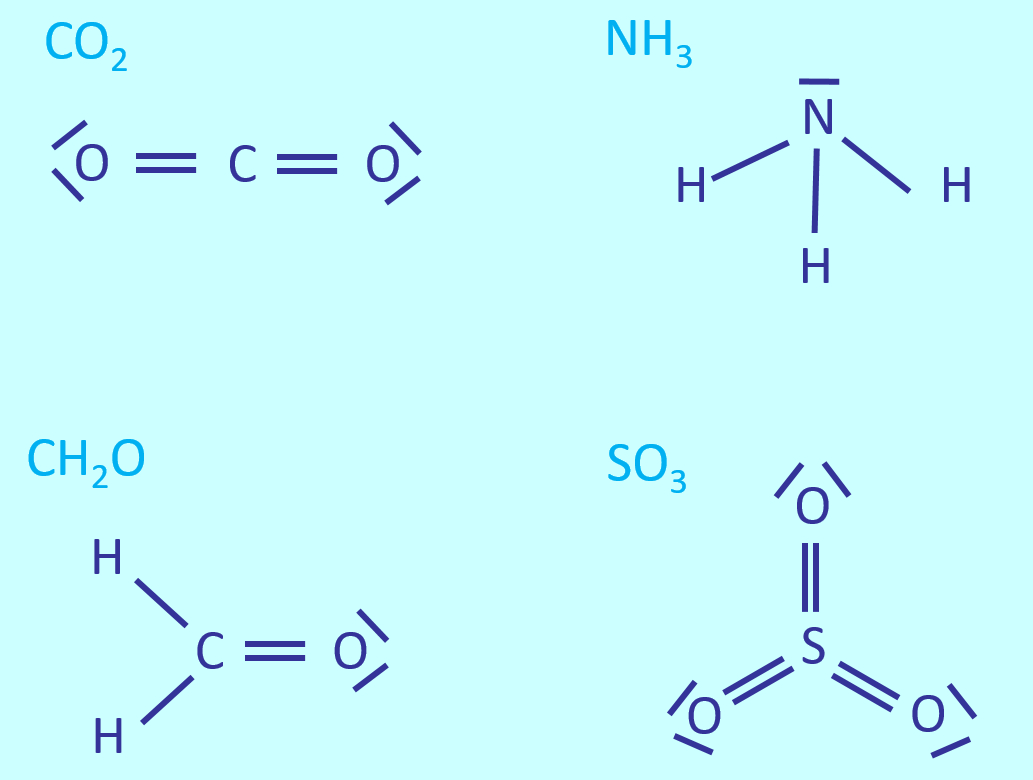
Ein paar einfache Aufgaben, um euch nach zwei Wochen Ferien langsam wieder auf Betriebs-Temperatur zu bringen: | |||
|Farbe= # | * Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | ||
|Farbe= #607 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DCF | ||
|Hintergrund= # | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel= | ||
|Inhalt= | |Inhalt= | ||
* | * Stellt die Bildung der folgenden Salze aus den Element in Form von chemischen Gleichung dar: Calciumoxid, Aluminiumchlorid, Magnesiumnitrid | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 343: | Zeile 377: | ||
}} | }} | ||
<br> | <br> | ||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg2_Salzgleichungen.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">Das war es schon für heute</span> | ||
|Inhalt= | |Inhalt= | ||
Falls ihr Schwierigkeiten mit den Aufgaben hattet, meldet euch bitte bei mir. | |||
|Farbe= #080 | |||
|Farbe= # | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
== Arbeitsauftrag Chemie5 == | == Arbeitsauftrag Chemie5 == | ||
| Zeile 472: | Zeile 503: | ||
<br> | <br> | ||
== Arbeitsauftrag | |||
== Arbeitsauftrag Chemie4 == | |||
* Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. | |||
* Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe. | |||
* Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!</span><br> | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Das Energie-Abstands-Diagramm'''</span> | ||
|Inhalt= | |Inhalt= | ||
Ihr habt sicher im Buch gesehen, dass ich einen Abschnitt im Buch zum Kapitel Atombindung ausgelassen habe: Das Diagramm auf der S. 106. Dieses Diagramm soll heute besprochen werden. Ihr braucht das Diagramm jetzt noch nicht anschauen, zunächst möchte ich euch sagen, welche Fragen dieses Diagramm beantworten kann: | |||
* Untersucht man ein Wasserstoff-Molekül (H<sub>2</sub>) genauer, stellt man fest, dass sich die beiden Atomkerne in einem ganz bestimmten Abstand zueinander aufhalten. Dieser Abstand wird '''Bindungsabstand '''genannt. Er ist bei allen Wasserstoffmolekülen gleich. Warum? - Das ist eine Frage, auf die das Diagramm eine Antwort geben kann. | |||
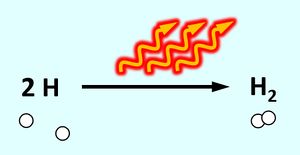
* Wasserstoff kommt immer als "Pärchen" vor, also als Molekül (H<sub>2</sub>). Ihr habt in der letzten Einheit gelernt, dass durch das Teilen von Elektronen über eine '''Atombindung '''Edelgaszustand erreicht werden kann. Man kann mit sehr viel Aufwand die beiden Wasserstoff-Atome eines Moleküls schon voneinander trennen. Aber sie finden sich sofort wieder zum Molekül zusammen. Dabei wird eine große Menge Energie frei, die '''Bindungsenergie'''. Das Diagramm im Buch kann auch erklären, warum das so ist. | |||
<br><br> | |||
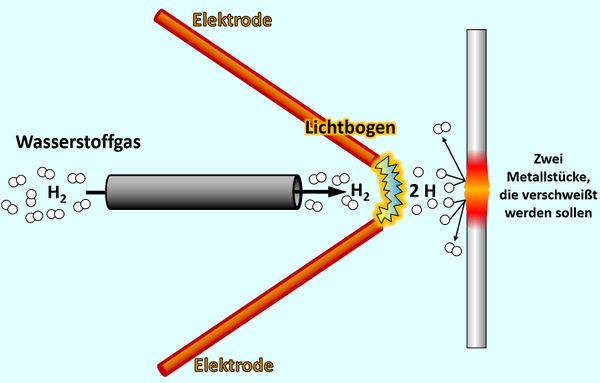
Beginnen wir mit dem letzten Punkt: Die folgende Abbildung zeigt schematisch eine Langmuir-Fackel, benannt nach einem US-amerikanischen Physiker und Chemiker, der diese Apparatur 1924 entwickelte. Man kann damit metallische Werkstücke verschweißen. Beschreibe diese Grafik: Mache Dir Stichpunkte auf einem Zettel. <br> | |||
[[Datei:A4_E_Abstandsdiagramm_LangmuirFackel.jpg|600px]]<br> | |||
{{Lösung versteckt| | |||
Über ein Röhrchen strömt Wassserstoff-Gas (besteht aus H<sub>2</sub>-Molekülen) zwischen zwei Elektroden hindurch. Von der einen zur anderen Elektrode spannt sich ein Lichtbogen (der wird durch eine sehr hohe Spannung erzeugt, die man an den Elektroden anlegt). Beim Durchtritt durch den Lichtbogen werden die Wasserstoff-'''Moleküle''' in einzelne Wasserstoff-'''Atome''' gespalten. Diese prasseln auf zwei metallische Werkstücke, die verschweißt werden sollen. Beim Auftreffen verbinden sich jeweils zwei Wasserstoff-'''Atome '''wieder zu einem Wasserstoff-'''Molekül'''. Dabei werden große Energiemengen frei, welche die metallischen Werkstücke so stark erhitzen, dass sie miteinander verschmelzen. | |||
|Lösung 1|Lösung ausblenden}} | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 485: | Zeile 527: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel=<span style="color:#070">'''optional (freiwillig) '''</span> | ||
|Inhalt= | |Inhalt= | ||
Je nachdem, ob ein Familienmitglied gerade Zeit hat oder nicht, kannst Du folgendes probieren: Gehe mit Deinem Zettel zu einem Familienmitglied. Erkläre ihm, wie eine Langmuir-Fackel funktioniert. Lass das Familienmitglied die Langmuir-Fackel nach Deinen Anweisungen zeichnen. Vergleicht dann die Zeichnung mit der Skizze hier. <br> | |||
Das geht auch "fernmündlich": Ruft jemanden an, der nach euren Anweisungen am Telefon die Skizze anfertigt. Anschließend soll euch derjenige ein Foto von seiner Zeichnung schicken. | |||
|Farbe= # | |Farbe= #070 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFC | ||
|Hintergrund= # | |Hintergrund= #DFC | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#607">'''Das Diagramm'''</span> | ||
|Inhalt= | |Inhalt= | ||
Was für euch an dieser Langmuir-Fackel wichtig ist, sind die Prozesse '''nach '''dem Lichtbogen: Zwei Wasserstoff-'''Atome verbinden sich '''wieder zu einem Wasserstoff-'''Molekül'''. Dabei werden große '''Energiemengen frei'''. <br> | |||
| | Es handelt sich um eine '''exotherme Reaktion''': Das "System" aus zwei Wasserstoff-Atomen enthält viel Energie, wenn sich beide zu einem Wasserstoff-Molekül vereinigen enthält dieses "System" weniger Energie. Die Energiedifferenz wird in diesem Beispiel als Wärme frei und erhitzt die metallischen Werkstücke. Als chemische Gleichung könnte man das z.B. so darstellen:<br> | ||
| | [[Datei:A4_E_Abstandsdiagramm_RGl_2HzuH2.jpg|300px]]<br> | ||
<br> | |||
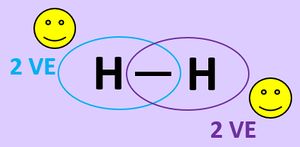
Es ist für zwei Wasserstoff-Atome also energetisch günstiger, wenn sie als Molekül vorkommen. In der letzten Stunde haben wir das auch anschaulich begründet: Durch das '''Teilen von Elektronen''' über die '''Atombindung''' können jedem Wasserstoff-Atom zwei Valenzelektronen zugeordnet werden, was einer Edelgaskonfiguration entspricht.<br> | |||
[[Datei:A4_E_Abstandsdiagramm_2_Valenzstrich.jpg|300px]]<br> | |||
<br> | |||
Die Grafik in eurem Buch versucht diese Bindung noch etwas genauer zu erklären.<br> | |||
* Lest jetzt im Buch auf den S. 106 - 107 die Abschnitte mit den Überschriften "Nichtmetalle reagieren miteinander", "Warum ist das Wasserstoffmolekül so stabil" und "Das bindende Elektronenpaar" | |||
* Versucht die Grafik (S. 106) zu interpretieren (1. Die Grafik zeigt... in Abhängigkeit von..., 2. Verlauf beschreiben, 3. Verlauf erklären) | |||
Ich glaube, dass anhand des Textes die Grafik schwierig zu verstehen ist. Vielleicht täusche ich mich aber auch. Falls ihr die Grafik nicht interpretieren könnt, hier ein Hilfsvideo: | |||
* Das Video ist mit Absicht ohne Ton. | |||
* Am oberen Bildrand wird immer erst ein Text eingeblendet, nach kurzer Verzögerung erfolgt (meist) eine Animation. | |||
* Wenn es euch zu schnell geht, dann drückt immer wenn sich der Text ändert kurz auf Pause, lest den Text in Ruhe und schaut euch dann die Animation an. | |||
<br> | |||
[[Datei:Atombdg_E_Abstands_Diagramm.mp4|600px]] <br> | |||
Jetzt sollte die Interpretation besser klappen, also los: | |||
* Die Grafik zeigt... in Abhängigkeit von... | |||
* Beschreibung des Verlaufs | |||
* Erklärung | |||
{{Lösung versteckt| | |||
* Die Grafik zeigt den Energiegehalt von zwei Wasserstoffatomen, die sich annähern in Abhängigkeit vom Abstand der Atomkerne. | |||
* Sind die beiden Kerne sehr weit voneinander entfernt, ist die Energie dieses Systems 0. Nähern sich die Atomkerne an, nimmt die Energie des Systems ab, bis zu einem Minimum. Nähert man die Kerne noch näher an, steigt der Energiegehalt des Systems sehr rasch an. | |||
* Begründung: Durch die Annäherung der Atome aneinander können die Elektronenhüllen sich immer besser überlappen. Das Teilen der Elektronen wird dadurch immer einfacher, das erklärt die Abnahme der Energie des Systems bis zu einem bestimmten Punkt. Nähert man die Atome noch näher an, beginnt nun die Abstoßung der positiv geladenen Kerne relevant zu werden und man muss Energie in das System hineinstecken. Der Kern-Abstand an dem der Energiegehalt des Systems am niedrigsten ist, nennt man '''Bindungsabstand''', die Energiedifferenz zwischen diesem Punkt und der "0-Linie" nennt man '''Bindungsenergie'''. | |||
|Lösung 2|Lösung ausblenden}} | |||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 536: | Zeile 579: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#070">'''optional (freiwillig) '''</span> | ||
|Inhalt= | |Inhalt= | ||
Wie oben: Je nachdem, ob ein Familienmitglied gerade Zeit hat oder nicht, kannst Du folgendes probieren: Gehe mit Deiner schriftlichen Lösung zu einem Familienmitglied. Beschreibe ihm die Grafik anhand Deiner Notizen, nach denen es die Grafik nachzeichnen soll. Vergleicht dann die Zeichnung mit der Grafik im Buch. <br> | |||
Das geht auch "fernmündlich": Ruft jemanden an, der nach euren Anweisungen am Telefon die Grafik anfertigt. Anschließend soll euch derjenige ein Foto von seiner Zeichnung schicken. | |||
|Farbe= #070 | |||
|Farbe= # | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFC | ||
|Hintergrund= # | |Hintergrund= #DFC | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Aufgabe'''</span> | ||
|Inhalt= | |Inhalt= | ||
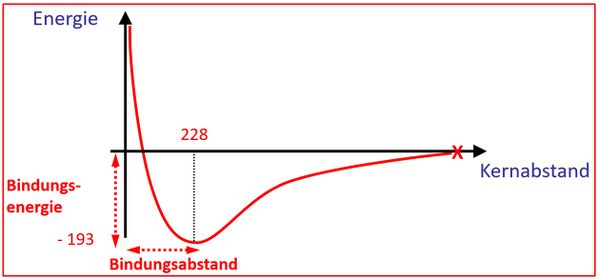
* Bei einem Brom-Molekül (Br<sub>2</sub>) beträgt der Bindungsabstand 228''pm'' (Pikometer) und die Bindungsenergie beträgt 193''kJ/mol'' (Kilojoule pro Mol). Zeichne ein vollständig beschriftetes Energie-Abstands-Diagramm für die theoretische Annäherung zweier Brom-Atome aneinander! Achte darauf, dass sich auch die eingangs genannten Werte in der Zeichnung wiederfinden! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A4_E_Abstandsdiagramm_A1_ML.jpg|600px]] | ||
|Lösung|Lösung ausblenden}} | |Lösung 3|Lösung ausblenden}} | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 573: | Zeile 609: | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel=<span style="color:#070">'''Hausaufgabe '''</span> | ||
|Inhalt= | |Inhalt= | ||
Als Hausaufgabe bearbeitet ihr bitte S. 107 A4. Die Lösung wird erst am Mittwoch hochgeladen. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
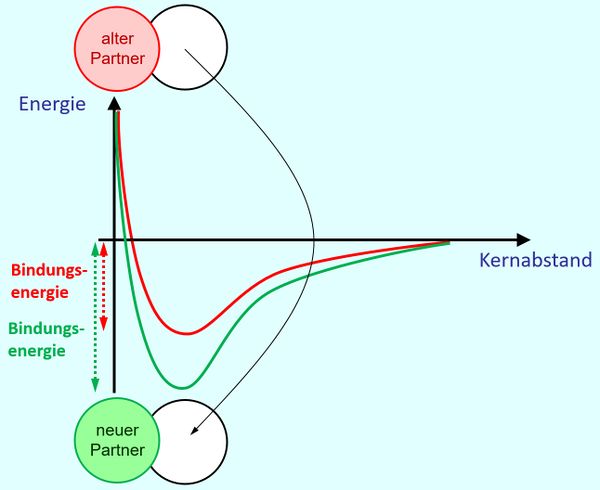
[[Datei: | Es könnte sein, dass bei der neuen Bindung mehr Energie frei wird als bei der alten Bindung: <br> | ||
[[Datei:A4_E_Abstandsdiagramm_HAVerb.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |Lösung 3|Lösung ausblenden}} | ||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 587: | Zeile 624: | ||
}} | }} | ||
<br> | <br> | ||
== Arbeitsauftrag Chemie3 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel=<span style="color:#607">'''Arbeitsauftrag Chemie3 (verpflichtend) '''</span> | ||
|Inhalt= | |Inhalt= | ||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel und einen Stift. Und Ruhe. Voraussetzung für die Bearbeitung ist, dass ihr Arbeitsauftrag '''Chemie2''' erledigt habt (vom Mo, 23.03.). Am Ende erhaltet ihr einen Hefteintrag sowohl für die Einheit Chemie2 als auch Chemie3. Den könnt ihr abschreiben (bitte nur im Notfall) oder ausdrucken und einkleben.</span><br> | |||
<span style="color:#607">'''Bitte klickt erst auf "Lösung", wenn ihr die Aufgabe wirklich versucht habt zu lösen.'''</span><br> | |||
<br> | |||
'''Verbesserung der Hausaufgabe'''<br> | |||
* Buch S. 107, A1 | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_S107_A1.jpg]]<br> | |||
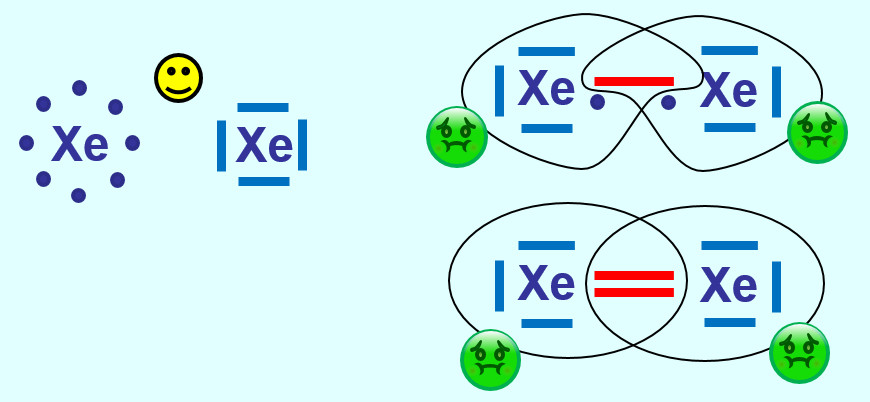
Xenon hat bereits Edelgaskonfiguration (8 VE auf der äußersten Schale). Durch eine (oder mehr) Atombindung(en) mit einem weiteren Xenon-Atom würde dieser energiearme Zustand zerstört werden. Daher kommen alle Edelgase einatomige Gase vor, im Gegensatz zu den anderen elementaren Gasen (wie z.B. Sauerstoff, Stickstoff, Wasserstoff...) | |||
|Hausaufgabe 1|Lösung ausblenden}} | |||
* Buch S. 107, A3 | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A2_HA_S107_A3.jpg]]<br> | ||
Ein Natrium-Atom könnte mit seinem '''einen Valenzelektron''' lediglich '''eine Atombindung''' aufbauen. Dadurch käme eine Konfiguration zustanden, bei der dem Atom zwei Elektronen zugeordnet werden können. Das ist weit entfernt von einer Edelgaskonfiguration und daher auch nicht stabil. | |||
|Hausaufgabe 2|Lösung ausblenden}} | |||
| | |||
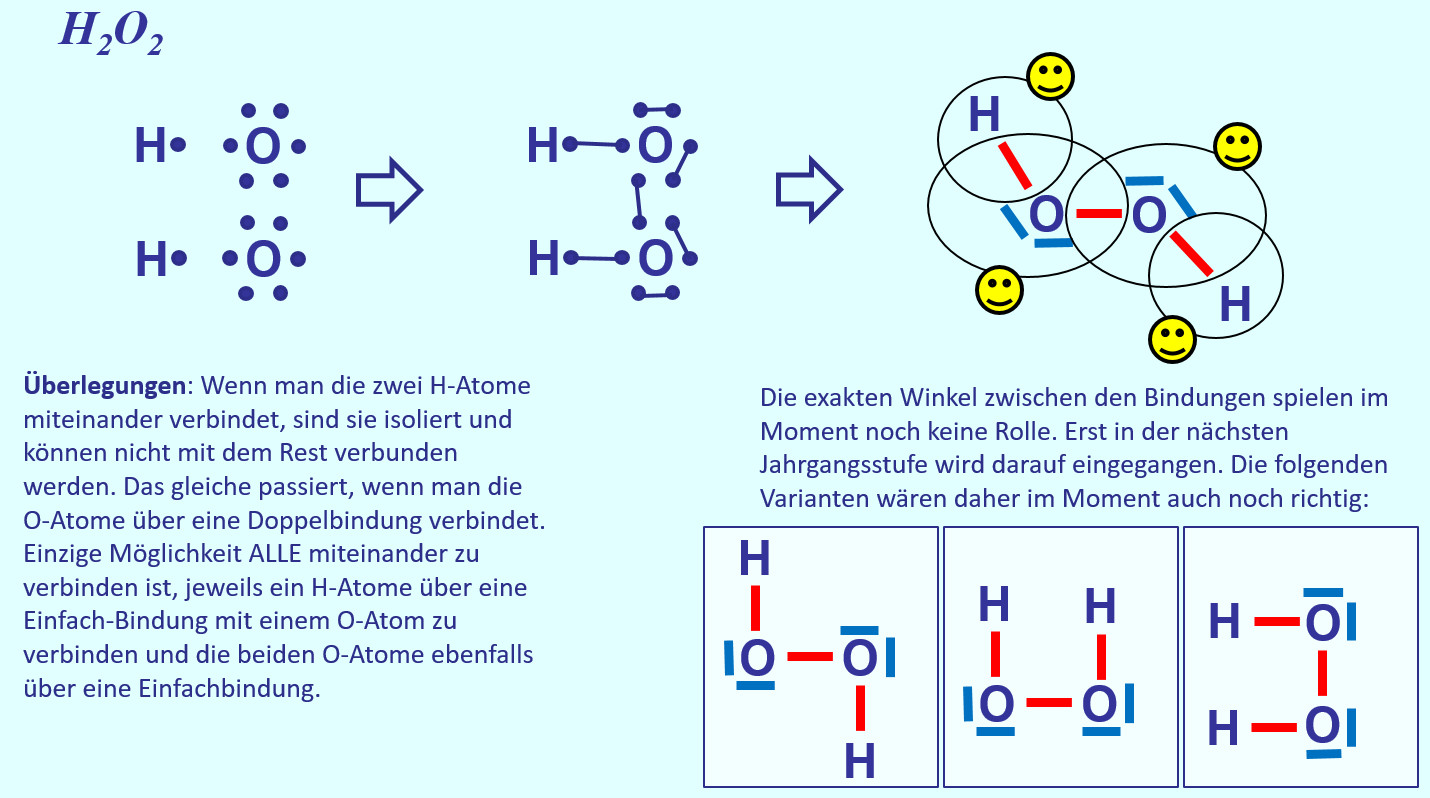
* Zeichne die Valenzstrichformel für Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) | |||
< | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A2_HA_H2O2.jpg]]<br> | ||
|Hausaufgabe 3|Lösung ausblenden}} | |||
| | Neu: '''Unterschiede zwischen Salzen und Molekülen''' <br> | ||
Bevor wir uns einige Spezialfälle beim Aufstellen von Valenzstrichformeln anschauen, soll hier zunächst noch einmal der Unterschied zwischen Salzen und Molekülen etwas genauer beleuchtet werden: Die chemischen Formeln '''CaF<sub>2</sub>''' und '''CO<sub>2</sub>''' sehen sich auf den ersten Blick recht ähnlich: Beide enthalten drei Atome, eines davon kommt doppelt vor. Auf Teilchen-Ebene betrachtet bedeuten sie jedoch etwas völlig anderes. <br> | |||
<br> | |||
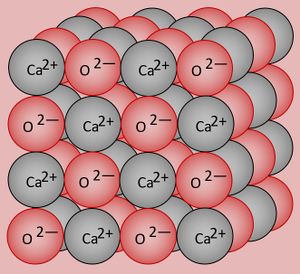
'''Zunächst zum Calciumfluorid (CaF<sub>2</sub>)''': Es gibt kein einzelnes CaF<sub>2</sub>-Teilchen. CaF<sub>2</sub> ist ein Salz und besteht aus sehr vielen Ca<sup>2+</sup>- und sehr vielen F<sup>-</sup>-Ionen. Alle ziehen aufgrund der unterschiedlichen Ladungen an ihren entgegen gesetzt geladenen Nachbarn, in alle Richtungen. Es entstehen riesige Gebilde, die Salzkristalle. Insgesamt ist das Verhältnis der vorliegenden Ionen in einem solchen Salzkristall aber immer 1 : 2. Nur so können sich die Ladungen exakt neutralisieren und es entsteht ein ungeladener Stoff (wären Salze geladen, würde man z.B. beim Berühren eine elektrischen Schlag bekommen). Das folgende Bild zeigt den Ausschnitt aus einem CaF<sub>2</sub>-Kristall. Weiß dargestellt sind die Ca<sup>2+</sup>-Ionen, die F<sup>-</sup>-Ionen grün. Man kann erkennen, dass Calcium-Ionen jeweils von acht Fluorid-Ionen als direkte Nachbarn umgeben sind (der graue Würfel links in der Abbildung), während Fluorid-Ionen jeweils nur von vier Calcium-Ionen als direkte Nachbarn umgeben sind (die graue pyramidenähnliche Figur rechts in der Abbildung). Pro Fluorid-Ion sind also doppelt so viele Calcium-Ionen vorhanden. | |||
[[Datei:CaF2_polyhedra.png|300px]]<br> | |||
<br> | <br> | ||
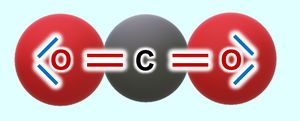
'''Nun zum Kohlenstoffdioxid (CO<sub>2</sub>)''': Hier gibt es tatsächlich einzelne CO<sub>2</sub>Teilchen. Jeweils eine Doppelbindung verbindet genau ein Sauerstoffatom mit dem zentralen Kohlenstoffatom. Diese drei Atome bilden eine Einheit, eben das Molekül. Mit anderen Teilchen tritt zunächst keine Wechselwirkung auf (später werden wir sehen, dass dies nicht korrekt ist, für den Moment bleiben wir aber bei dieser Annahme).<br> | |||
[[Datei:A3_CO2_Einzelmolekül.jpg|300px]]<br> | |||
| | |||
<br> | <br> | ||
Woran erkennt man nun, ob ein Salz oder ein Molekül vorliegt? Im Moment ist auch das noch recht einfach: '''Salze '''liegen vor, wenn es sich um eine Verbindung aus '''einem Metall und einem Nichtmetall''' handelt. '''Moleküle '''liegen vor, wenn es sich um eine Verbindung '''aus Nichtmetallen untereinander''' handelt. <br> | |||
* Entscheidet, ob es sich bei den folgenden Verbindungen um ein Salz oder einen molekularen Stoff handelt (Im PSE in eurem Buch auf der letzten Seite kann man erkennen, ob ein Element zu den Metallen oder Nichtmetallen gezählt wird): NO<sub>2</sub>, K<sub>2</sub>O, Al<sub>2</sub>O<sub>3</sub>, N<sub>2</sub>O<sub>3</sub> | |||
{{Lösung versteckt| | |||
* NO<sub>2</sub>: Stickstoff(N) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: NO<sub>2</sub> ist ein '''molekularer Stoff''' | |||
* K<sub>2</sub>O: Kalium (K) ist ein Metall, Sauerstoff (O) ein Nichtmetall, das bedeutet: K<sub>2</sub>O ist ein '''Salz''' | |||
* Al<sub>2</sub>S<sub>3</sub>: Aluminium (Al) ist ein Metall, Schwefel (S) ein Nichtmetall, das bedeutet: Al<sub>2</sub>S<sub>3</sub> ist ein '''Salz''' | |||
* SO<sub>3</sub>: Schwefel (S) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: SO<sub>3</sub> ist ein '''molekularer Stoff''' | |||
|Lösung 1|Lösung ausblenden}} | |||
'''Zurück zu den Valenzstrichformeln für Moleküle:''' <br> | |||
In der letzten Unterrichtseinheit habt ihr gesehen, wie man die Valenzstrichformel für Moleküle aufstellt. In eurem Buch ist ein mathematisches Verfahren dazu beschrieben. Ich persönlich finde es etwas umständlich und glaube, das man auch ohne dieses Verfahren auskommt. Einfach indem man sich ein paar sinnvolle Gedanken macht und etwas herumprobiert. Ihr dürft aber gerne das mathematische Verfahren anwenden. | |||
* Versucht nun eine Valenzstrichformel für das Molekül Schwefeldioxid (SO<sub>2</sub>) aufzustellen! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
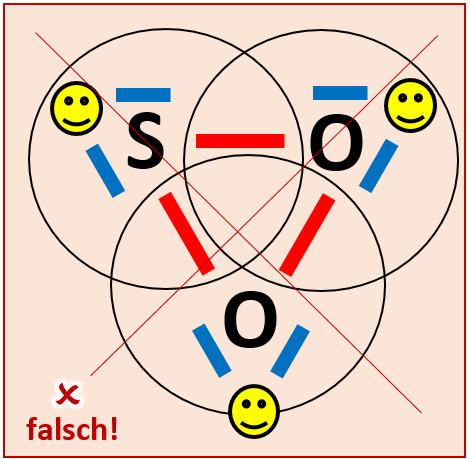
Wenn ihr etwas Geduld aufgebracht habt, kommt ihr vielleicht zu der folgenden Lösung: <br> | |||
|Lösung|Lösung ausblenden}} | [[Datei:A3_SO2_falsch.jpg]]<br> | ||
Obwohl hier alle drei Atome Edelgaskonfiguration aufweisen würden, bildet sich dieses Molekül nicht! Diese Lösung ist daher leider falsch. Aber woran liegt das? | |||
|Lösung 2|Lösung ausblenden}} | |||
Das Problem ist die Geometrie. Ein Effekt, den ich euch im Moment nicht näher erläutern kann, führt dazu, dass '''Dreiecks- und Vierecks-Verbindungen''' so gut wie nie stabil sind und sich daher auch (fast) nicht bilden. Die oben abgebildete Variante eines SO<sub>2</sub>-Moleküls wäre eine Dreiecks-Verbindung. <br> | |||
Wenn ihr weiter versucht, eine Lösung zu finden, werdet ihr vermutlich verzweifeln. Es fehlt euch nämlich noch eine wichtige Zusatzinformation. Zunächst zeige ich euch aber die richtige Strukturformel. Klickt auf "Anzeigen", schaut euch das Molekül an und erklärt, warum diese Variante nach eurem bisherigen Wissenstand falsch sein sollte: | |||
| | {{Lösung versteckt| | ||
[[Datei:A3_SO2_richtig.jpg]] | |||
| | |Anzeigen|Lösung ausblenden}} | ||
| | |||
}} | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Man | Dem Schwefel-Atom werden in dieser Anordnung '''zehn Valenzelektronen''' zugeordnet. Das ist kein Edelgaszustand. | ||
|Lösung 3|Lösung ausblenden}} | |||
Dennoch ist dieser Zustand stabiler als die Dreiecksverbindung. Man darf allerdings nicht jedem Atom in Molekülen mehr als acht Valenzelektronen zuordnen! Das ist nur möglich, wenn es sich um Elemente der 3. Periode oder noch höher handelt. Für Elemente der 2. Periode gilt die '''Oktettregel '''streng (ohne Ausnahme):<br> | |||
<br> | <br> | ||
''Atome besitzen in Verbindungen oft eine Elektronenkonfiguration, bei der auf der äußersten Schale '''acht Elektronen''' sitzen.''<br> | |||
<br> | <br> | ||
Nachdem Schwefel ein Element der 3. Periode ist, kann im SO<sub>2</sub> das '''Oktett '''(also 8 VE) überschritten werden. | |||
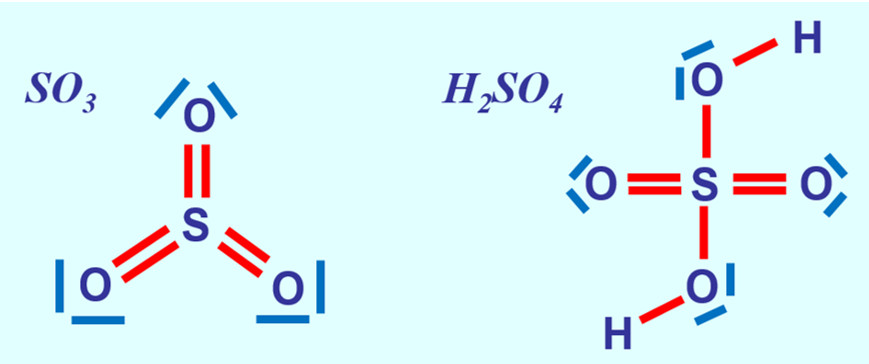
* Wendet dieses neue Wissen jetzt an und stellt die Valenzstrichformeln für Schwefeltrioxid SO<sub>3</sub> (leicht) und Schwefelsäure H<sub>2</sub>SO<sub>4</sub> (schwer) auf! | |||
{{Lösung versteckt| | |||
[[Datei:A3_SO3_H2SO4.jpg]] | |||
|Lösung 4|Lösung ausblenden}} | |||
Ihr könnt euch nun die Hefteinträge für die letzten beiden Einheiten herunterladen: | |||
* [[Spezial:FilePath/A2_Atombdg_Hefteintrag1.pdf| Einheit 1]] | |||
* [[Spezial:FilePath/A2_Atombdg_Hefteintrag2.pdf| Einheit 2]] | |||
Hier findet ihr noch ein Übungsblatt mit vielen Molekülen, zu denen ihr die Valenzstrichformeln aufstellen könnt. '''Meine Empfehlung:''' Macht ab heute jeden Tag als Hausaufgabe drei von der linken und zwei von der rechten Seite. Übung macht den Meister! | |||
* [[Spezial:FilePath/A3_ÜAufg_Valenzstrich_AA.pdf| Übungsaufgaben]] | |||
* [[Spezial:FilePath/A3_ÜAufg_Valenzstrich_ML.pdf| Lösungen]] | |||
[[ | |||
| | |||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 674: | Zeile 719: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
== Arbeitsauftrag Chemie2 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel=<span style="color:#607">'''Arbeitsauftrag Chemie2 (verpflichtend) '''</span> | ||
|Inhalt= | |Inhalt= | ||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein yt-Video zu schauen. Und Ruhe. Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!</span><br> | |||
<br> | <br> | ||
'''Die Atombindung (auch: kovalente Bindung)'''<br> | |||
Das folgende yt-Video bietet einen sehr guten Einstieg in die Thematik. Tatsächlich würde ich im Unterricht nahezu genau das gleiche sagen. Zu Beginn des Videos wird auf andere Videos verwiesen, die vorausgesetzt werden. Diese Videos braucht ihr nicht zu schauen. Wir haben das bereits im Unterricht besprochen. <br> | |||
Zum Einstieg vielleicht eine kleine Wiederholung (ca. 5 Min.): | |||
* Notiere, was "Valenzelektronen" sind! | |||
{{ | {{Lösung versteckt| | ||
Das sind die Elektronen, die sich bei Atomen eines bestimmten Elements auf der äußersten Schale befinden. | |||
| | |Lösung 1|Lösung ausblenden}} | ||
| | |||
| | |||
}} | |||
* Bestimme die Anzahl der Valenzelektronen (VE) der Atome folgender Elemente mit Hilfe des PSE: Calcium, Lithium, Iod! | |||
{{ | {{Lösung versteckt| | ||
Ca: 2 VE, Li: 1 VE, I: 7 VE | |||
| | |Lösung 2|Lösung ausblenden}} | ||
* Erkläre, wie Du diese Anzahl bestimmt hast! | |||
{{Lösung versteckt| | |||
Die Anzahl der VE entspricht der Hauptgruppen-Nr. im PSE. | |||
|Lösung 3|Lösung ausblenden}} | |||
* Bestimme die chemische Formel des Salzes '''Berylliumbromid'''! | |||
{{ | {{Lösung versteckt| | ||
Beryllium besitzt 2 VE. Um Edelgaskonfiguration zu erreichen, muss es diese beiden abgeben. Es entstehen Be<sup>2+</sup>-Ionen. Brom besitzt 7 VE. Um Edelgaskonfiguration zu erreichen muss es ein Elektron aufnehmen. Es entstehen Br<sup>-</sup>-Ionen. Damit ein neutrales (nicht geladenes) Salz entsteht und keine Elektronen verloren gehen oder übrig bleiben, müssen immer zwei Bromid-Atome mit einem Beryllium-Atom reagieren. Die Formel des entstehenden Salzes lautet dann BeBr<sub>2</sub> | |||
|Lösung 4|Lösung ausblenden}} | |||
Das genügt als Wiederholung. Jetzt zum yt-Video (10:06 min.): [https://www.youtube.com/watch?v=PsR-HRiGAzA Hier klicken] | |||
<br><br> | |||
'''Testet, ob ihr die Inhalte des Videos wiedergeben könnt:''' <br> | |||
<br> | <br> | ||
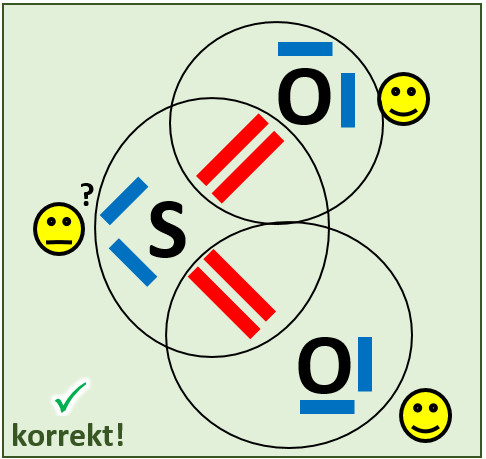
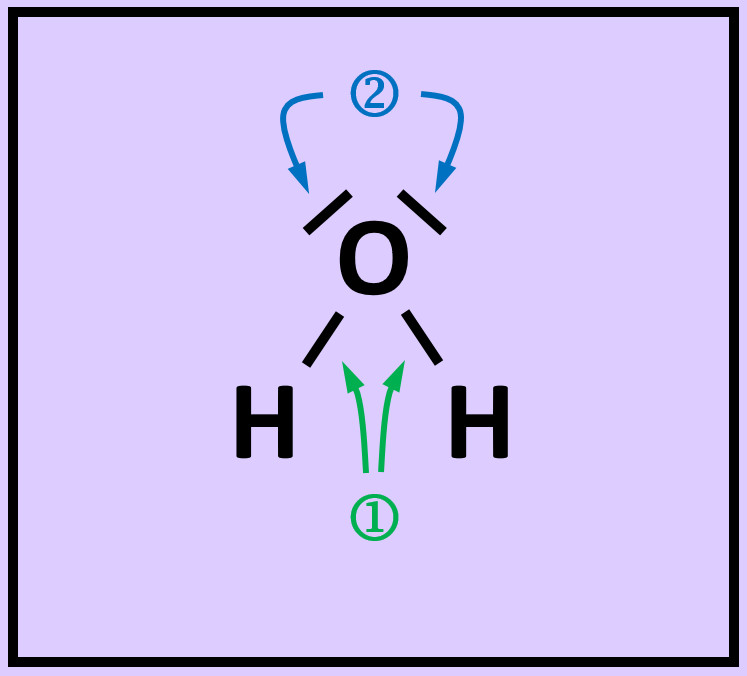
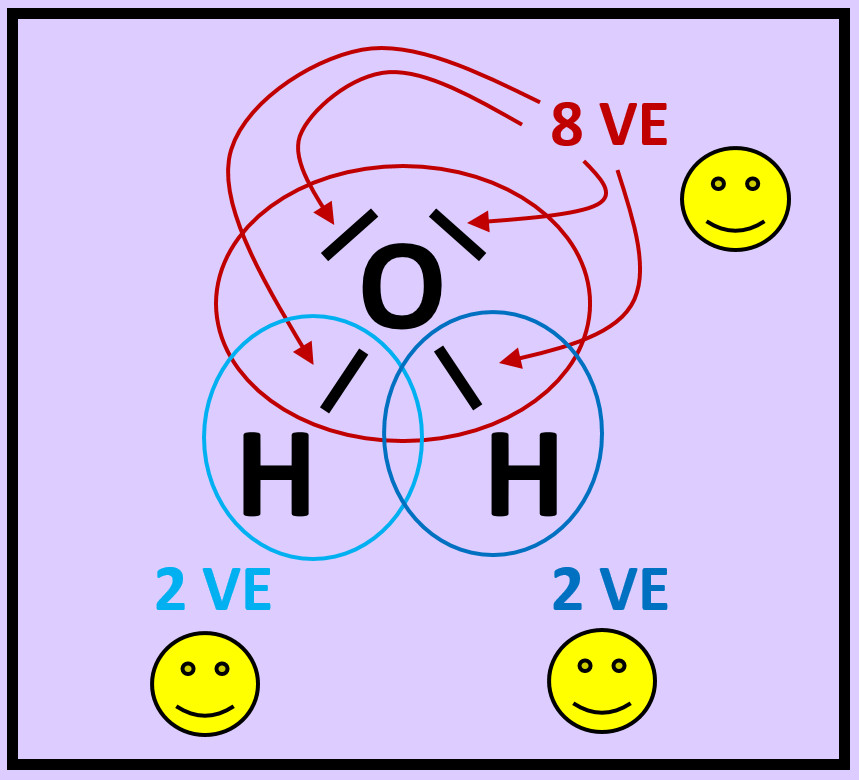
* Das folgende Bild zeigt die Valenzstrichformel des Wassermoleküls. Was bedeuten die mit unterschiedlichen Ziffern markierten Striche? | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_F.jpg]] | |||
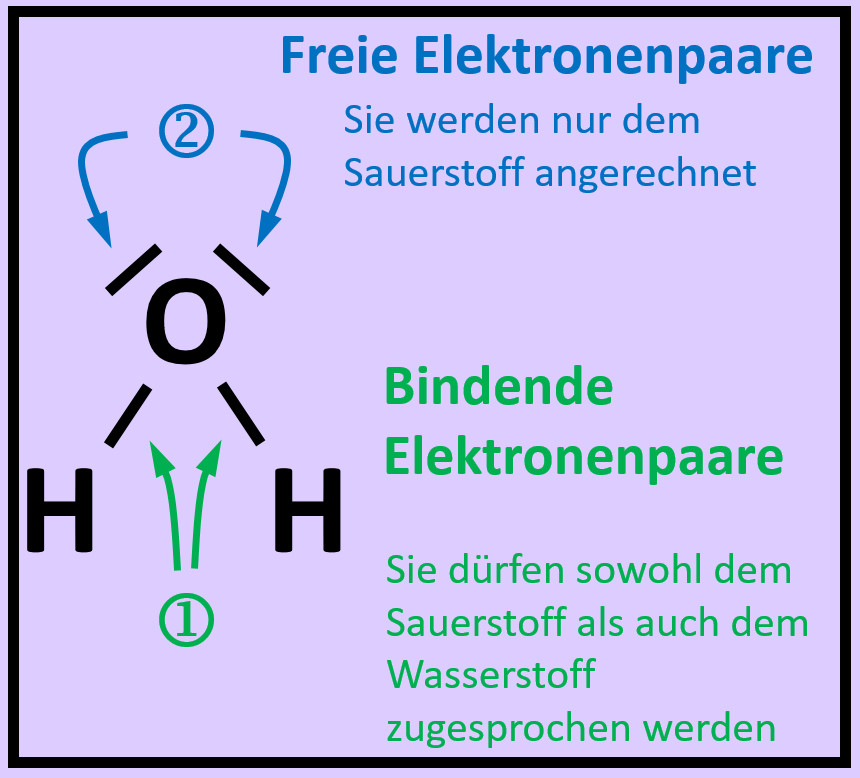
{{ | {{Lösung versteckt| | ||
[[Datei:A2_Atombdg_ePaare_Unterschied_ML.jpg]]<br> | |||
Freie Elektronenpaare stammen nur von dem Atom, das sie umgeben. Bei den bindenden Elektronenpaaren stammt ein Elektron vom einen Partner (hier: Sauerstoff) und das andere Elektron vom anderen Partner (hier: Wasserstoff) | |||
|Lösung 5|Lösung ausblenden}} | |||
| | |||
| | |||
}} | |||
* Zeichnet das Wassermolekül ab. Kreist nun jedes Atom ein. Achtet dabei darauf, dass im Kreis alle Elektronen (freie Elektronenpaare und bindende Elektronenpaare) enthalten sind, die dem Atom zugerechnet werden können! | |||
* Zählt nun die Elektronen, die ihr jedem Atom zugeordnet habt! | |||
* Entscheidet, ob durch diese Anordnung Edelgaskonfiguration erreicht wurde! | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_ML2.jpg]]<br> | |||
|Lösung 6|Lösung ausblenden}} | |||
* Warum kann man beim Wasserstoff von Edelgaskonfiguration sprechen, obwohl ihm nur zwei Elektronen zugesprochen werden? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Die beiden Elektronen sitzen auf der innersten Schale, der K-Schale. Damit ist diese voll besetzt. Dies entspricht der Konfiguration von Helium und damit einem Edelgas. | |||
|Lösung 7|Lösung ausblenden}} | |||
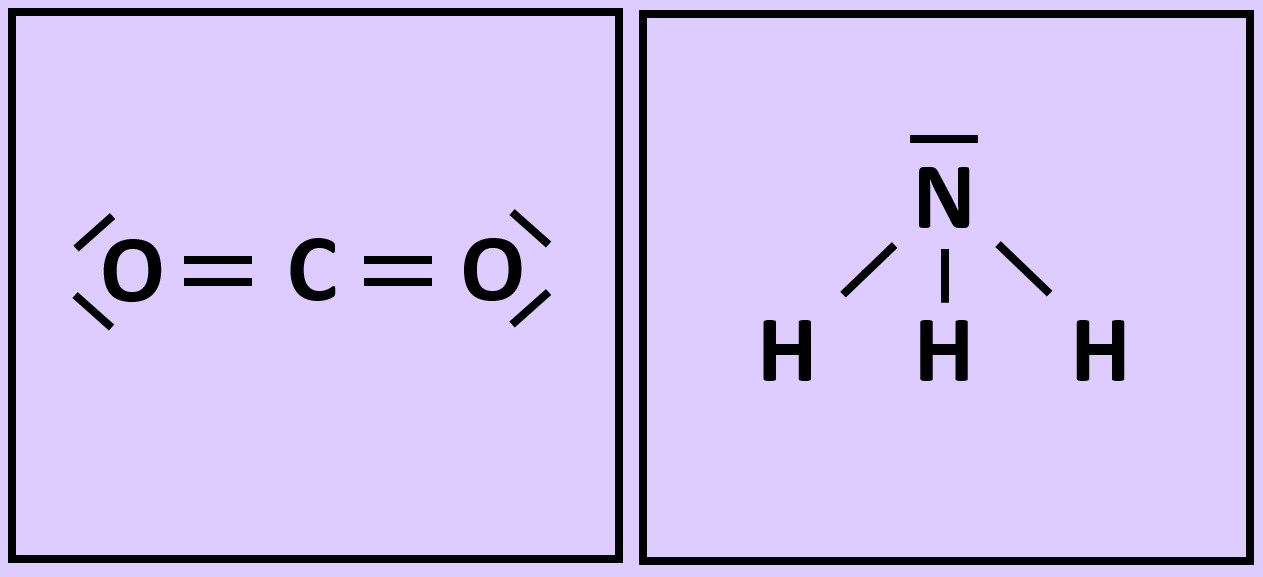
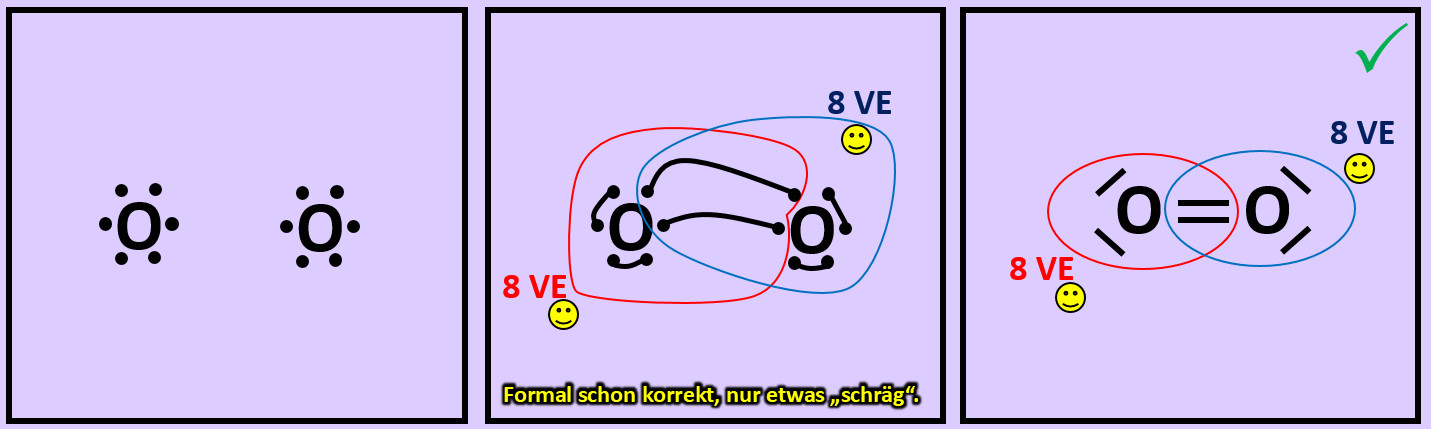
* Wiederholt die vorangegangenen Schritte (Einkreisen der Atome; Zählen der Elektronen; Entscheiden, ob Edelgaskonfiguration vorliegt) für die Moleküle '''"Kohlenstoffdioxid" (CO<sub>2</sub>)''' und '''"Ammoniak" (NH<sub>3</sub>)''' <br> | |||
Die | [[Datei:A2_Atombdg_Co2_NH3_A.jpg]] | ||
|Lösung|Lösung ausblenden}} | |||
< | |||
<br> | |||
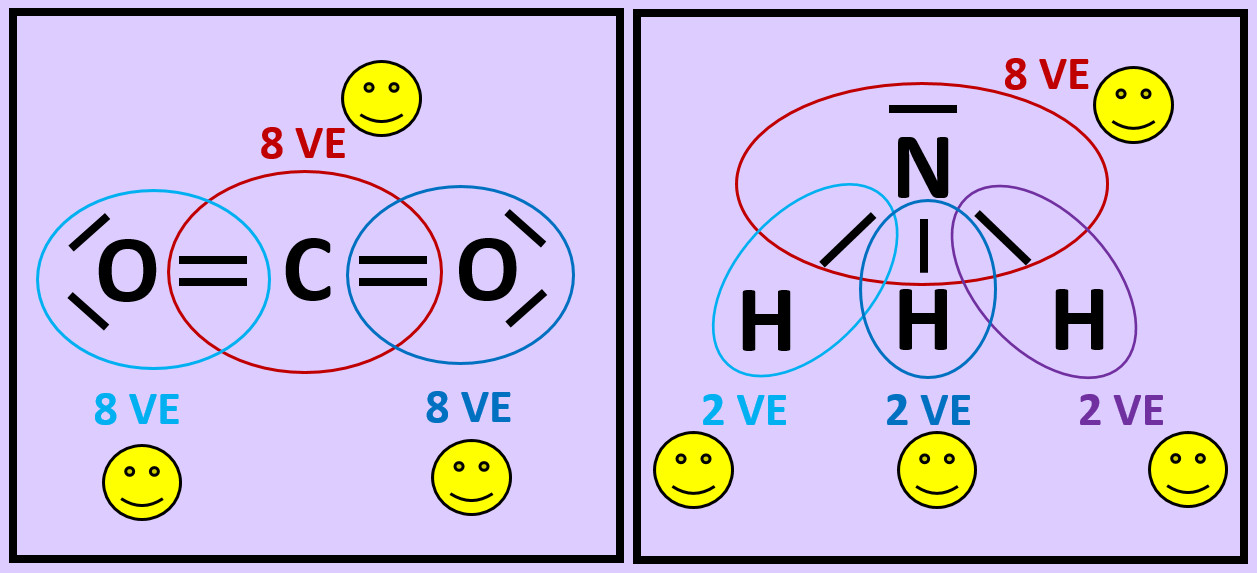
{{ | {{Lösung versteckt| | ||
[[Datei:A2_Atombdg_Co2_NH3_ML.jpg]]<br> | |||
| | |Lösung 8|Lösung ausblenden}} | ||
<br> | |||
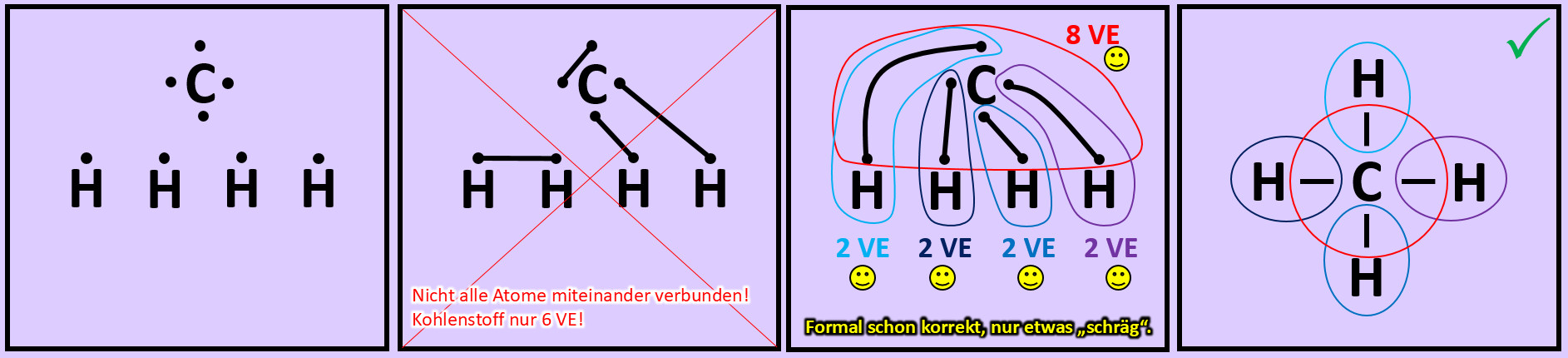
Versucht nun mit Hilfe der Valenzstrichformel selbst ein Molekül zu zeichnen, das ihr noch nicht im Video gesehen habt: '''"Methan" (CH<sub>4</sub>)'''. Geht wie folgt vor: | |||
* Zeichnet die Elementsymbole aller fünf Atome auf das Papier. Tipp: Wählt eine möglichst symmetrische Anordnung. | |||
* Zeichnet nun um jeden Atom die richtige Anzahl an Valenzelektronen. | |||
* Versucht nun die Punkte so zu verbinden, dass alle Atome miteinander zusammenhängen und gleichzeitig Edelgaskonfiguration erreicht wird. | |||
* Hinweis: Wenn man die zwei Valenzelektronen von zwei Wasserstoffen miteinander verbindet, dann besitzen zwar diese beiden Edelgaskonfiguration können aber keine weitere Bindung mehr eingehen. Sie können dann mit den restlichen Atomen nicht mehr verknüpft werden. Man muss also nach einer anderen Lösung suchen... | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:A2_Atombdg_CH4_ML.jpg]]<br> | |||
|Lösung 9|Lösung ausblenden}} | |||
In eurem Buch ist auf der Seite 113 ist ein Verfahren beschrieben, mit dem man die Valenzstrichformeln "berechnen" kann. Ihr dürft das in Zukunft gerne so durchführen. Wenn man etwas übt, dann klappt es aber nach einiger Zeit auch ohne dieses Verfahren. Lest dieses Verfahren jetzt noch nicht, sondern erst als Hausaufgabe. | |||
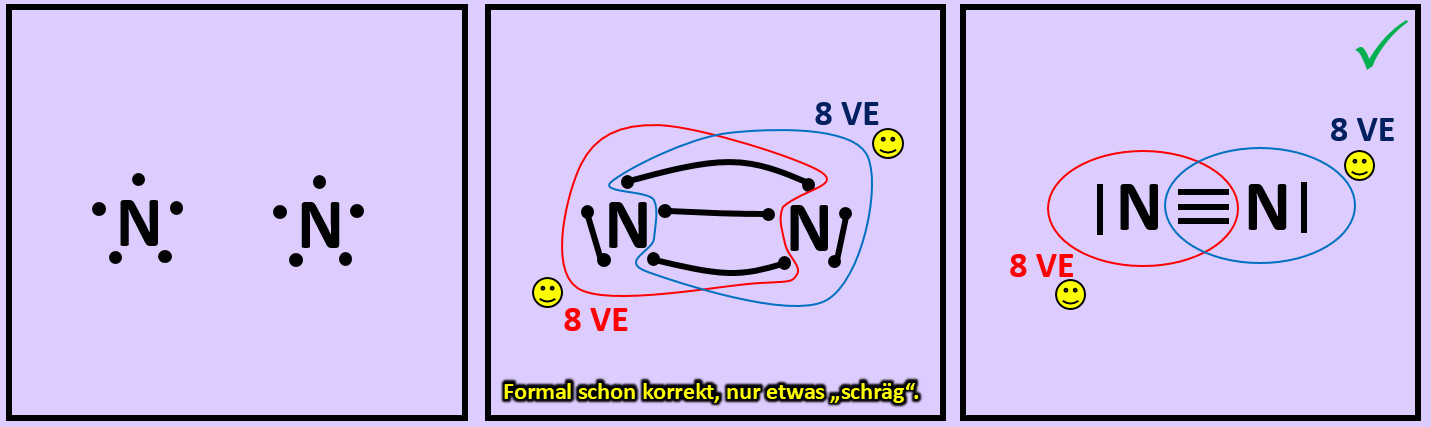
* Versucht erst noch zwei weitere Moleküle mit Hilfe der Valenzstrichformeln darzustellen: '''"Sauerstoff" (O<sub>2</sub>)''' und '''"Stickstoff" (N<sub>2</sub>)''' | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A2_Atombdg_O2_ML.jpg]]<br> | ||
[[Datei:A2_Atombdg_N2_ML.jpg]]<br> | |||
| | |Lösung 10|Lösung ausblenden}} | ||
* Beim Sauerstoffmolekül sind an der Bindung zwischen den beiden Atomen zwei Elektronenpaare, beim Stickstoffmolekül drei beteiligt. Diese Formen von Bindungen haben eigene Namen. Wie nennt man diese Bindungen? | |||
{{Lösung versteckt| | |||
Beim Sauerstoffmolekül: Doppelbindung, beim Stickstoffmolekül: Dreifachbindung. | |||
|Lösung 11|Lösung ausblenden}} | |||
<span style="color:#607">'''Hausaufgabe''': Lest im Buch folgende Abschnitte: S. 107 "Das Konzept der Elektronenpaarbindung", S. 108 komplett, S. 109 "Die Molekülformel". (Hinweis: Der Begriff "stöchiometrische Wertigkeit" spielt im meinen Unterricht keine große Rolle.) '''Bearbeitet die Aufgaben 1 + 3 auf S. 107''' und stellt die Valenzstrichformel für Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) auf (schwierig).<br></span> | |||
<span style="color:#607">'''Bitte macht die Hausaufgabe nicht jetzt sofort, sondern am besten erst morgen. Die Lösung wird am Mittwoch eingestellt.''' </span> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 805: | Zeile 820: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
== Arbeitsauftrag Chemie1 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie1 '''</span> | |||
|Inhalt= | |||
Züchtet einen Salzkristall: | |||
* Dokumentiert jeden der folgenden Schritte mit einem Foto, damit ihr daraus später eine schöne Anleitung am PC erstellen könnt! | |||
* Füllt ein Glas mit heißem Wasser. Ihr braucht es nicht extra erhitzen, nehmt einfach das heißeste Wasser, was ihr aus eurer Leitung bekommen könnt. | |||
* Gebt löffelweise '''Spülmaschinen-Salz''' dazu und rührt um. Minutenlang! (Wenn ihr kein Spülmaschinen-Salz habt, geht auch normales Speisesalz) | |||
* Irgendwann wird sich das Salz im Glas nicht mehr auflösen. Lasst den Ansatz dann noch 5 Minuten stehen. | |||
* Filtriert das Salzwasser durch einen Kaffee-Filter und fangt das Wasser in einem zweiten Glas auf | |||
* Schüttet etwas von dem Filtrat in eine Untertasse (am besten eine, die nicht weiß ist) und stellt es an einen sonnigen Platz auf das Fensterbrett, wo der Ansatz bis Montag stehen bleiben kann ohne dass er stört. Er sollte nicht bewegt werden. | |||
* Macht alle 24 Stunden ein Foto. | |||
* Am Montag, 23.03. geht es weiter | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 838: | Zeile 842: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
< | |||
{{Lösung versteckt| | |||
<gallery mode="packed"> | |||
SalzkristallZüchten_V1_LsgiGlas.jpg|Gesättigte Salzlösung | |||
SalzkristallZüchten_V1_LsgiUTasse.jpg|Klare Salzlösung in Untertasse | |||
SalzkristallZüchten_V1_LsgiUTasse2.jpg|nach 12 Stunden | |||
SalzkristallZüchten_V1_LsgiUTasse3.jpg|nach 24 Stunden | |||
SalzkristallZüchten_V1_LsgiUTasse4.jpg|nach 36 Stunden | |||
</gallery> | |||
|Lösung Chemie1|Lösung ausblenden}} | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#607">'''Arbeitsauftrag Chemie1b (freiwillig)'''</span> | ||
|Inhalt= | |Inhalt= | ||
Sofern ihr Arbeitsauftrag Chemie1 durchgeführt habt, könnt ihr nun folgende Überlegungen anstellen: | |||
* Gibt es in eurem Haushalt noch andere "reine Salze" mit denen ihr diesen Versuch durchführen könnte. Wenn ja: Probiert es aus! | |||
|Farbe= # | * Wenn man das Wasser vollständig verdunsten lässt, entstehen ganz zum Schluss viele kleine Kristalle, die wie ein Schleier alles überziehen. | ||
** Wenn man das nicht möchte, kann man vorher (z.B. nach 12 Stunden) einen kleinen, sauberen Kristall aus der Lösung holen und in ein neues Gefäß mit gesättigter Salzlösung überführen. Man kann ihn auch an einem Faden in ein Glas mit der Salzlösung hängen. Im Internet gibt es dazu reichlich Anleitungen. Wenn man Glück hat, wächst nur der kleine Kristall zu einem großen heran. Versucht das! | |||
** Man kann aus Draht z.B. einen Stern formen und diesen in ein Glas mit der Salzlösung hängen. Oder auch wieder in eine Untertasse mit der Salzlösung legen. Lässt man das Wasser komplett verdunsten, ist der Draht dann überall mit kleinen Kristallen überzogen. Manche finden das schön. | |||
* Führt den Versuch erneut durch. Stellt das Gefäß, in dem die Kristalle wachsen sollen, an einen ungestörten Ort. Baut eine Halterung, in der ihr euer Handy / euren Fotoapparat zum Anfertigen des Fotos kurz einspannen könnt, so dass jedes Foto vom Versuch aus exakt der selben Perspektive gemacht wird. Macht alle 8 Stunden (besser alle 4 oder 2 - was nachts aber schwierig ist...) ein Foto. Aus diesen Fotos kann man später eine Zeitrafferaufnahme machen. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DCF | ||
|Hintergrund= # | |Hintergrund= #DCF | ||
}} | }} | ||
Version vom 5. Mai 2020, 16:06 Uhr
Arbeitsauftrag Chemie10
Arbeitsauftrag Chemie9
Arbeitsauftrag Chemie8
Arbeitsauftrag Chemie7
Arbeitsauftrag Chemie6
Arbeitsauftrag Chemie5
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie4
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie3
Arbeitsauftrag Chemie2
Arbeitsauftrag Chemie1