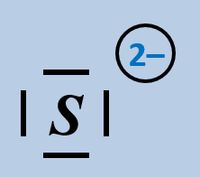Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Aus RMG-Wiki
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 219: | Zeile 219: | ||
|Titel=<span style="color:#080">Verbesserung der Hausaufgabe</span> | |Titel=<span style="color:#080">Verbesserung der Hausaufgabe</span> | ||
|Inhalt= | |Inhalt= | ||
'''Pflicht''': Sucht bei euch zu Hause drei völlig verschiedene '''Lebensmittel''', die '''sauer '''sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen"). <br> | '''Pflicht''': Sucht bei euch zu Hause drei völlig verschiedene '''Lebensmittel''', die '''sauer '''sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen"). <br> | ||
'''Freiwillig:''' Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist! | '''Freiwillig:''' Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist! | ||
* z.B.: Essig - Essigsäure (CH<sub>3</sub>-COOH) | * z.B.: Essig - Essigsäure (CH<sub>3</sub>-COOH) | ||
* z.B.: Zitronen (allgemein Früchte) - Zitronensäure (C<sub>6</sub>H<sub>8</sub>O<sub>7</sub>) | * z.B.: Zitronen (allgemein Früchte) - Zitronensäure (C<sub>6</sub>H<sub>8</sub>O<sub>7</sub>) | ||
* z.B.: Joghurt (allgemein Sauermilchprodukte) - Milchsäure (C<sub>3</sub>H<sub>6</sub>O<sub>3</sub>) | |||
* z.B.: Limo (allgemein sprudelnde Getränke) - Kohlensäure (H<sub>2</sub>CO<sub>3</sub>) | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 234: | Zeile 235: | ||
|Titel=<span style="color:#607">'''Die "Gegenspieler" der Säuren'''</span> | |Titel=<span style="color:#607">'''Die "Gegenspieler" der Säuren'''</span> | ||
|Inhalt= | |Inhalt= | ||
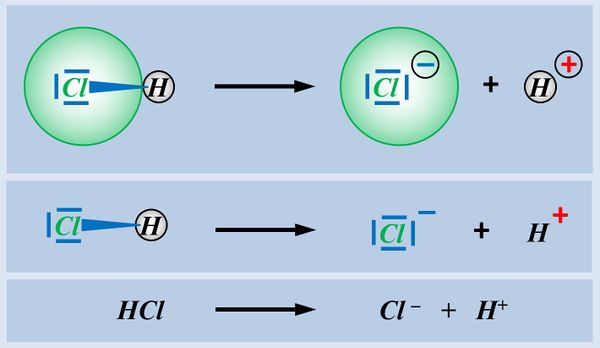
In der letzten Einheit habt ihr gesehen, dass es Moleküle mit einer polaren Atombindung zwischen einem elektronegativen Atom und einem Wasserstoff-Atom gibt, die heterolytische ein Proton abspalten können. Hier noch einmal verschiedene Darstellungsformen am Beispiel von Hydrogenchlorid (HCl).<br | In der letzten Einheit habt ihr gesehen, dass es Moleküle mit einer polaren Atombindung zwischen einem elektronegativen Atom und einem Wasserstoff-Atom gibt, die heterolytische ein Proton abspalten können. Hier noch einmal verschiedene Darstellungsformen am Beispiel von Hydrogenchlorid (HCl).<br> | ||
[[Datei: | [[Datei:SäBa2_Heterolyse_divDarstellungen.jpg|600px]]<br> | ||
<br> | <br> | ||
<br> | <br> | ||
| Zeile 260: | Zeile 261: | ||
|Titel=<span style="color:#607">'''Beispiel'''</span> | |Titel=<span style="color:#607">'''Beispiel'''</span> | ||
|Inhalt= | |Inhalt= | ||
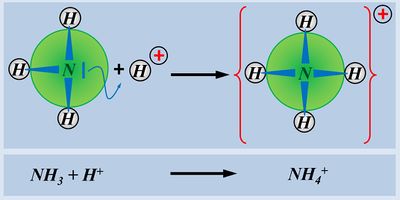
Ein einfaches Molekül, dass in der Lage ist, ein Proton aufzunehmen ist NH<sub>3</sub> (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen: | Ein einfaches Molekül, dass in der Lage ist, ein Proton aufzunehmen ist NH<sub>3</sub> (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen:<br> | ||
[[Datei: | [[Datei:SäBa2_NH3_AufnahmeProton.jpg|400px]]<br> | ||
<br> | <br> | ||
| Zeile 311: | Zeile 312: | ||
|Rahmenfarbe= #DCF | |Rahmenfarbe= #DCF | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Hausaufgabe</span> | |||
|Inhalt= | |||
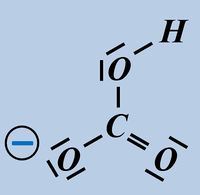
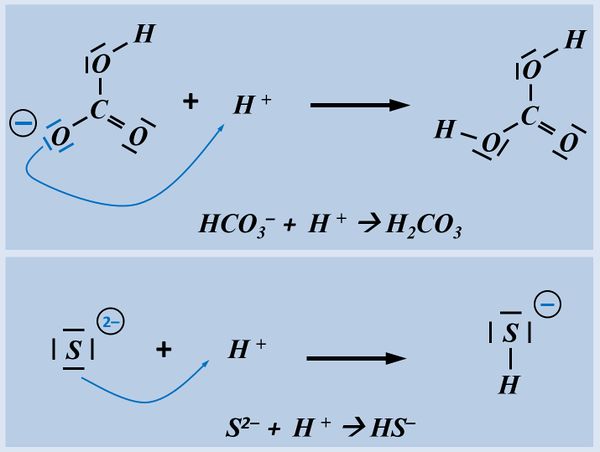
Formuliert die Aufnahme '''eines Protons''' auf Teilchen-Ebene von folgenden Basen: | |||
* Hydrogencarbonat-Ion | |||
* Sulfid-Ion | |||
[[Datei:SäBa2_HCO3minus_VSF.jpg|200px]] [[Datei:SäBa2_S2minus_VSF.jpg|200px]]<br> | |||
Bitte wirklich erst auf "Lösung" klicken, wenn ihr diesen chemischen Vorgang auf ein Stück Papier gezeichnet habt! | |||
{{Lösung versteckt| | |||
Hast Du wirklich die Lösung schon gezeichnet? | |||
{{Lösung versteckt| | |||
[[Datei:SäBa2_HA_ML.jpg|600px]] | |||
|Ja!|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | }} | ||
<br> | <br> | ||
Version vom 1. Mai 2020, 15:52 Uhr
neuer Test
Arbeitsauftrag für den 04.05.