10e 2022 23/BioChemie: Unterschied zwischen den Versionen
Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| (4 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 56: | Zeile 56: | ||
|Titel=<span style="color:#607">'''Referatsrunde'''</span> | |Titel=<span style="color:#607">'''Referatsrunde'''</span> | ||
|Inhalt= | |Inhalt= | ||
''' | '''- beendet - ''' | ||
Bewertungskriterien: <br> | Bewertungskriterien: <br> | ||
| Zeile 147: | Zeile 134: | ||
=== Zusammenfassung '''Organische Chemie''' === | === Zusammenfassung '''Organische Chemie''' === | ||
* Teil 1: '''Die organische Chemie''' [[Spezial:FilePath/C10EK_001_DieOrganischeChemie.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.) | * Teil 1: '''Die organische Chemie''' [[Spezial:FilePath/C10EK_001_DieOrganischeChemie.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.) | ||
* Teil 2: '''Die Welt des Kohlenstoffatoms''' [[Spezial:FilePath/C10EK_002_WeltDesCAtoms.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 91 Rest + 94 | |||
<span style="color:#F00;"> Neu, 19.06.:</span><br> | |||
* Teil 3: '''Die einfachsten organischen Moleküle: Kohlenwasserstoffe''' [[Spezial:FilePath/C10EK_003_EinfacheOrg_KWs.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 96 - 97 | |||
=== Ein wichtiger Reaktionstyp: '''Die Säure-Base-Reaktion''' === | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Die Säure-Base-Reaktion'''</span> | |||
|Inhalt= | |||
Ihr habt im Unterricht '''Säuren''' und '''Basen '''kennengelernt. Hier noch einmal eine Kurz-Zusammenfassung über deren typische Eigenschaften auf molekularer Ebene: | |||
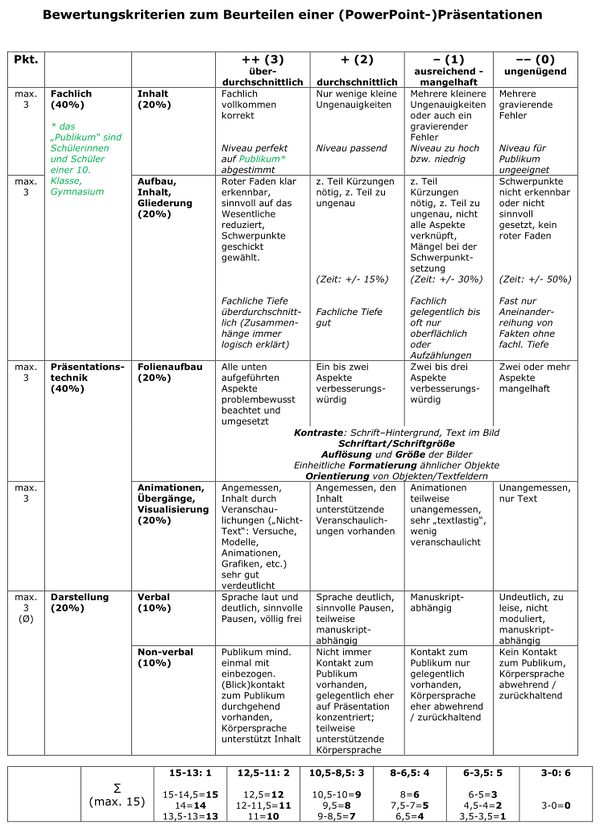
* Säuren können aus einer heterolytischen Bindung zwischen einem Wasserstoff-Atom und einem anderen Atom ein '''Proton abspalten''', z.B. HCl (Hydrogenchlorid):<br> | |||
[[Datei:SäBa3_HCl_alleine.jpg|800px]] | |||
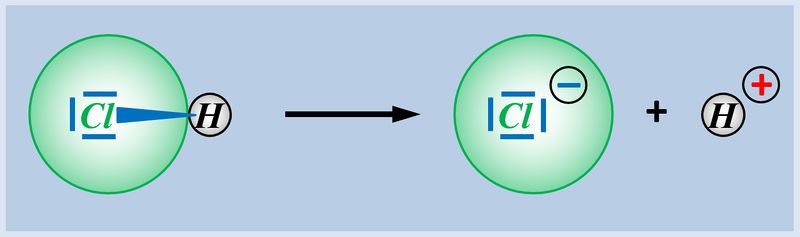
* Basen können ein Proton über ein freies Elektronenpaar ein Proton binden, also aufnehmen, z.B. NH<sub>3</sub> (Ammoniak) | |||
[[Datei:SäBa3_NH3_alleine.jpg|800px]] | |||
<br> | |||
Protonen können aber weder von Säuren einfach so "ins Freie" abgegeben werden, noch fliegen Protonen einfach so in der Gegend herum und können von Basen beliebig aufgenommen werden. Dazu ist immer ein Reaktionspartner nötig, der diese Protonen aufnimmt oder hergibt.<br> | |||
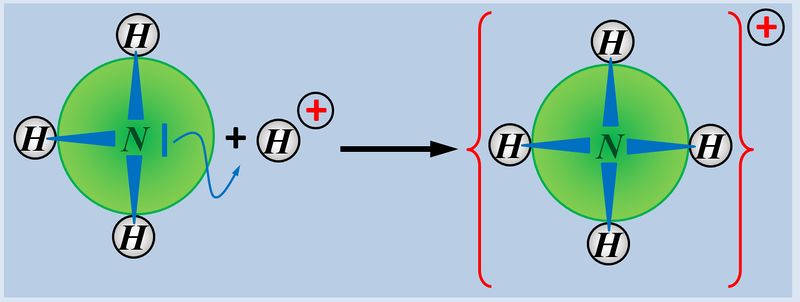
Insofern sind '''Säuren und Basen''' hervorragende '''Reaktionspartner''' und reagieren in einer typischen '''"Säure-Base-Reaktion"''' miteinander:<br> | |||
[[Datei:SäBa3_HCl_mit_NH3.jpg|800px]]<br> | |||
<br> | |||
Wie ihr sehen könnt, entsteht bei dieser Reaktion ein Salz. Also ein Stoff, der aus positiv geladenen Teilchen (hier NH<sub>4</sub><sup>+</sup>) und negativ geladenen Teilchen (hier: Cl<sup>-</sup>) aufgebaut ist. Salze entstehen auch bei der Reaktion von Metallen mit Nichtmetallen, z.B. von Natrium mit Chlor. | |||
* Vergleicht diese beiden Reaktionstypen miteinander! "Vergleichen" heißt: Gemeinsamkeiten und Unterschiede herausstellen. | |||
{{Lösung versteckt| | |||
* Bei der Salzbildung aus '''Metall und Nichtmetall''' gibt das Metall '''Elektronen '''ab, das Nichtmetall nimmt Elektronen auf. | |||
* Bei der Salzbildung aus '''Säure und Base''' gibt die Säure ein '''Proton '''ab, die Base nimmt ein Proton auf. | |||
* Gemeinsamkeit: In beiden Fällen entstehen unterschiedlich geladene Ionen, die das Salz bilden. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Die direkte Reaktion einer Säure mit einer Base betrachtet man an dieser Stelle im Unterricht eher selten. Einfach deswegen, weil viele Säure-Base-Reaktionen im Wasser ablaufen. Und Wasser hat ein besondere Eigenschaft. <br> | |||
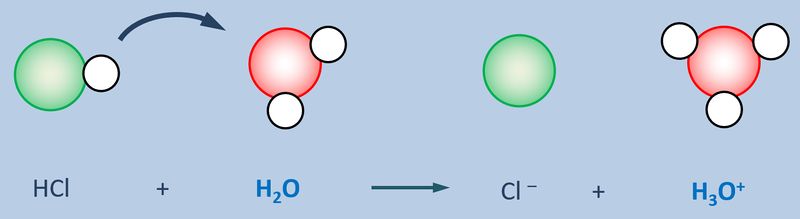
Betrachtet zunächst die hier stark vereinfacht dargestellte Reaktion, die beim Einleiten von HCl-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Ein HCl-Molekül gibt ein Proton an ein Wassermolekül ab. Es entsteht ein Chlorid-Ion und ein Oxonium-Ion (den Namen wusstet ihr vielleicht noch nicht, auch "H<sub>3</sub>O<sup>+</sup>-Teilchen" wäre o.k. gewesen. | |||
|Lösung|Lösung ausblenden}} | |||
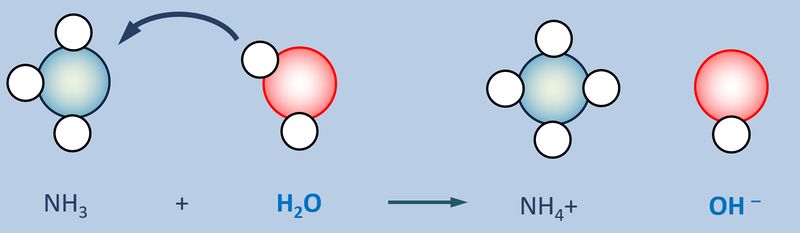
Betrachtet nun die stark vereinfacht dargestellte Reaktion, die beim Einleiten von NH<sub>3</sub>-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:SäBa3_NH3_und_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Ein Ammoniak-Molekül entreißt einem Wasser-Molekül ein Proton. Es entsteht ein Ammonium-Ion (NH<sub>4</sub><sup>+</sup>-Teilchen) und ein Hydroxid-Ion (OH<sup>-</sup>-Teilchen) | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Legt nun den Fokus eurer Betrachtung auf das Wassermolekül. Zunächst zur oberen Gleichung (HCl wird in Wasser eingeleitet): Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton aufgenommen. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Basen. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Jetzt zur unteren Gleichung (NH<sub>3</sub> wird in Wasser eingeleitet): Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton abgegeben. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Säuren. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Der Einfluss des Wassers'''</span> | |||
|Inhalt= | |||
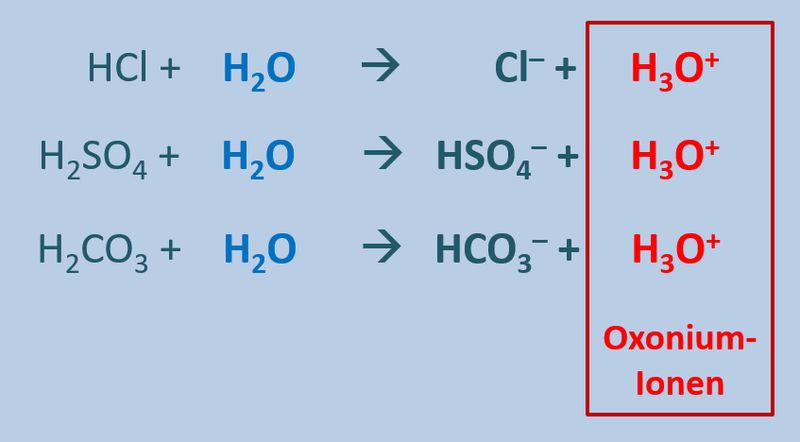
Diese Eigenschaft von Wasser führt dazu, dass beim Zugeben von einer '''Säuren''' (egal welcher) zu Wasser '''saure Lösungen''' entstehen, die alle eine Gemeinsamkeit haben: Sie enthalten das Oxonium-Ion H<sub>3</sub>O<sup>+</sup>:<br> | |||
[[Datei:SäBa3_divSä_undH2O.jpg|800px]]<br> | |||
<br> | |||
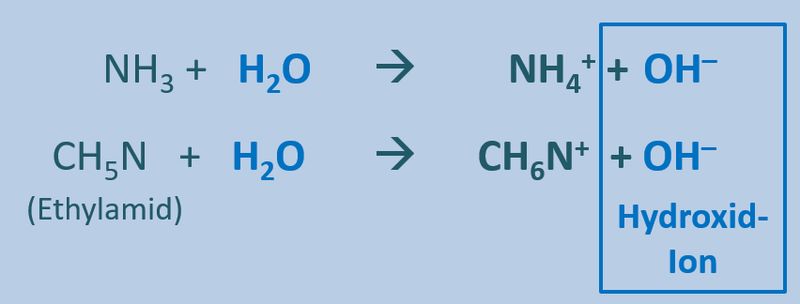
Ähnliches gilt für Basen. Egal welche '''Basen''' man in Wasser gibt, es entstehen immer '''basische Lösungen''', die das Hydroxid-Ion enthalten OH<sup>-</sup>:<br> | |||
[[Datei:SäBa3_divBa_undH2O.jpg|800px]]<br> | |||
<br> | |||
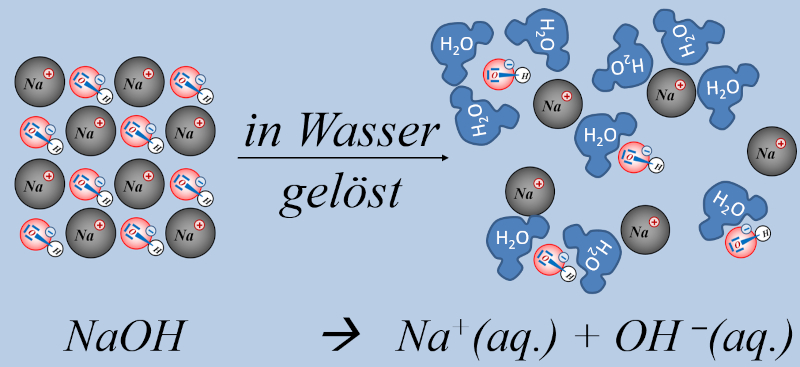
Allerdings gibt es noch eine andere Stoffgruppe, die zu '''basischen Lösungen''' führt, in denen OH<sup>-</sup>-Ionen enthalten sind: Nämlich Hydroxid-Salze, wie z.B. NaOH oder KOH oder Ca(OH)<sub>2</sub>. All diese Salze lösen sich in Wasser und setzen dabei Hydroxid-Ionen frei, ohne dass eine chemische Reaktion mit Wasser stattfinden müsste. Das Ergebnis ist aber ein ähnliches wie mit NH<sub>3</sub>, es entsteht eine '''basische Lösung''', die Hydroxid-Ionen enthält:<br> | |||
[[Datei:SäBa3_NaOH_und_H2O_V2.jpg|800px]]<br> | |||
Das '''"(aq.)"''' bedeutet, diese Teilchen liegen frei beweglich im Wasser vor und sind '''von Wasserteilchen umringt''', kurz: Sie sind '''aquatisiert'''. | |||
<br> | |||
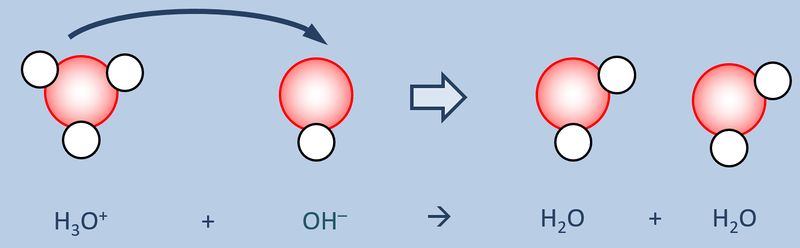
Schüttet man nun eine '''saure Lösung''' und eine '''basische Lösung''' zusammen, so reagieren eigentlich nicht die Säure und die Base direkt miteinander, sondern die bereits vorher durch den Kontakt mit Wasser gebildeten Oxonium-Ionen H<sub>3</sub>O<sup>+</sup> mit den Hydroxid-Ionen OH<sup>-</sup>:<br> | |||
[[Datei:SäBa3_H3O_und_OH.jpg|800px]]<br> | |||
<br> | |||
Diese Reaktion führ zu einer Verringerung der Oxonium- bzw. Hydroxid-Ionen, die für den sauren bzw. basischen Charakter verantwortlich waren. Die entstehende Lösung ist also weder sauer noch basisch sondern neutral. '''Man kann also sagen, Säuren und Basen neutralisieren sich gegenseitig.''' | |||
<br> | |||
Schüler formulieren folgende Aufgabe oft "stark vereinfacht": | |||
* Formuliere die Neutralisationsgleichung für die Reaktion von Natronlauge mit Salzsäure: | |||
<br> | |||
Lösung der Schüler: HCl + NaOH --> H<sub>2</sub>O + NaCl<br> | |||
<br> | |||
Was dabei übersehen wird: '''Salzsäure''' ist nicht das selbe wie '''HCl'''. '''HCl''' ist ein Gas. Wenn dieses in Wasser gelöst wird, entsteht erst die "Salzsäure". Formuliert die Gleichung für diese Reaktion! | |||
{{Lösung versteckt| | |||
HCl + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup>(aq.) + Cl<sup>-</sup>(aq.)<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Auch NaOH ist nicht das gleiche wie Natronlauge. Diese entsteht erst durch Lösen von NaOH in Wasser. Formuliert die Gleichung für diese Reaktion! | |||
{{Lösung versteckt| | |||
NaOH --> Na<sup>+</sup>(aq.) + OH<sup>-</sup>(aq.) | |||
|Lösung|Lösung ausblenden}} | |||
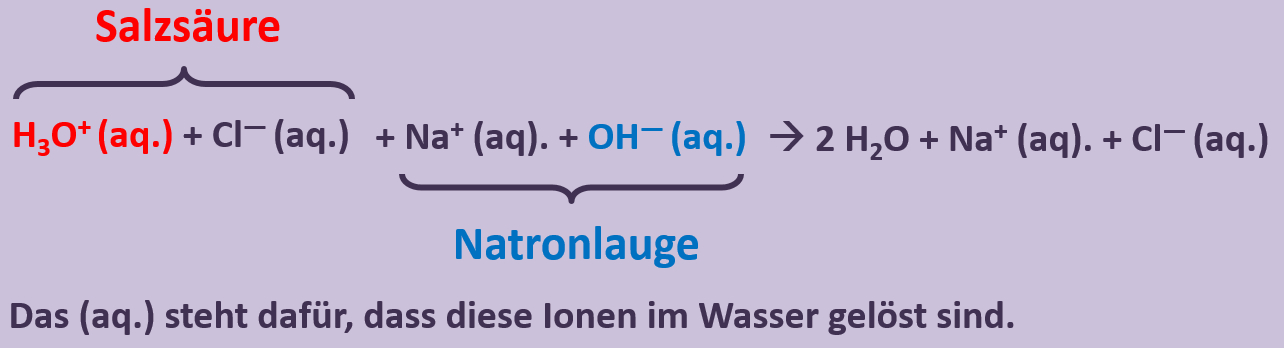
Man sollte also besser formulieren: <br> | |||
[[Datei:SäBa3_NaOH_und_HCl_mit_H2O.jpg]]<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
1. Formuliert die Reaktion von folgenden Stoffen mit Wasser: | |||
* Schwefelsäure | |||
* Iodsäure (HIO<sub>3</sub>) | |||
2. Formuliert die Neutralisationsreaktion von Schwefelsäure H<sub>2</sub>SO<sub>4</sub> mit Calciumhydroxid Ca(OH)<sub>2</sub><br> | |||
<br> | |||
Die Lösung für diese Aufgaben braucht ihr nicht über den Schulmanager zu schicken. Wir verbessern sie gemeinsam in der nächsten Videokonferenz am Dienstag, 02.03. | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Einüben der letzten Einheit'''</span> | |||
|Inhalt= | |||
Zur Wiederholung: Was solltet ihr im Moment wissen: | |||
* Säuren sind Stoffe, die im Wasser mind. ein Proton abgeben. | |||
* Allgemein kann man daher für die Reaktion einer Säure mit Wasser formulieren: HX + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup> + X<sup>-</sup> | |||
** Typische Beispielaufgabe: Formuliere die Reaktion von Hydrogenchlorid (einer Säure) mit Wasser! | |||
** HCl + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup> + Cl<sup>-</sup> | |||
* Durch das Einleiten einer Säure in Wasser entstehen also '''saure Lösungen'''. Diese enthalten immer''' H<sub>3</sub>O<sup>+</sup>-Ionen''' | |||
<br> | |||
* Basen sind Stoffe, die mind. ein Proton aufnehmen können. | |||
* Allgemein kann man daher für die Reaktion einer Base mit Wasser formulieren Y + H<sub>2</sub>O --> OH<sup>-</sup> + HY<sup>+</sup> | |||
* Ein konkretes Beispiel wäre das Einleiten von NH<sub>3</sub> (Ammoniak, eine Base) in Wasser: NH<sub>3</sub> + H<sub>2</sub>O --> OH<sup>-</sup> + NH<sub>4</sub><sup>+</sup> | |||
* Durch das Einleiten einer Base in Wasser entstehen also '''basische Lösungen'''. Diese enthalten immer''' OH<sup>-</sup>-Ionen''' | |||
* Achtung: Es gibt einen anderen Weg, wie basische Lösungen entstehen können, auch ohne, dass eine Base im Wasser den Wassermolekülen ein Proton entreißt: Es gibt einige Salze, die das OH<sup>-</sup>-Ion im Kristallgitter enthalten. Wenn man diese Salze in Wasser löst und die Ionen von Wassermolekülen umringt werden (aquatisiert werden), entstehen auch basische Lösungen mit den typischen OH<sup>-</sup>-Ionen | |||
** Typisch Beispielaufgabe: Formuliere die Reaktion von Natriumhydroxid mit Wasser! | |||
** NaOH --> Na<sup>+</sup>(aq.) + OH<sup>-</sup>(aq) | |||
<br> | |||
* Schüttet man basische und saure Lösungen im genau richtigen Verhältnis zusammen in ein Gefäß, reagieren die OH<sup>-</sup>-Ionen der basischen Lösung mit den H<sub>3</sub>O<sup>+</sup>-Ionen der sauren Lösung zu Wasser. Die Lösungen neutralisieren sich gegenseitig | |||
* Gleichung: OH<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> --> 2 H<sub>2</sub>O. | |||
* Übrig bleiben die anderen Ionen (z.B. das positive Metallkation des Salzes und der negativ geladene Säurerest), die zusammen ein Salz ergeben. Dieses Salz kann man benennen. | |||
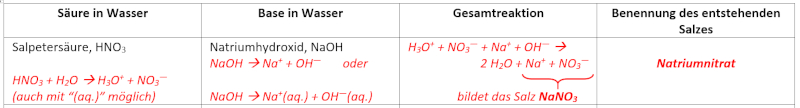
** Typische Beispielaufgabe: Formuliere in einer chemischen Gleichung die Neutralisation, von '''wässriger HCl-Lösung''' (heißt auch "'''Salzsäure'''") mit '''NaOH-Lösung''' (heißt auch '''Natronlauge''')! | |||
** H<sub>3</sub>O<sup>+</sup> + Cl<sup>-</sup> + Na<sup>+</sup> + OH<sup>-</sup> --> 2 H<sub>2</sub>O + Cl<sup>-</sup> + Na<sup>+</sup> | |||
** Man kann jederzeit auch "(aq.)" dazu schreiben (außer beim Wasser): H<sub>3</sub>O<sup>+</sup>(aq.) + Cl<sup>-</sup>(aq.) + Na<sup>+</sup>(aq.) + OH<sup>-</sup>(aq.) --> 2 H<sub>2</sub>O + Cl<sup>-</sup>(aq.) + Na<sup>+</sup>(aq.) | |||
<br> | |||
* Etwas schwieriger wird es, wenn die Säure eine andere Anzahl an Protonen abgibt, als die Base aufnimmt. Dann muss man mit entsprechenden Koeffizienten (das sind in einer chemischen Gleichung die Zahlen vor den chemischen Formeln) arbeiten: | |||
** Formuliere in einer chemischen Gleichung die Neutralisation, von wässriger H<sub>2</sub>SO<sub>4</sub>-Lösung mit '''NaOH-Lösung''' (heißt auch '''Natronlauge''')! | |||
** Nachdem die Schwefelsäure in Wasser 2 Protonen abgeben kann, braucht man doppelt so viele NaOH-Teilchen, um die Schwefelsäure zu neutralisieren. Denn aus einem NaOH-Teilchen entsteht im Wasser ja nur ein OH<sup>-</sup>-Teilchen, welches auch nur ein Proton aufnehmen kann. | |||
** 2 H<sub>3</sub>O<sup>+</sup> + SO<sub>4</sub><sup>2-</sup> + 2 Na<sup>+</sup> + 2 OH<sup>-</sup> --> 4 H<sub>2</sub>O + SO<sub>4</sub><sup>2-</sup> + 2 Na<sup>+</sup> | |||
<br> | |||
Mit diesen Hinweisen solltet ihr das folgende Arbeitsblatt komplett lösen können. Eine Lösung hier im WIKI gibt es erstmal nur für die erste Aufgabe. Solltet ihr nicht weiter wissen, dann müsst ihr selbständig die letzten Einheiten wiederholen. Ich erwarte, dass ihr am kommenden Donnerstag alle die Lösung habt! | |||
<br> | |||
<br> | |||
Hier das Arbeitsblatt als [[Spezial:FilePath/C9NTG_PP23_NeutralisationAB_Corona.pdf|pdf-Datei]]<br> | |||
(Ihr braucht das AB nicht ausdrucken! - Ihr bekommt nach der Verbesserung eine Lösung als pdf-Datei.) | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_NeutrReak_AB_MLA1.jpg]] | |||
|Lösung für A1|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
Aktuelle Version vom 2. Juli 2023, 08:39 Uhr
Termine
Eigenverantwortliches Lernen: Mittwoch, 03.05.
Referate
Wie man Grafiken interpretiert
Das Interpretieren von Grafiken (auch Tabellen oder Karikaturen) ist eine oft verlangte Fähigkeit von Oberstufen-Schülern. Ich empfehle folgendes Vorgehen:
- Man beginnt mit einer Beschreibung
- Was zeigt die Grafik? (y-Achse und x-Achse in Beziehung setzen, z.B. mit der Formulierung: "Die Grafik zeigt das was auf der y-Achse steht in Abhängigkeit von dem was auf der x-Achse steht.)
- Welche Zusammenhänge sind zu sehen? Man verzichtet zunächst auf Erklärungen/Begründungen, bleibt zunächst noch bei einer reinen Beschreibung (Schöne Formulierungen: "Je ...größer/kleiner/höher/niedriger/usw. desto ..."
- Erst zum Schluss versucht man die Zusammenhänge zu erklären. Je nach behandeltem Stoff im Unterricht kann diese Erklärung recht umfangreiches Wissen verlangen. Gelegentlich sind hier auch Hypothesen über eine mögliche Begründung verlangt, die noch nicht besprochen wurden.
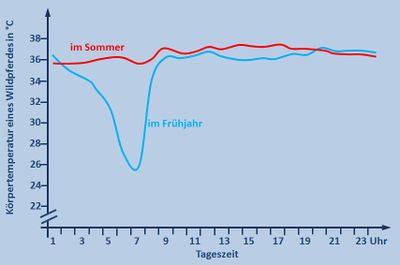
Abb. selbst erstellt, Originalgrafik: Kuntz, Regina; Der versteckte Winterschlaf der Wildpferde; Spektrum der Wissenschaft; August 2008; S. 46 - 53, 2008
Versucht zunächst selbst diese Grafiken zu interpretieren. - Lasst euch dann die Lösung anzeigen.
- Die Grafik zeigt die Körpertemperatur eines Wildpferdes in Abhängigkeit von der Uhrzeit einmal im Sommer und einmal im Winter.
- Im Sommer bleibt die Körpertemperatur den ganzen Tag konstant bei 36°C. Im Frühjahr sinkt die Körpertemperatur nachts und in den frühen Morgenstunden um 10°C auf 26°C ab. Ab 08:00 Uhr steigt sie wieder auf 36°C und bleibt dann konstant.
- Im Unterricht könnte man dazu folgendes besprochen haben: Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.
Biologie
Skript "Verdauung"
1. Verdauungsorgane: Überblick (nur AB)
2. Verdauungsprozesse im Mund als pdf-Datei
3. Verdauungsprozesse im Magen als pdf-Datei (Buch, S. 26, Abs. 1-5)
- Einschub: Enzympraktikum als pdf-Datei
4. Verdauungsprozesse im Dünndarm als pdf-Datei (Buch, S. 26 ab "Der Dünndarm" - S. 27)
Skript "Ökologie"
- Teil 1: "Grundbegriffe" als pdf-Datei, s. Buch S. 62/63
- Teil 2: "Einflussfaktoren auf Lebewesen" Buch, S. 64/65 +
- Teil 3: "Vitalitätskurven" als als pdf-Datei, s. Buch, S. 70
- Teil 4: "Nischenbildung" als als pdf-Datei, s. Buch, S. 88/89
- Teil 5: Tiergeographische Regeln als pdf-Datei, s. Buch, S. 66/67
Neu, 29.03.23:
- Teil 6: Umweltfaktor Licht bei Pflanzen pdf-Datei, s. Buch, S. 68
- Teil 7: Umweltfaktor Wasser bei Pflanzen pdf-Datei, nicht explizit im Buch
Grundlagen in Chemie
Zum Abschluss einer jeden Einheit gibt es ein etwas ausführlicheres Skript zu den behandelten Inhalten. Bis ihr die richtigen Bücher habt, um die im Unterricht besprochenen Themen aufzuarbeiten erhaltet hier die Screenshots der "Hefteinträge":
1. Grundlegende Überlegungen zur Vorstellung vom Atombau als pdf-Datei
2. Der Bau der Elektronenhülle als pdf-Datei
3. Bau der Elektronenhülle und PSE als pdf-Datei
4. Bildung von Ionen als pdf-Datei
5. Salze: Zusammenhang zwischen Bau und Eigenschaften als pdf-Datei
- Am 11.01. wurden zum Abschluss der Thematik die folgenden Aufgaben aus dem Buch (Galvani S1), S. 104 bearbeitet: 1, 4, 6, 7, 8, 10, 11 (schwer, evtl. S. 92 unten lesen), 15.
- Lösungsvorschläge als pdf-Datei
6. Die Atombindung: Teilen macht glücklich als pdf-Datei
7. Metalle als pdf-Datei
Zusammenfassung Atombau
Zusammenfassung Aufbau des PSE
Zusammenfassung Bindungsarten
Zusammenfassung Organische Chemie
- Teil 1: Die organische Chemie pdf-Datei, s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.)
- Teil 2: Die Welt des Kohlenstoffatoms pdf-Datei, s. Buch (Galvani S2), S. 91 Rest + 94
Neu, 19.06.:
- Teil 3: Die einfachsten organischen Moleküle: Kohlenwasserstoffe pdf-Datei, s. Buch (Galvani S2), S. 96 - 97
Ein wichtiger Reaktionstyp: Die Säure-Base-Reaktion