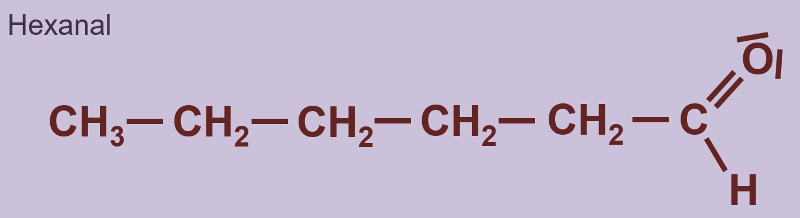10d 2020 21/Chemie/Archiv: Unterschied zwischen den Versionen
(Archiv angelegt) Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
==Lernen zu Hause== | ==Lernen zu Hause== | ||
=== Distanzunterricht Dienstag, 18.05. === | |||
Heute mal was kreatives! Aber schon auch eine fachliche Vorbereitung auf das letzte Kapitel in diesem Schuljahr: '''Biomoleküle'''.<br> | |||
In diesem letzten Kapitel sollt ihr vieles, was ihr über '''organische Verbindungen''' bisher gelernt habt auf Moleküle übertragen, die für Lebewesen eine wichtige Rolle spielen. Tatsächlich solltet ihr in '''Biologie '''über diese Moleküle bereits gesprochen haben. Und genau aus diesem Grund bekommt ihr jetzt auch diese Aufgabe gestellt: Verarbeitet euer bereits vorhandenes Wissen über die '''Kohlenhydrate''', '''Fette '''und '''Eiweiße '''zu einem ästhetisch anspruchsvollen, '''wissenschaftlichen Poster'''!<br> | |||
Wissenschaftliche Poster sind zu einem beliebten Mittel geworden, um kleinere (aber auch größere) Forschungsarbeiten übersichtlich und anschaulich zu präsentieren. Wenn ihr euch genauer über "wissenschaftliche Poster" informieren wollt, dann könnt ihr z.B. folgenden Links folgen: | |||
* Die Studienwerkstatt der Uni-Bremen hat ein pdf-Dokument mit etlichen Tipps zusammengestellt: [https://www.uni-bremen.de/fileadmin/user_upload/sites/studierwerkstatt/Leitfaden_wissenschaftliche_Poster_erstellen.pdf Hier klicken] | |||
* In dem pdf-Dokument sind auch zwei Seiten verlinkt, auf denen man bereits fertige wissenschaftliche Plakate anschauen kann: [https://www.geo.uni-halle.de/geooekologie/pr/poster/ Zum Beispiel hier] oder [https://projects.ncsu.edu/project/posters/ExamplePosters.html hier] | |||
* So ein richtig wahnsinnig schönes yt-Video habe ich auf die Schnelle leider nicht gefunden. Ihr könnt natürlich "wissenschaftliches Poster" bei Google oder Youtube eingeben und ihr werdet tausende von Treffern erhalten, aber die ersten fünf, die ich mir angeschaut habe, hatten alle irgendwelche Haken. | |||
<br> | |||
<br> | |||
'''Ein paar einfache Tipps''': | |||
* Verwendet ein '''Präsentationsprogramm''', um ein Poster zu erstellen. Hier lassen sich Texte, Bilder, Grafiken etc. am einfachsten anordnen und formatieren. | |||
* '''Hochformat '''ist günstiger (Entwurf --> Foliengröße --> Benutzerdefinierte Foliengröße --> "4:3" und "Hochformat" auswählen) | |||
* Geht sparsam mit grellen '''Farben''' und/oder Kontrasten um. Bleibt am besten in einer "Farbfamilie". | |||
* Poster werden in der Regel relativ groß ausgedruckt (DIN A2, A1 oder sogar A0), daher könnt ihr auch eine sehr kleine '''Schriftgröße''' (10pt) verwenden. Diese ist immer noch gut lesbar. '''ABER ACHTUNG:''' | |||
* '''Niemand '''will ein Poster lesen, das Gigatonnen an '''Text''' enthält! Versucht eure fachlichen Inhalte gut zu '''veranschaulichen'''. | |||
<br> | |||
<br> | |||
'''Inhalt''': | |||
* Als Ausgangspunkt könnt ihr eure '''Biologie-Schulbuch''' verwenden (S. 18, 19) | |||
* Ihr könnt natürlich auch im Internet recherchieren. | |||
* Bleibt inhaltlich aber bei dem, was ihr schon gelernt (inzwischen aber vielleicht wieder vergessen) habt. | |||
* Zum Veranschaulichen eurer Inhalte könnt ihr selbst Fotos machen (z.B. von Nahrungsmitteln), selbst Symbole erstellen (ähnlich wie die Abbildungen auf S. 18 im Bio-Schulbuch) oder auch Grafiken aus dem Netz verwenden (z.B. Gehalt von ungesättigten Fettsäuren in verschiedenen Ölsorten) | |||
<br> | |||
Das folgende Plakat wurde mit PowerPoint erstellt und enthält keinerlei sinnvollen Inhalt. Es geht lediglich darum, zu zeigen, wie eine grundsätzliche Aufteilung aussehen könnte:<br> | |||
<br> | |||
[[Datei:C10NTG_PosterVorschlag.jpg|800px]]<br> | |||
<br> | |||
Verwendet nicht mehr als 90min. für diesen Arbeitsauftrag! Man kann sicher deutlich mehr Zeit investieren, um immer mehr Details zu erzeugen, aber ihr sollt auch lernen, mit der Ressource Zeit effektiv umzugehen. Ich empfehle daher zunächst das Plakat in Grundzügen zu entwerfen und je nach zur Verfügung stehender Zeit nach und nach Aspekte zu vertiefen, zu verfeinern oder optisch aufzuhübschen. Beim "linearen Arbeiten" (das heißt: Ich fange oben auf dem Plakat an und mache alles sofort super genau und super schön) kann es leicht passieren, dass die zur Verfügung stehende Zeit aufgebraucht ist und das Plakat aber noch lange nicht fertig wird. Das sollte nicht passieren.<br> | |||
Speichert die Präsentation als pdf-Datei ab und schickt sie mir als Antwort auf den Arbeitsauftrag im Schulmanager. Wir hören uns morgen (Mittwoch, 19.05.) in einer Videokonferenz. | |||
=== Distanzunterricht Dienstag, 11.05.=== | |||
Da ich heute (Di, 11.05.) und morgen (Mi, 12.05.) aufgrund des Abiturs stark in organisatorische Aufgaben an der Schule eingebunden bin, müsst ihr an diesen beiden Tagen leider alleine klar kommen. Vergesst aber auf keinen Fall am Dienstag bis spätestens 08:15 Uhr eure Rückmeldung auf den "Start-in-den-Tag"-Auftrag im Schulmanager!<br> | |||
<br> | |||
Ihr erhaltet hier '''drei Arbeitsaufträge''' für die '''drei Chemie-Unterrichtsstunden'''. Ich empfehle euch, jeden Arbeitsauftrag in der Zeit zu erledigen, die angegeben ist. Wenn ihr unbedingt eine andere Reihenfolge wählen wollt: Von mir aus. Für zwei Arbeitsaufträge erhaltet ihr auch im Schulmanager einen Auftrag, auf den ihr bitte eure entsprechend passende Lösung hochladet: | |||
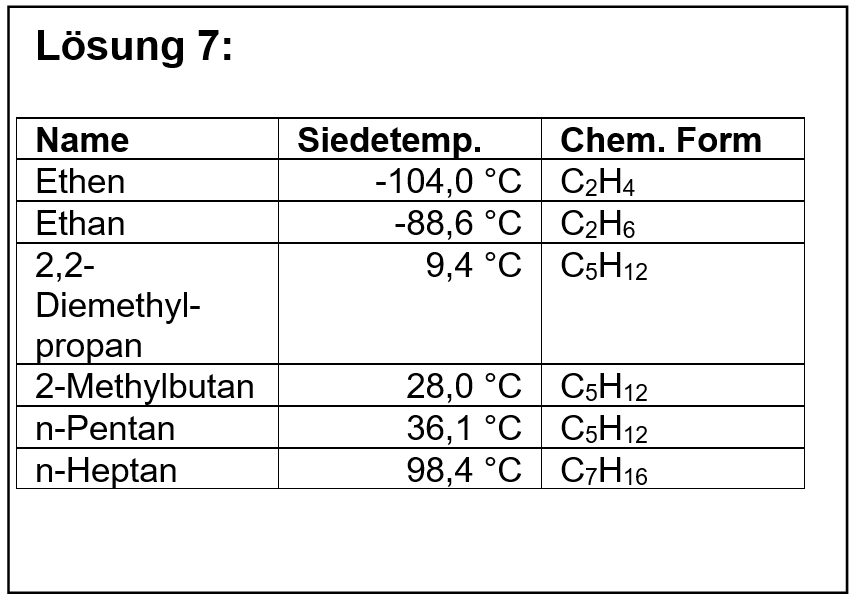
* Dienstag, 1. Std. (08:00 - 08:45 Uhr): Knobelaufgaben auf S. 132 lösen - '''Abgabe eines Lösungsvorschlags im Schulmanager erforderlich'''! | |||
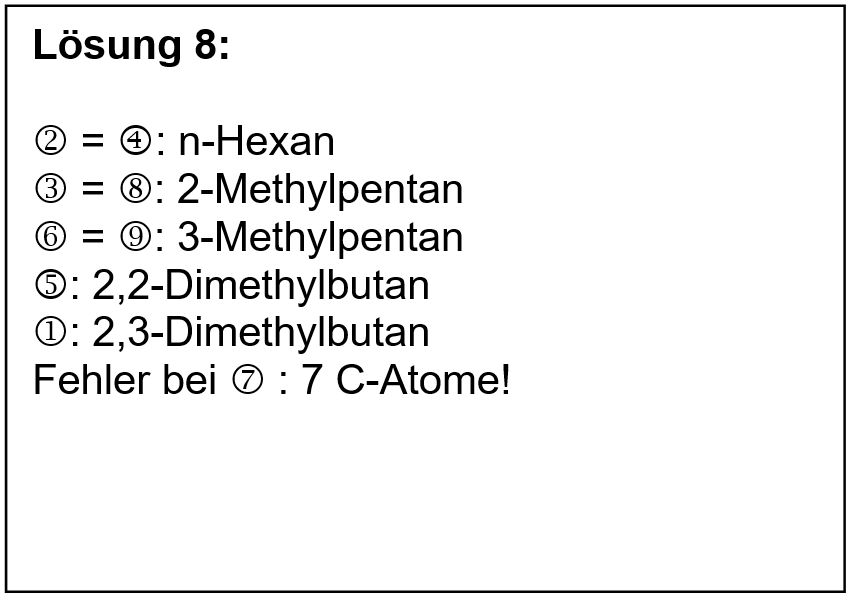
* Dienstag, 2. Std. (08:45 - 09:30 Uhr): Abschließende Rätsel zum gesamten bislang behandelten Stoff in org. Chemie | |||
* Mittwoch, 2. Std. (09:45 - 10:30 Uhr): Versuch "CO<sub>2</sub>-Löscher" durchführen und Aufgaben dazu bearbeiten - '''Abgabe eines Lösungsvorschlags im Schulmanager erforderlich'''! Achtung: Die Aufgaben lassen sich auch lösen, wenn man den Versuch nicht durchgeführt hat (z.B. weil ihr kein Backpulver, keinen Essig oder kein Teelicht zu Hause hattet)! | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">Versuch: '''Knobelaufgaben (Säuren und Ester)'''</span> | |||
|Inhalt= | |||
Löst in eurem Buch auf der Seite 132 die folgenden Aufgaben: | |||
* Nr. 1 | |||
* Nr. 2 | |||
* Nr. 3: Der Begriff "Disproportionierung" ist z.B. hier erklärt: [https://de.wikipedia.org/wiki/Disproportionierung Wikipedia] | |||
* Nr. 4 | |||
* Nr. 7: Evtl. hilft hier der folgende verlinkte Abschnitt: [https://de.wikipedia.org/wiki/Schweiß#Zusammensetzung_und_Eigenschaften_des_menschlichen_Schweißes Wikipedia]. Nur den verlinkten Abschnitt, nicht die ganze Seite lesen (also natürlich dürft ihr das, aber ihr müsst es nicht) | |||
* Nr. 8: '''Eisessig''' ist eine weitere Bezeichnung für '''reine Essigsäure'''. Diese hat einen Schmelzpunkt von 17°C. Bewahrt man Eisessig daher im Kühlschrank auf, liegt ein (kalter) Feststoff vor. | |||
<br> | |||
<span style="color:#007">'''Neu, 19.05.:''' Lösungsvorschläge als</span> [[Spezial:FilePath/C10NTG_Knobel132_123478.pdf|pdf-Datei]] | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Rätsel zum bisher behandelten Stoff'''</span> | |||
|Inhalt= | |||
Der folgende Link leitet euch auf eine Seite unseres "alten RMG-Wikis". Dort habe ich vor Jahren eine "Grundwissens-Seite" angelegt. Ich bin noch nicht dazu gekommen, sie ins neue Wiki umzuziehen. | |||
* Zum einen zeigt euch die Seite kompakt, was ihr in diesem Schuljahr alles schon gelernt habt (bzw. haben solltet) ;) | |||
* Darüber hinaus sind einige einfachen Rätsel enthalten. Natürlich könnt ihr euch in einigen Fällen auch nur schnell die Lösung anzeigen lassen und danach sagen "Klar, hätte ich gewusst." Ich empfehle euch aber, euren Lösungsvorschlag zunächst wirklich aufzuschreiben und dann auf den Lösungsbutton zu klicken (sofern einer vorhanden ist). Erst dann könnt ihr euch wirklich sicher sein, dass ihr die korrekte Lösung gewusst hättet. | |||
* Hier geht´s zur Grundwissens-Seite: [http://rmg.zum.de/wiki/Grundwissen_Chemie:_10._Klasse_NTG Hier klicken] | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">Versuch: '''CO<sub>2</sub>-Löscher'''</span> | |||
|Inhalt= | |||
'''Ihr benötigt:''' | |||
* ein schmales Glas, in das gerade so ein Teelicht passt | |||
* ein Teelicht | |||
* ein größeres Gefäß, z.B. Messbecher | |||
* ein Geschirrtuch (o.ä.) | |||
* ein Päckchen Backpulver | |||
* Essig oder besser: Essigessenz | |||
<br> | |||
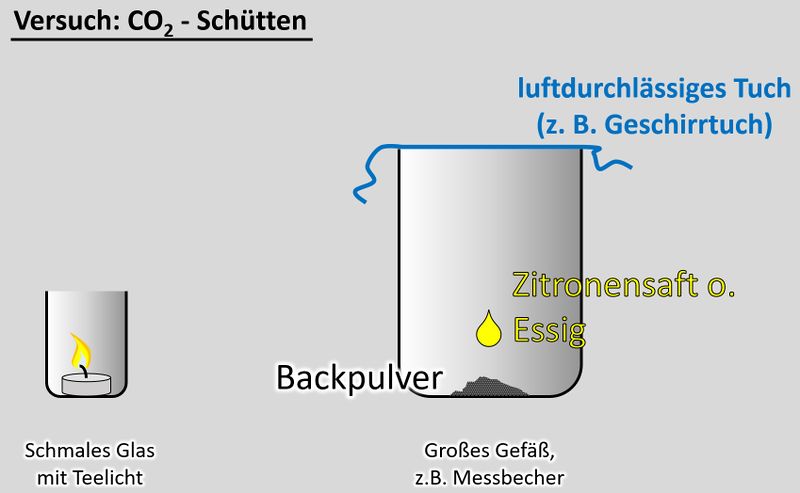
'''Durchführung''':<br> | |||
[[Datei:CO2Schütten_V.jpg|800px]]<br> | |||
* Entzündet das Teelicht im schmalen Glas | |||
* Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit | |||
* Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden. | |||
* Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann). | |||
* Zieht nun '''vorsichtig '''das Geschirrtuch ab. Gießt nun das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen! | |||
<br> | |||
'''Beobachtung/Erklärung''':<br> | |||
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie das Ergebnis aussehen könnte. | |||
{{Lösung versteckt| | |||
[[Datei:CO2Schütten_V1.gif]] | |||
|Video|Lösung ausblenden}} | |||
<br> | |||
Einen Teilprozess bei der Reaktion von Zitronensäure mit dem Hauptbestandteil des Backpulvers, Natriumhydrogencarbonat, kann man vereinfacht so formulieren: <br> | |||
<br> | |||
NaHCO<sub>3</sub> + H<sub>3</sub>O<sup>+</sup> --> CO<sub>2</sub> + 2 H<sub>2</sub>O + Na<sup>+</sup><br> | |||
<br> | |||
'''Aufgaben''' | |||
* Begründe unter Angabe von Oxidationszahlen, ob es sich bei diesem Vorgang um eine Redoxreaktion handelt! | |||
* Um die Oxidationszahlen in diesen Fällen zu bestimmen ist es zwar nicht nötig, die Valenzstrichformeln dieser Stoffe zu betrachten, trotzdem: Zeichne die Valenzstrichformel von NaHCO<sub>3</sub>, H<sub>3</sub>O<sup>+</sup>, CO<sub>2</sub> und 2 H<sub>2</sub>O | |||
* Falls es sich Deiner Meinung nach nicht um einen Redoxprozess handeln sollte, gib an, welcher Gruppe von chemischen Reaktionen man diesen Vorgang dann zuordnen könnte | |||
* Nimm zu dem folgenden Satz begründet Stellung: "In diesem Versuch tauchen C-Atome auf, also handelt es sich um organische Chemie" | |||
<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
=== Distanzunterricht Mittwoch, 05.05.=== | |||
Videokonferenz: Weitere Verbesserung des Arbeitsauftrages vom Dienstag (Milchsäure, Terephthalsäure, Lactone).<br> | |||
<br> | |||
Im Anschluss an den Versuch "Schöpfen" (27.04.) gab es einen Hefteintrag, der auf die Verschiebung des chemischen Gleichgewichts eingeht. Dieser Hefteintrag war noch nicht an der richtigen Stelle verfügbar. Falls ihr ihn noch nicht gesehen habt: Bitte druckt ihn aus und klebt ihn ins Heft oder schreibt ihn ab: [[Spezial:FilePath/C10NTG_Ester_VerschChemGG_Heft.pdf|Hier klicken]] | |||
=== Distanzunterricht Dienstag, 04.05.=== | |||
Über den Arbeitsauftrag im Schulmanager habt ihr alle 4 Arbeitstexte enthalten. Ihr müsst nur einen davon bearbeiten, die unteren Kästen zeigen euch, wer welchen Text bearbeiten soll. Zusätzlich war ein Arbeitsblatt enthalten, auf dem ihr das zu eurem Text passende Viertel nach dem Lesen des Arbeitstextes ausfüllen sollt. Falls ihr technisch dazu in der Lage seid, könnt ihr diese Aufgabe gerne zusammen erledigen, z.B. indem ihr nach dem Ausfüllen des ABs jemanden aus eurer Gruppe anruft oder auf anderem Weg kontaktiert und dann eure Lösungen vergleicht.<br> | |||
In der zweiten Stunde besprechen wir eure Ergebnisse in einer Videokonferenz: Ich werde aus jeder Gruppen jemanden aufrufen, der seine Ergebnisse vorstellt. Während ihr eure Ergebnisse vorstellt, wird das vollständig ausgefüllte Viertel des ABs eingeblendet sein, welches zu eurer Gruppe gehört. Diese Lösung findet ihr auch im unteren Kasten <br> | |||
<br> | |||
{{Box-spezial | |||
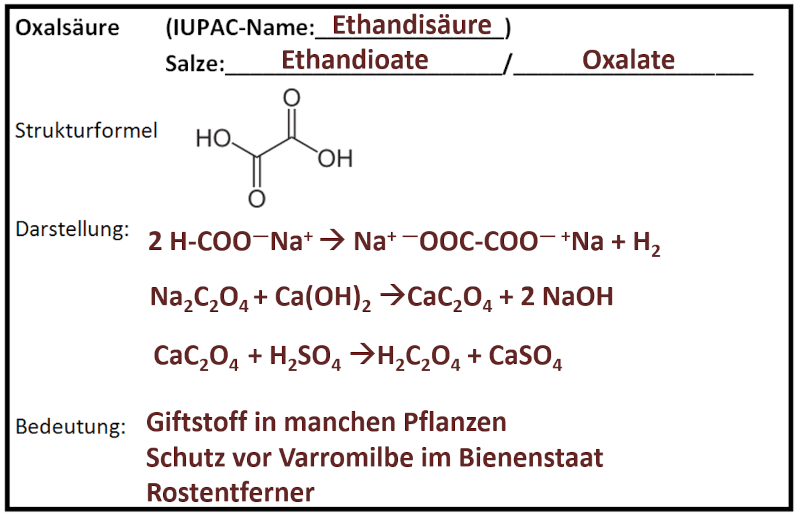
|Titel=<span style="color:#607">'''Gruppe 1: Oxalsäure'''</span> | |||
|Inhalt= | |||
'''Teilnehmer''' (Erster Buchstabe des Vornamens + Erster Buchstabe des Nachnamens, bei Verwechslungsmöglichkeiten: mehr Buchstaben des Vornamens):<br> | |||
KB, FB, MG, JaK, EN, EmS, EW<br> | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_GA_Ester_OxalsäureML.jpg]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
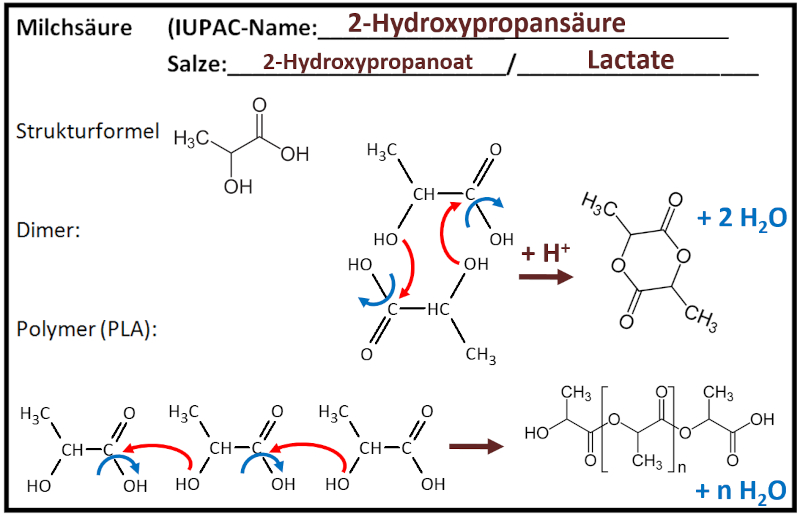
|Titel=<span style="color:#607">'''Gruppe 2: Milchsäure'''</span> | |||
|Inhalt= | |||
'''Teilnehmer''' (Erster Buchstabe des Vornamens + Erster Buchstabe des Nachnamens, bei Verwechslungsmöglichkeiten: mehr Buchstaben des Vornamens):<br> | |||
OB, VD, CH, JoK, LP, ElS, LW<br> | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_GA_Ester_MilchsäureML.jpg]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
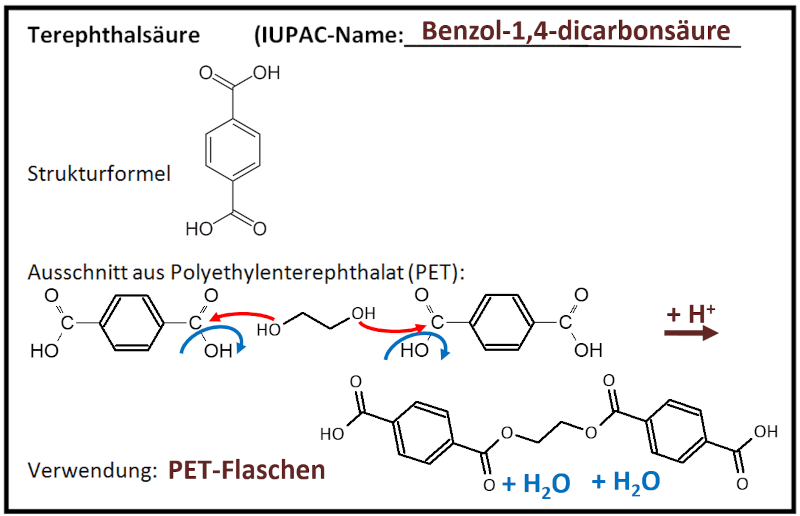
|Titel=<span style="color:#607">'''Gruppe 3: Terephthalsäure'''</span> | |||
|Inhalt= | |||
'''Teilnehmer''' (Erster Buchstabe des Vornamens + Erster Buchstabe des Nachnamens, bei Verwechslungsmöglichkeiten: mehr Buchstaben des Vornamens):<br> | |||
LiB, PD, EH, FL, AR, AT<br> | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_GA_Ester_TerephthalsäureML.jpg]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
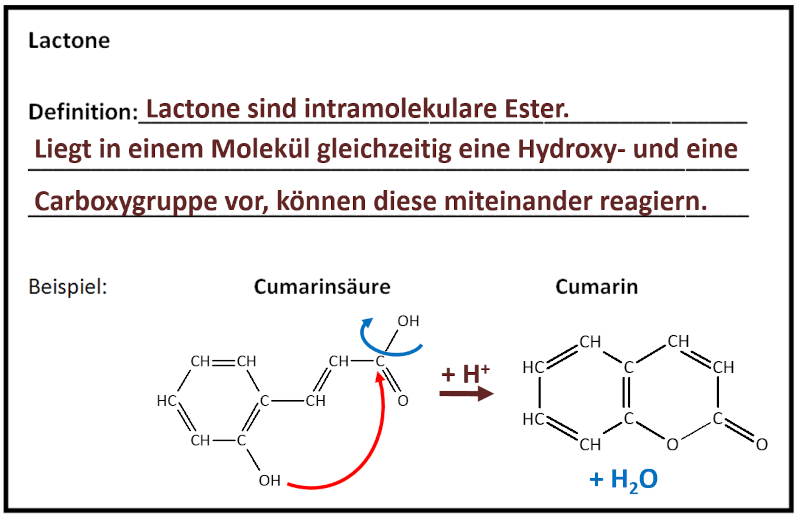
|Titel=<span style="color:#607">'''Gruppe 4: Lactone'''</span> | |||
|Inhalt= | |||
'''Teilnehmer''' (Erster Buchstabe des Vornamens + Erster Buchstabe des Nachnamens, bei Verwechslungsmöglichkeiten: mehr Buchstaben des Vornamens):<br> | |||
LeB, ME, BH, PM, LS, AW<br> | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_GA_Ester_LactoneML.jpg]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Dienstag, 27.04.=== | |||
Ihr habt in der letzten Videokonferenz gehört, dass die Esterkondensation '''im Gleichgewicht''' mit der Esterhydrolyse steht (sofern am Reaktionsraum keine Manipulationen vorgenommen werden - dazu später mehr). Das bedeutet: In einem Rundkolben, indem sich Essigsäureethylester, Essigsäure und Ethanol befinden, findet permanent die Reaktion einiger Säure- mit Alkoholmolekülen zum Ester statt, gleichzeitig reagieren aber auch einige Ester-Moleküle zurück zur Säure und dem Alkohol. Es handelt sich also um eine '''Gleichgewichtsreaktion'''. Falls ihr das noch nicht vollständig verstanden habt, lest jetzt im Buch (noch einmal) die S. 124.<br> | |||
* Hier gibt es den passenden Hefteintrag als pdf-Datei: [[Spezial:FilePath/019_020_Esterkondensation_Esterspaltung_V2.pdf|Hier klicken]] (Bitte ausdrucken und einkleben oder ins Heft abschreiben) | |||
* Heute sollt ihr einen Versuch zu Hause durchführen, der das '''dynamische Gleichgewicht''' einer solchen Gleichgewichtsreaktion simulieren kann | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Schöpfen'''</span> | |||
|Inhalt= | |||
'''Material:''' | |||
* Zwei Gefäße "A" und "B" (am besten Trinkgläser, ca. 200mL Fassungsvermögen, die Gläser sollten möglichst gerade sein; also nicht oben einen größeren Durchmesser als unten haben) | |||
* Lineal | |||
* Zwei Strohalme | |||
* Wasser | |||
* Eigentlich müsste man den Versuch mit Messzylindern durchführen, da man sehr oft das Volumen des Wassers in Milliliter in den beiden Gefäßen bestimmen muss. Es geht aber auch, wenn ihr den Flüssigkeitsstand in Milimeter mit einem Lineal messt. | |||
<br><br> | |||
'''Durchführung:''' | |||
* Gebt in das Gefäß A ca. 100mL (die Hälfte des Fassungsvermögens) Wasser, das Gefäß B bleibt leer. | |||
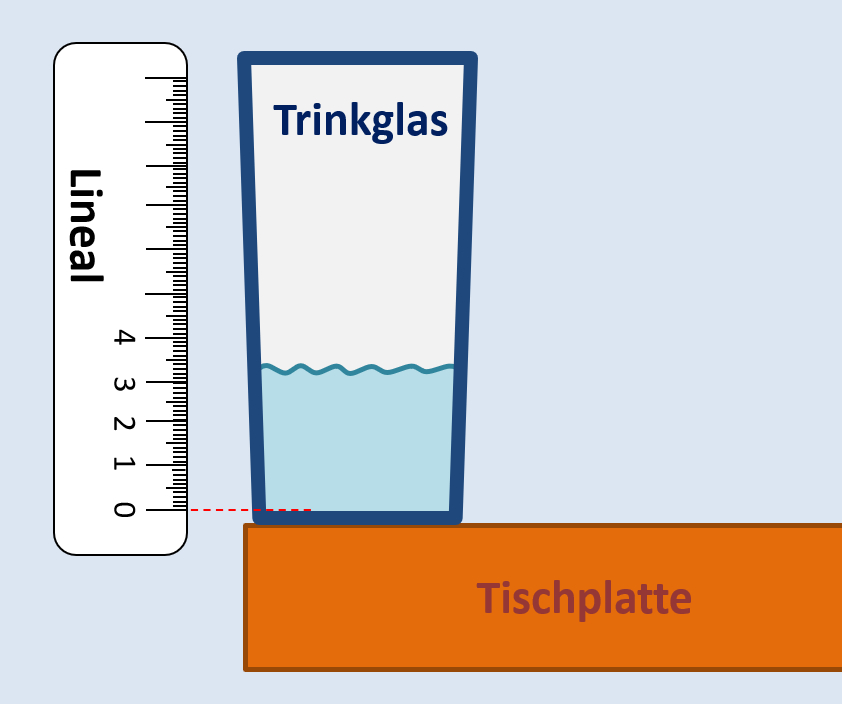
* Notiert euch den Flüssigkeitsstand (in mm) in beiden Gefäßen! (Vermutlich hat euer Glas einen dicken Boden und euer Lineal einen Rand; die 0 ist also nicht ganz am Ende des Lineals aufgedruckt. Wenn ihr ein Lineal so hinhalten könnt, dass sich die "0" genau am '''inneren '''Boden des Glases befindet: Perfekt. Wenn der Boden zu dünn, bzw. der Rand des Lineals zu lang ist, dann schiebt euer Glas an den Rand des Tisches, so könnt ihr den Flüssigkeitsstand exakt (+/-) messen (s. Bild unten). | |||
* In beide Gefäße wird nun gleichzeitig ein Strohhalm eingetaucht, bis sie den Boden berühren. | |||
* Nun verschließt man mit den Zeigefingern die Löcher am oberen Ende der Strohhalme. | |||
* Tauscht nun die Strohhalme in den Gefäßen aus '''ohne den Finger vom oberen Loch zu nehmen''': Der Strohhalm aus Gefäß A kommt in Gefäß B, der Strohhalm aus Gefäß B kommt in Gefäß A. | |||
* Erst jetzt dürft ihr die Finger vom Strohhalm nehmen. Die im Strohhalm "festgehaltene" Flüssigkeit aus Gefäß A sollte nun in das Gefäß B fließen und umgekehrt (beim ersten Mal natürlich noch nicht, weil ja in Gefäß B noch nichts drin war). | |||
* Messt und notiert erneut den Flüssigkeitsstand in beiden Gefäßen! | |||
* Wiederholt diesen Vorgang mindestens 20 - 30 mal, am besten so lange, bis sich am Flüssigkeitsstand in beiden Gefäß nur noch wenig ändert. | |||
* Zeichnet mit euren Werten ein Diagramm: X-Achse: „Schöpfzyklus“, y-Achse: Flüssigkeitsstand in mm. Verbindet alle Punkte, die zum Gefäß A gehören zu einer "schönen Kurve" und alle Punkte, die zum Gefäß B gehören zu einer zweiten Kurve in einer anderen Farbe. | |||
* Von eurem Ergebnis schickt ihr mir ein Foto auf den Arbeitsauftrag im Schulmanager, der gegen 08:30 Uhr eintreffen wird. | |||
* Anschließend könnt ihr '''freiwillig''' eure Daten auch in ein Tabellenkalkulationsprogramm eingeben und eine Kurve zeichnen lassen (sofern ihr das könnt). | |||
* '''Verpflichtend''': Wiederholt den kompletten Versuch (inkl. Diagramm zeichnen), ändert aber einen der folgenden Parameter: | |||
** Verwendet unterschiedliche dicke Strohhalme | |||
** Verwendet zwei Gläser mit unterschiedlichem Durchmesser | |||
* Erklärt abschließend (nicht schriftlich, aber ich werde euch am Mittwoch danach fragen): Was hat das mit der Esterbildung bzw. Esterspaltung zu tun? | |||
* Auf der folgenden Seite kann man ein Simulationsprogramm herunterladen, mit dem man diesen Versuch am Rechner nachspielen und verschiedene Parameter ändern kann. Wer Lust hat, kann das gerne ausprobieren: [https://www.lpm.uni-sb.de/typo3/index.php?id=826 Link] (Keine Haftung wegen Viren, Trojanern, Fishing-Gedöns o.ä. - Aber ich habe die Datei selbst am 25.04. heruntergeladen, bis jetzt funktioniert mein Rechner noch) | |||
<br><br> | |||
Bild zur Veranschaulichung der Messwert-Erhebung:<br> | |||
[[Datei:C10NTG_Ester2_Schöpfen_VAufbau.jpg]]<br> | |||
<br> | |||
Abschließender Hefteintrag: [[Spezial:FilePath/C10NTG_Ester_VerschChemGG_Heft.pdf|Hier klicken]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Estern und ihre Benennung'''</span> | |||
|Inhalt= | |||
Sollte noch Zeit übrig sein, übt '''gemeinsam '''das Benennen von Estern: | |||
* Findet eine/n Partner/in (eine/n Mitschüler/in aus eurer Klasse), die/der auch noch Zeit übrig hat. Ihr könnt auch eine Gruppe mit mehren Leuten bilden. | |||
* Erfindet mindestens drei Ester und zeichnet die Valenzstrichformel. | |||
* Benennt sowohl den Ester als auch die Säure und den Alkohol aus den man den Ester herstellen kann. | |||
* Schickt entweder die Valenzstrichformel an eure/n Partner/in oder den Namen des Esters. Jeweils das andere (Valenzstrichformel oder Name) muss heraus gefunden werden. | |||
* Verbessert euch gegenseitig, falls Fehler aufgetaucht sind. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Dienstag, 20.04.=== | |||
In der heutigen Einheit soll es um einen typischen Reaktionstyp gehen, an dem Carbonsäuren beteiligt sind. Ihr braucht dazu später das Schulbuch und das unten verfügbare Arbeitsblatt (das nicht zwangsläufig ausgedruckt werden muss). | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Versuchsbeschreibung'''</span> | |||
|Inhalt= | |||
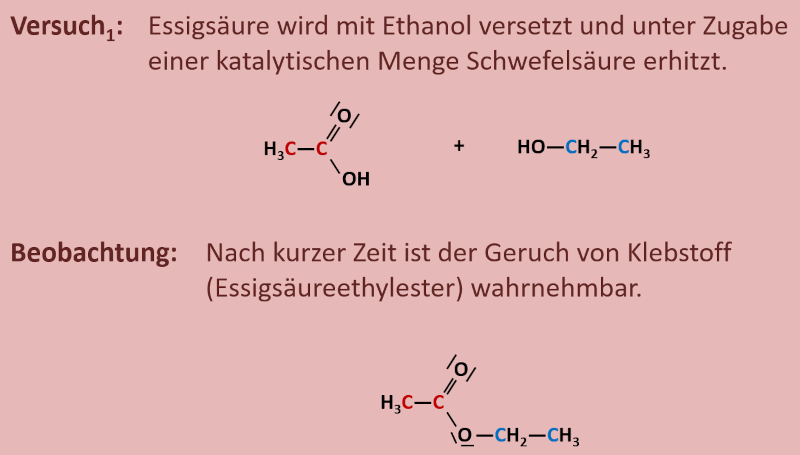
Erhitzt man in einem Rundkolben, auf dem ein Rückflusskühler sitzt (ihr könnt euch die Apparatur später im Buch auf S. 123 anschauen), Essigsäure (systematischer Name: Ethansäure) mit Ethanol, so ist nach einigen Minuten im Reaktionsgefäß deutlich der Geruch von "Klebstoff" wahrnehmbar. Dieser Geruch ist auf den entstanden Stoff "Essigsäureethylester" zurückzuführen. <br> | |||
Einige Ergänzungen: | |||
* Als Katalysator für diese Reaktion sind zusätzlich einige Tropfen Schwefelsäure erforderlich. Für die weiteren Betrachtungen sollen diese jedoch keine Rolle spielen. | |||
* Alle Schülerinnen und Schüler identifizieren den Geruch sofort als "Uhu" oder eben "Klebstoff". Die von Kindern häufig in der Schule verwendeten Klebestifte enthalten aber schon seit vielen Jahren keinen Essigsäureethylester mehr. | |||
<br><br> | |||
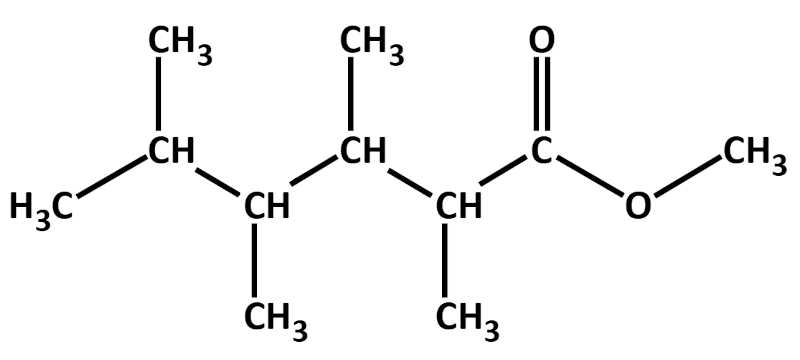
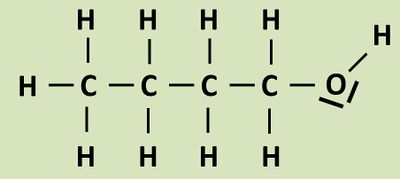
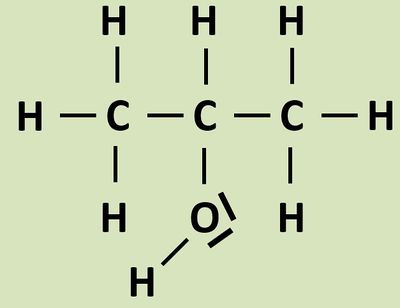
Zur eigentlichen Aufgabe: Das folgende Bild zeigt die beiden Ausgangsstoffe und das Endprodukt. Versucht möglichst genau stichpunktartig zu beschreiben, was bei dieser Reaktion passiert ist! Zur Erleichterung sind die Kohlenstoffatome der Säure rot und die C-Atome des Alkohols blau markiert.<br> | |||
[[Datei:C10NTG_Ester1_VBeschr.jpg]]<br> | |||
<br> | |||
{{Lösung versteckt| | |||
Die beiden Moleküle werden unter Wasserabspaltung miteinander verknüpft. <br> | |||
<br> | |||
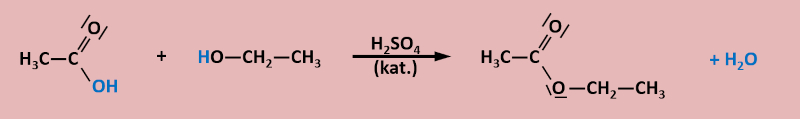
Stellt jetzt die chemische Gesamtgleichung für die Reaktion auf! | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_Ester1_chemGl.jpg]]<br> | |||
<br> | |||
Hinweis: Theoretisch könnte das Sauerstoff-Atoms im Wasser auch von der Hydroxygruppe des Alkohols stammen. Mit geschickten Versuchen kann man jedoch zeigen, dass dem nicht so ist. | |||
|Gleichung anzeigen|Lösung ausblenden}} | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
<br> | |||
<br> | |||
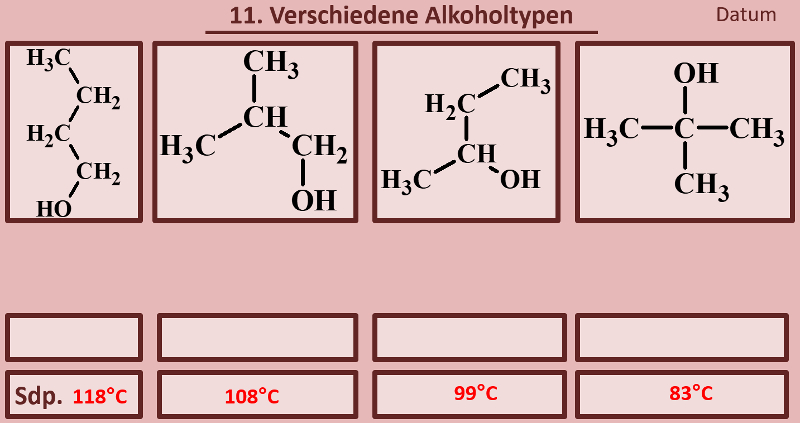
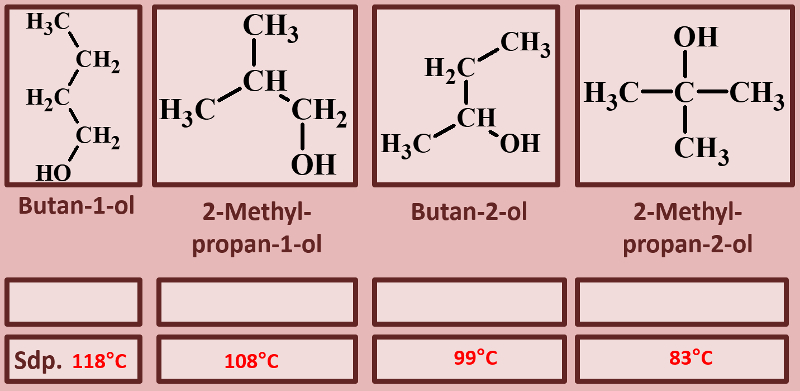
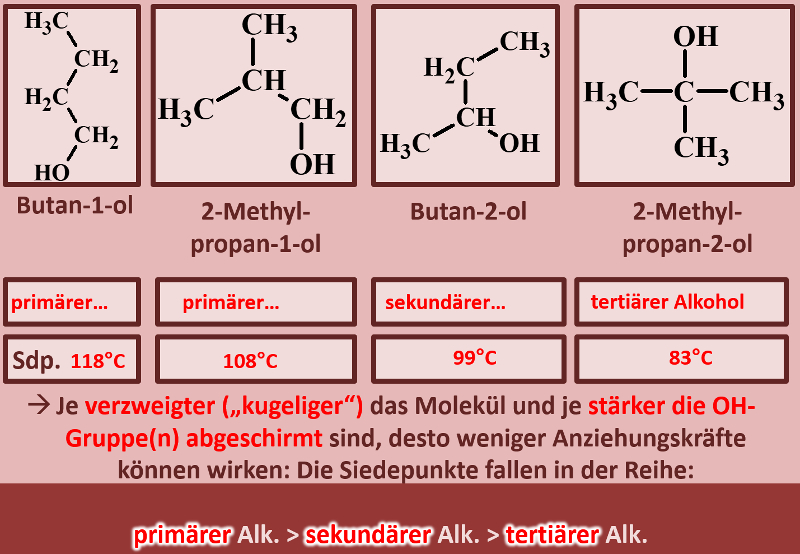
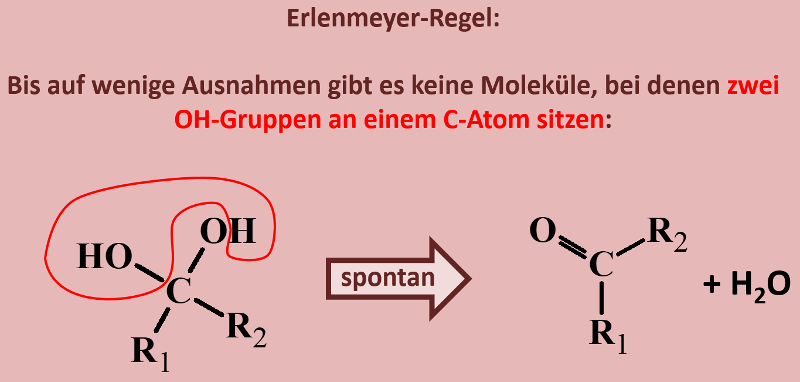
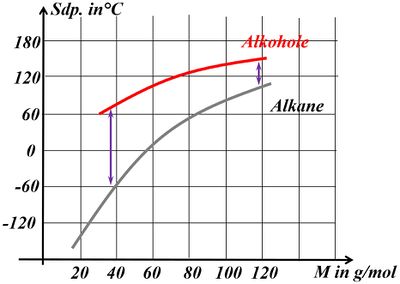
Betrachte die an dieser Reaktion beteiligten Stoffe nun aus physikalischer Sicht: Der Siedepunkt der Essigsäure (Ethansäure) liegt bei 118°C, der von Ethanol bei 78°C. Begründe, welchen ungefähren Siedepunkt beim Essigsäureethylester erwartest! | |||
{{Lösung versteckt| | |||
Folgende Gedanken sollten in Deine Überlegung eingeflossen sein: | |||
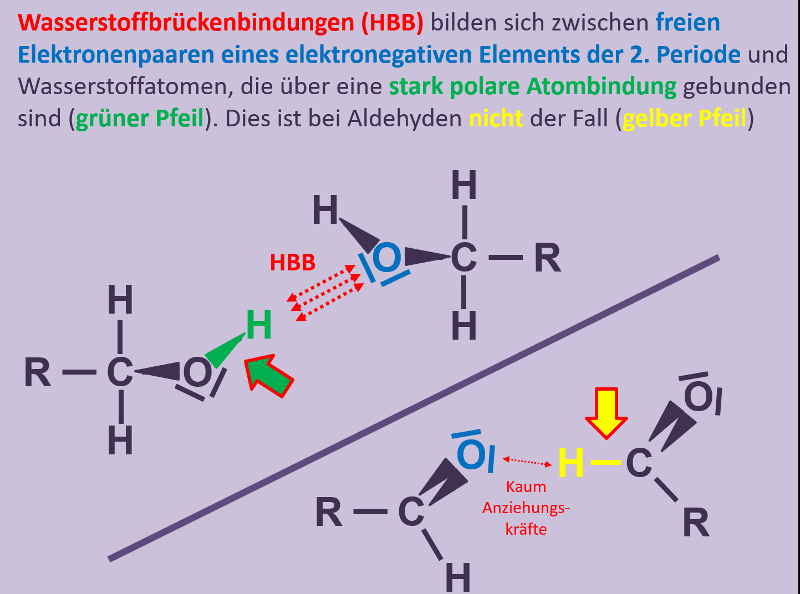
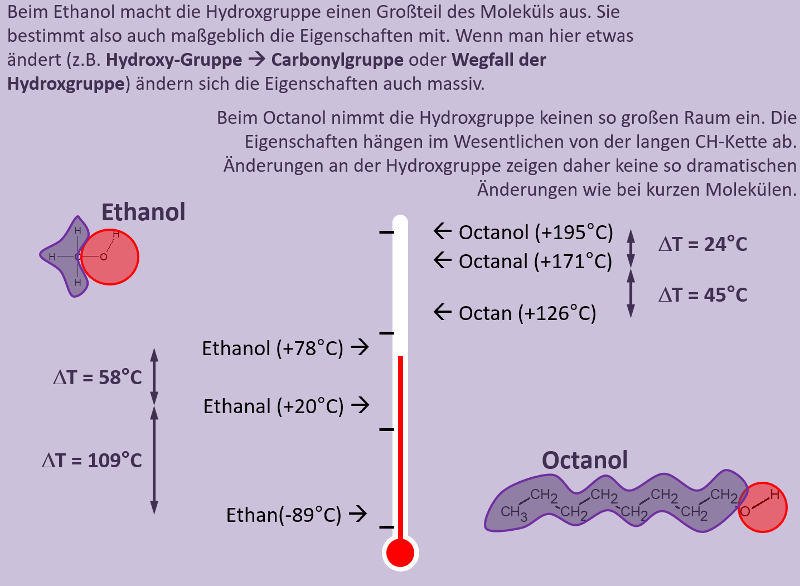
* Sowohl die Säure als auch der Alkohol haben (gemessen an ihrer Größe, bzw. ihrem molaren Gewicht) hohe Siedepunkte, da bei ihnen starke zwischenmolekulare Kräfte wirken. Dazu zählen Wechselwirkungen zwischen permanenten Dipolen, aber vor allem die Fähigkeit Wasserstoffbrücken ausbilden zu können. | |||
* Im Ester können keine Wasserstoffbrücken mehr ausgebildet werden. Es fehlen H-Atome, die an ein stark elektronegatives Element (z.B. Sauerstoff) gebunden sind. Damit sollten die Siedepunkte deutlich niedriger liegen als vergleichbar schwere Moleküle, die H-Brücken ausbilden können. | |||
* Der Ester ist größer und schwerer als die Säure und der Alkohol. Das wird den Siedepunkt etwas erhöhen. Denn je größer ein Moleküle, desto leichter lassen sich Dipole induzieren und die van-der-Waals-Kräfte nehmen zu. | |||
<br> | |||
<br> | |||
Letztlich liegt der Siedepunkt von Essigsäureethylester bei 77°C. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
<br> | |||
Lest nun die S. 123 im Buch. Beantwortet anschließend folgende Fragen: | |||
* Warum erhitzt man den Reaktionsansatz überhaupt (Grund im Buch nicht enthalten, das ist Grundwissen) | |||
* Selbst wenn man den Ansatz nur so leicht erwärmen würde, dass die Ausgangsstoffe noch nicht sieden, braucht man trotzdem einen Rückflusskühler. Warum? | |||
* Was bedeutet bei chemischen Reaktionen der Begriff "Kondensation"? | |||
{{Lösung versteckt| | |||
* Je höher die Temperatur, desto schneller laufen chemische Reaktion ab | |||
* Der Siedepunkt des Produkts liegt niedriger als die Siedepunkte der Edukte. Ohne Rückflusskühler würde das Produkt das Reaktionsgefäß verlassen und wäre verloren. In der Regel führt man eine chemische Reaktion ja aber durch, weil man das Produkt haben möchte. | |||
* Bei einer Kondensation werden zwei Moleküle unter Abspaltung einer kleinen Gruppe (hier: Wasser) miteinander verknüpft. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Benennung von Estern'''</span> | |||
|Inhalt= | |||
Es gibt verschiedene Möglichkeiten Ester zu benennen. <br> | |||
<br> | |||
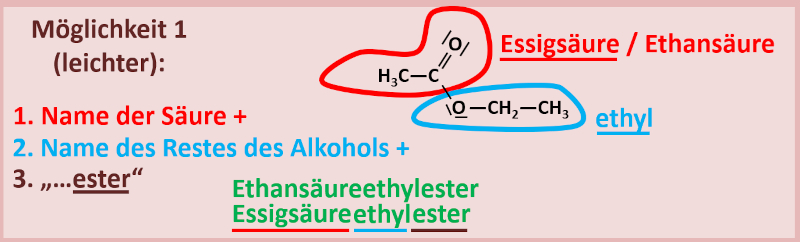
'''1. Variante'''<br> | |||
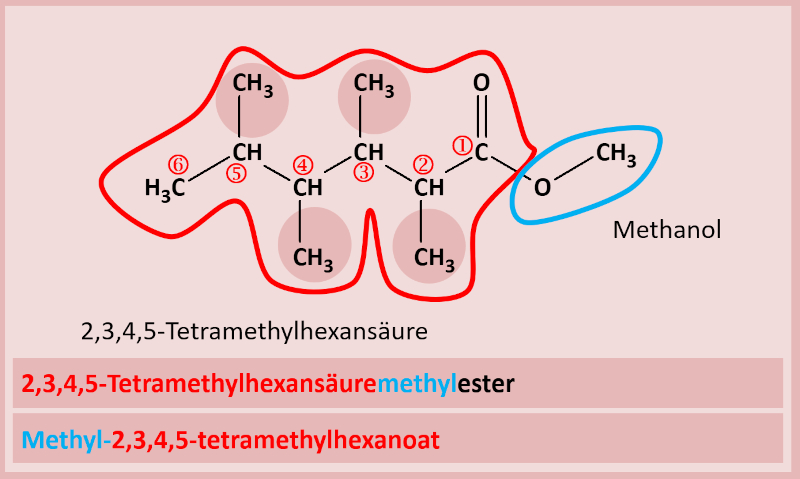
Man nennt zuerst den '''Namen der Säure''' (entweder den Trivialnamen oder den systematischen Namen), hängt dann den '''Namen des Alkyl-Restes vom Alkohol''' an (man tut also so, als wäre der Alkohol eine Seitengruppe eines größeren Moleküls) und lässt den Namen '''auf -ester enden'''. Bsp.:<br> | |||
[[Datei:C10NTG_Ester1_Benenn_Vorschrift_V1.jpg]]<br> | |||
<br> | |||
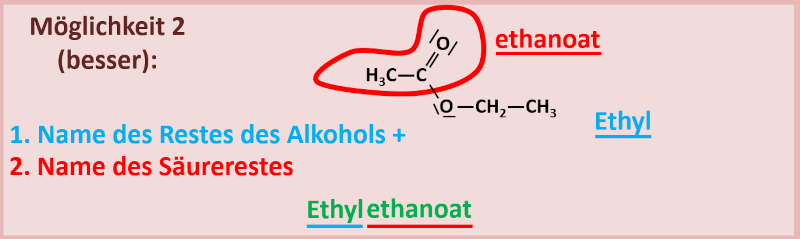
'''2. Variante'''<br> | |||
Man nennt zuerst den '''Alkohol-Rest''' und dann den Namen des '''Säure-Restes'''. Bei einem Säure-Rest wird die sonst übliche Endung ''...-säure'' ersetzt durch ''...-oat''. Also z.B. Ethansäure wird zu Ethanoat. Das funktioniert allerdings nur mit den systematischen Namen. Mit Trivialnamen geht das nicht, der Rest der Ameisensäure heißt also nicht Ameisenoat. Die Ameisensäure heißt systematisch Methansäure, ihr Rest würde Methanoat heißen. Tatsächlich würde es aber auch für die Säurereste Trivialnamen geben. Bei der Ameisensäure wäre das z.B. "Formiat"...<br> | |||
Haltet euch am besten an die systematischen Namen. Die sind eindeutig! Bsp.:<br> | |||
[[Datei:C10NTG_Ester1_Benenn_Vorschrift_V2.jpg]]<br> | |||
<br> | |||
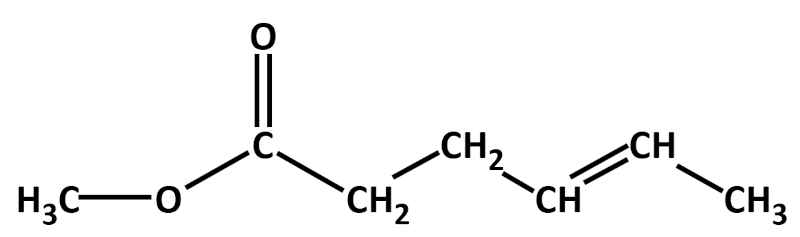
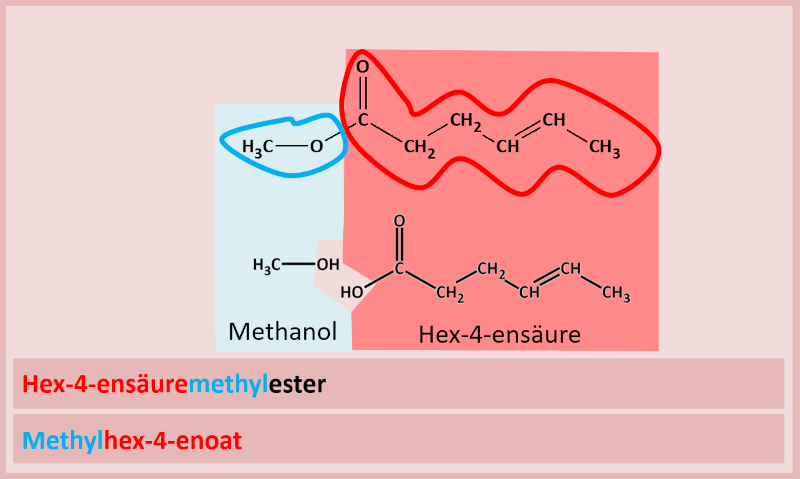
Hier zwei weitere Beispiele mit Lösung: | |||
<br> | |||
[[Datei:C10NTG_Ester1_Benenn_Bsp1AA.jpg]]<br> | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_Ester1_Benenn_Bsp1ML.jpg]]<br> | |||
|Benennung|Lösung ausblenden}} | |||
<br> | |||
<br> | |||
[[Datei:C10NTG_Ester1_Benenn_Bsp2AA.jpg]]<br> | |||
{{Lösung versteckt| | |||
[[Datei:C10NTG_Ester1_Benenn_Bsp2ML.jpg]]<br> | |||
|Benennung|Lösung ausblenden}} | |||
<br> | |||
Bearbeitet nun nach diesem Muster das folgende Arbeitsblatt! | |||
* Arbeitsblatt als pdf-Datei: [[Spezial:FilePath/C10NTG_Ester_Benennung_AB.pdf|Hier klicken]] | |||
* Lösungsvorschlag als pdf-Datei: [[Spezial:FilePath/27_BenennungEster_Ü_ML.pdf|Hier klicken]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Bedeutung von Estern'''</span> | |||
|Inhalt= | |||
Lest abschließend die Seite 127. Dort geht es um das Vorkommen, bzw. die Bedeutung von Estern. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Freiwillig'''</span> | |||
|Inhalt= | |||
Wer schnell gearbeitet hat und noch Zeit übrig ist, kann den '''Mechanismus '''der Esterbildung auf S. 126 genauer unter die Lupe nehmen. | |||
* Formuliert den Mechanismus für die säurekatalysierte Bildung von Essigsäurepropylester! | |||
|Farbe= #060 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFD | |||
|Hintergrund= #DFD | |||
}} | |||
=== Distanzunterricht Dienstag, 13.04.=== | |||
Hallo 10d!<br> | |||
<br> | |||
Also wieder Distanzunterricht... Na ja,... Was will man machen.<br> | |||
Um euch wieder auf Betriebstemperatur zu bringen: Vor den Ferien haben wir zum einen über das '''Erstellen guter PowerPoint-Präsentationen''' gesprochen. Behaltet das im Hinterkopf! Ihr werdet alle in diesem Schuljahr noch ein Referat halten. Zur Not auch von zu Hause aus per Videokonferenz.<br> | |||
Zum anderen haben wir begonnen über '''Carbonsäuren''' zu sprechen. Dazu habt ihr ein Übungsblatt bekommen. Auf der einen Seite war eine Wiederholungseinheit zu anorganischen Säuren aus der 9. Jahrgangsstufe. Diese Seite haben wir im Unterricht bereits verbessert. Die zweite Seite enthielt weitere Arbeitsaufträge, die wir noch nicht besprochen haben. Hier zunächst noch einmal das Arbeitsblatt, falls es euch nicht mehr zur Verfügung steht, die Vorderseite enthält schon eine Musterlösung: | |||
* [[Spezial:FilePath/C10NTG_HS_KW11_ML.pdf|pdf-Datei]] | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag für die erste Stunde (08:00 - 08:45 Uhr)'''</span> | |||
|Inhalt= | |||
Bearbeitet die zweite Seite des Arbeitsblattes erneut! Wenn ihr das vor den Ferien tatsächlich bereits erledigt habt, dann versucht diesmal ohne erneutes Lesen der Buchseiten sofort die Aufgaben zu lösen. | |||
* Buch, S. 114 - 115 lesen | |||
* Aufgabe 2 auf S. 114 lösen | |||
* Buch, S. 118 - 119 lesen | |||
* Interpretiere Abb. 1 auf S. 119 | |||
* Interpretiere Abb. 3 auf S. 119 | |||
* Bearbeite Aufgabe 1 auf S. 119 | |||
<br> | |||
Wir besprechen die Aufgaben am Mittwoch in der 2. Std in einer Videokonferenz | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag für die zweite Stunde (08:45 - 09:30 Uhr)'''</span> | |||
|Inhalt= | |||
1. Sofern ihr es noch nicht getan habt, widmet euch der "freiwilligen Aufgabe" auf dem Arbeitsblatt: <br> | |||
'''Woher hat Pimelinketon seinen Namen? ''' | |||
* Verwendet auf keinen Fall mehr als 15 Minuten für diese Aufgabe! Ich werde euch die Auflösung am Mittwoch sagen. | |||
<br> | |||
2. Ein PPP-Effekt: Ich habe versucht euch klar zu machen, dass man bei Referaten in der PowerPoint-Präsentation möglichst viele Aspekte '''anschaulich visualisieren''' sollte. Text sollte so weit es geht, vermieden werden. In den letzten Jahren bin ich mit den zehnten Klassen immer eine Stunde pro Woche in den Computerraum gegangen, um dort das Erstellen anschaulicher Präsentationen zu üben. Im folgenden Video (3:55min) ist ein Problem beschrieben, auf das ein Schüler in diesen Stunden gestoßen ist und lange keine Lösung gefunden hat. Vielleicht bekommt ihr es ja hin? | |||
* Auch hier: Verwendet auf keinen Fall mehr als 15 Minuten für diese Aufgabe! Ich werde euch eine Lösung am Mittwoch zeigen. | |||
{{#ev:youtube|XnY8XQM14Cg}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
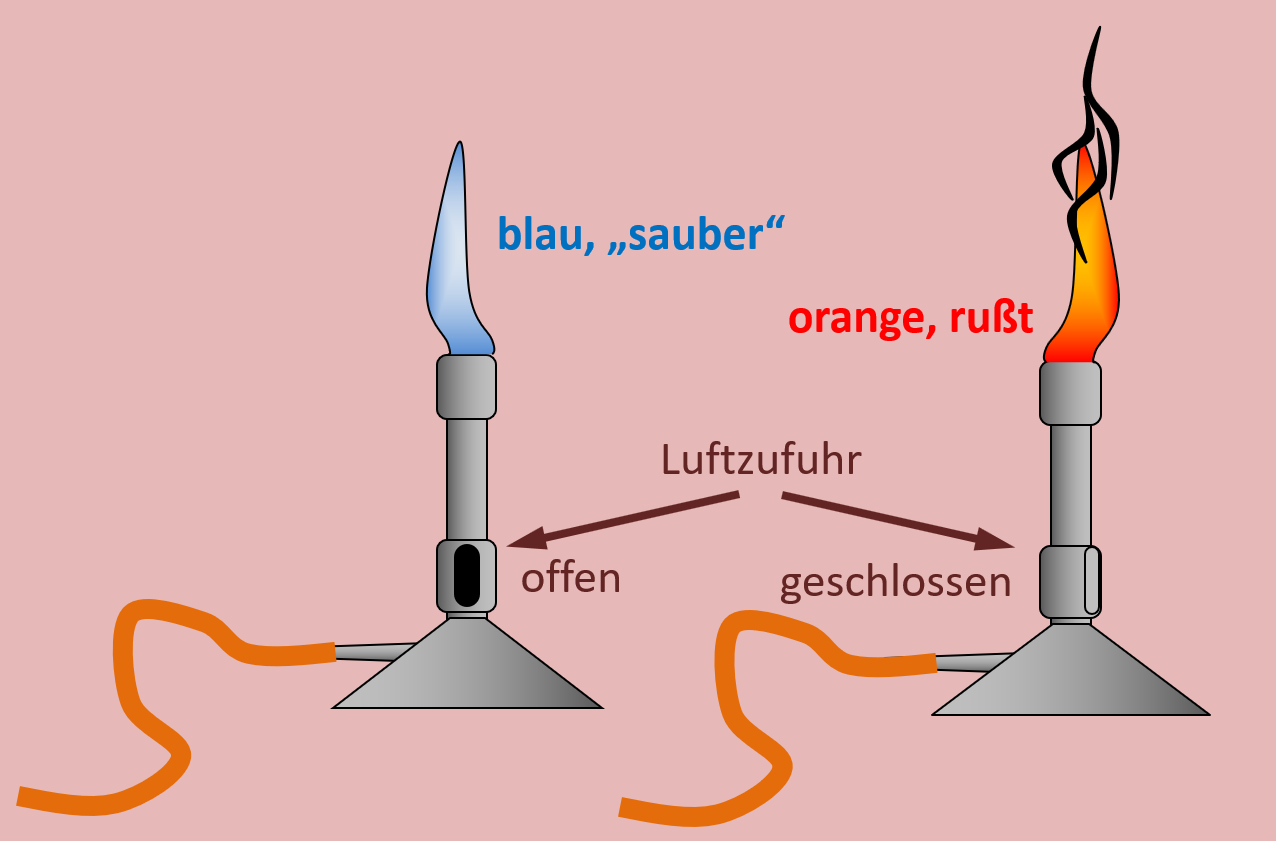
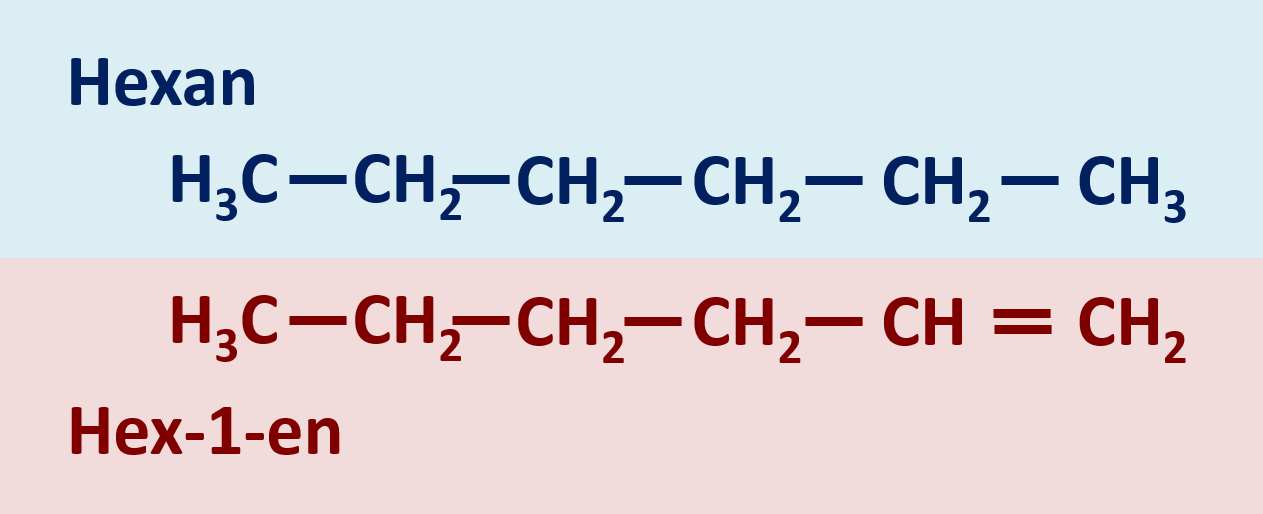
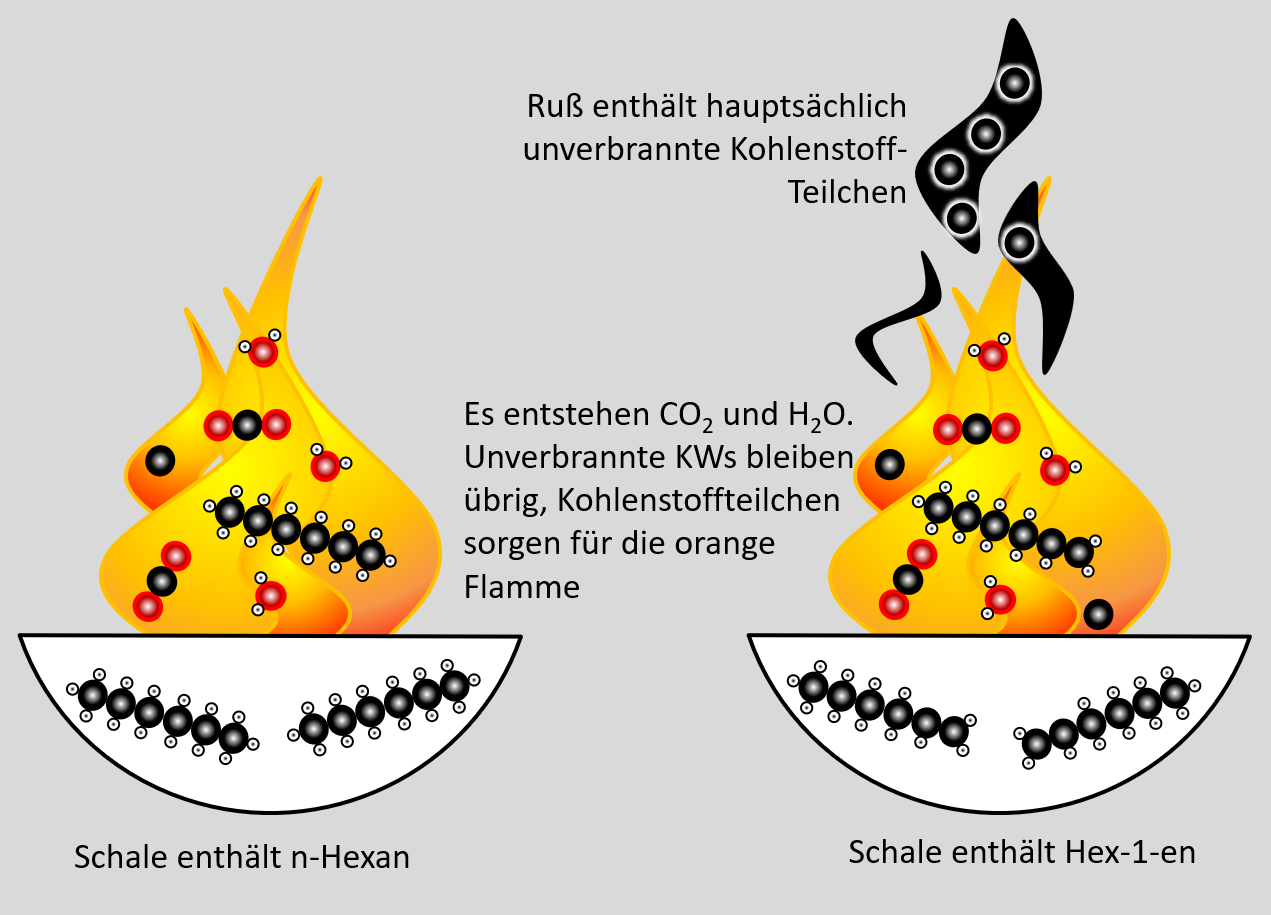
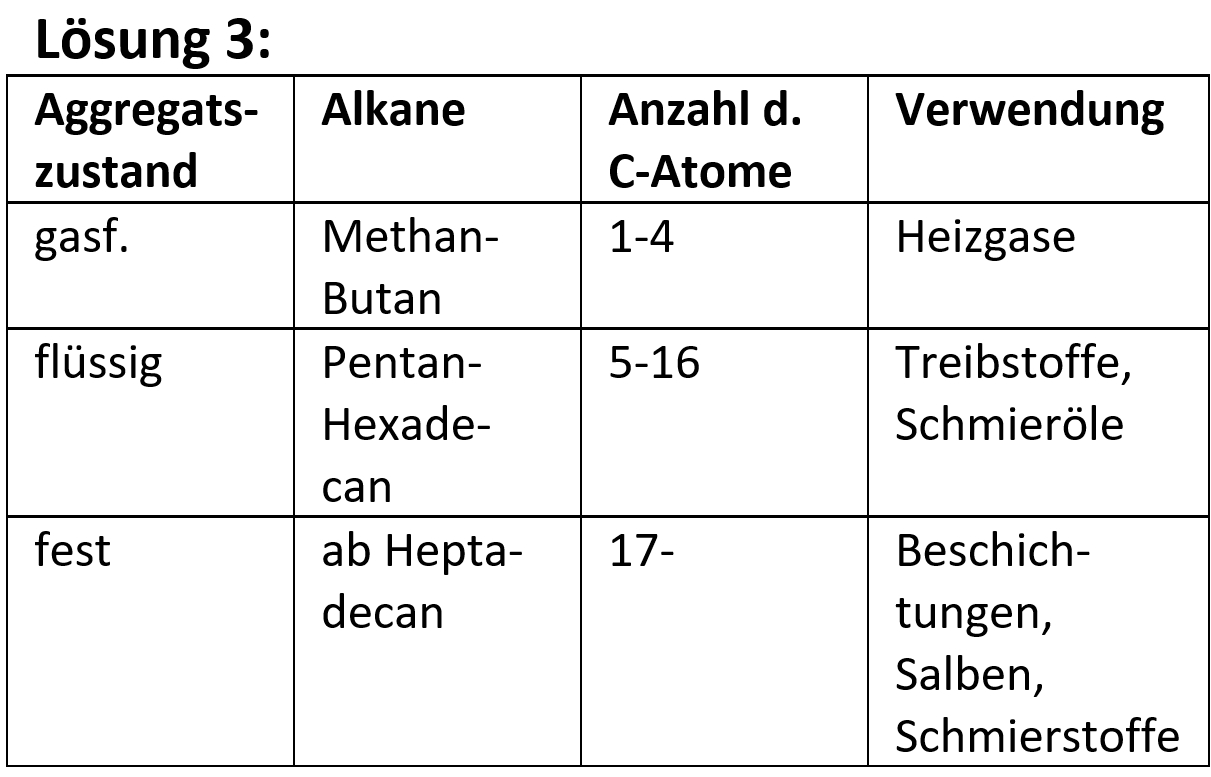
=== Distanzunterricht Dienstag, 09.03. === | === Distanzunterricht Dienstag, 09.03. === | ||
Aktuelle Version vom 1. Juni 2021, 06:34 Uhr
Lernen zu Hause
Distanzunterricht Dienstag, 18.05.
Heute mal was kreatives! Aber schon auch eine fachliche Vorbereitung auf das letzte Kapitel in diesem Schuljahr: Biomoleküle.
In diesem letzten Kapitel sollt ihr vieles, was ihr über organische Verbindungen bisher gelernt habt auf Moleküle übertragen, die für Lebewesen eine wichtige Rolle spielen. Tatsächlich solltet ihr in Biologie über diese Moleküle bereits gesprochen haben. Und genau aus diesem Grund bekommt ihr jetzt auch diese Aufgabe gestellt: Verarbeitet euer bereits vorhandenes Wissen über die Kohlenhydrate, Fette und Eiweiße zu einem ästhetisch anspruchsvollen, wissenschaftlichen Poster!
Wissenschaftliche Poster sind zu einem beliebten Mittel geworden, um kleinere (aber auch größere) Forschungsarbeiten übersichtlich und anschaulich zu präsentieren. Wenn ihr euch genauer über "wissenschaftliche Poster" informieren wollt, dann könnt ihr z.B. folgenden Links folgen:
- Die Studienwerkstatt der Uni-Bremen hat ein pdf-Dokument mit etlichen Tipps zusammengestellt: Hier klicken
- In dem pdf-Dokument sind auch zwei Seiten verlinkt, auf denen man bereits fertige wissenschaftliche Plakate anschauen kann: Zum Beispiel hier oder hier
- So ein richtig wahnsinnig schönes yt-Video habe ich auf die Schnelle leider nicht gefunden. Ihr könnt natürlich "wissenschaftliches Poster" bei Google oder Youtube eingeben und ihr werdet tausende von Treffern erhalten, aber die ersten fünf, die ich mir angeschaut habe, hatten alle irgendwelche Haken.
Ein paar einfache Tipps:
- Verwendet ein Präsentationsprogramm, um ein Poster zu erstellen. Hier lassen sich Texte, Bilder, Grafiken etc. am einfachsten anordnen und formatieren.
- Hochformat ist günstiger (Entwurf --> Foliengröße --> Benutzerdefinierte Foliengröße --> "4:3" und "Hochformat" auswählen)
- Geht sparsam mit grellen Farben und/oder Kontrasten um. Bleibt am besten in einer "Farbfamilie".
- Poster werden in der Regel relativ groß ausgedruckt (DIN A2, A1 oder sogar A0), daher könnt ihr auch eine sehr kleine Schriftgröße (10pt) verwenden. Diese ist immer noch gut lesbar. ABER ACHTUNG:
- Niemand will ein Poster lesen, das Gigatonnen an Text enthält! Versucht eure fachlichen Inhalte gut zu veranschaulichen.
Inhalt:
- Als Ausgangspunkt könnt ihr eure Biologie-Schulbuch verwenden (S. 18, 19)
- Ihr könnt natürlich auch im Internet recherchieren.
- Bleibt inhaltlich aber bei dem, was ihr schon gelernt (inzwischen aber vielleicht wieder vergessen) habt.
- Zum Veranschaulichen eurer Inhalte könnt ihr selbst Fotos machen (z.B. von Nahrungsmitteln), selbst Symbole erstellen (ähnlich wie die Abbildungen auf S. 18 im Bio-Schulbuch) oder auch Grafiken aus dem Netz verwenden (z.B. Gehalt von ungesättigten Fettsäuren in verschiedenen Ölsorten)
Das folgende Plakat wurde mit PowerPoint erstellt und enthält keinerlei sinnvollen Inhalt. Es geht lediglich darum, zu zeigen, wie eine grundsätzliche Aufteilung aussehen könnte:

Verwendet nicht mehr als 90min. für diesen Arbeitsauftrag! Man kann sicher deutlich mehr Zeit investieren, um immer mehr Details zu erzeugen, aber ihr sollt auch lernen, mit der Ressource Zeit effektiv umzugehen. Ich empfehle daher zunächst das Plakat in Grundzügen zu entwerfen und je nach zur Verfügung stehender Zeit nach und nach Aspekte zu vertiefen, zu verfeinern oder optisch aufzuhübschen. Beim "linearen Arbeiten" (das heißt: Ich fange oben auf dem Plakat an und mache alles sofort super genau und super schön) kann es leicht passieren, dass die zur Verfügung stehende Zeit aufgebraucht ist und das Plakat aber noch lange nicht fertig wird. Das sollte nicht passieren.
Speichert die Präsentation als pdf-Datei ab und schickt sie mir als Antwort auf den Arbeitsauftrag im Schulmanager. Wir hören uns morgen (Mittwoch, 19.05.) in einer Videokonferenz.
Distanzunterricht Dienstag, 11.05.
Da ich heute (Di, 11.05.) und morgen (Mi, 12.05.) aufgrund des Abiturs stark in organisatorische Aufgaben an der Schule eingebunden bin, müsst ihr an diesen beiden Tagen leider alleine klar kommen. Vergesst aber auf keinen Fall am Dienstag bis spätestens 08:15 Uhr eure Rückmeldung auf den "Start-in-den-Tag"-Auftrag im Schulmanager!
Ihr erhaltet hier drei Arbeitsaufträge für die drei Chemie-Unterrichtsstunden. Ich empfehle euch, jeden Arbeitsauftrag in der Zeit zu erledigen, die angegeben ist. Wenn ihr unbedingt eine andere Reihenfolge wählen wollt: Von mir aus. Für zwei Arbeitsaufträge erhaltet ihr auch im Schulmanager einen Auftrag, auf den ihr bitte eure entsprechend passende Lösung hochladet:
- Dienstag, 1. Std. (08:00 - 08:45 Uhr): Knobelaufgaben auf S. 132 lösen - Abgabe eines Lösungsvorschlags im Schulmanager erforderlich!
- Dienstag, 2. Std. (08:45 - 09:30 Uhr): Abschließende Rätsel zum gesamten bislang behandelten Stoff in org. Chemie
- Mittwoch, 2. Std. (09:45 - 10:30 Uhr): Versuch "CO2-Löscher" durchführen und Aufgaben dazu bearbeiten - Abgabe eines Lösungsvorschlags im Schulmanager erforderlich! Achtung: Die Aufgaben lassen sich auch lösen, wenn man den Versuch nicht durchgeführt hat (z.B. weil ihr kein Backpulver, keinen Essig oder kein Teelicht zu Hause hattet)!
Distanzunterricht Mittwoch, 05.05.
Videokonferenz: Weitere Verbesserung des Arbeitsauftrages vom Dienstag (Milchsäure, Terephthalsäure, Lactone).
Im Anschluss an den Versuch "Schöpfen" (27.04.) gab es einen Hefteintrag, der auf die Verschiebung des chemischen Gleichgewichts eingeht. Dieser Hefteintrag war noch nicht an der richtigen Stelle verfügbar. Falls ihr ihn noch nicht gesehen habt: Bitte druckt ihn aus und klebt ihn ins Heft oder schreibt ihn ab: Hier klicken
Distanzunterricht Dienstag, 04.05.
Über den Arbeitsauftrag im Schulmanager habt ihr alle 4 Arbeitstexte enthalten. Ihr müsst nur einen davon bearbeiten, die unteren Kästen zeigen euch, wer welchen Text bearbeiten soll. Zusätzlich war ein Arbeitsblatt enthalten, auf dem ihr das zu eurem Text passende Viertel nach dem Lesen des Arbeitstextes ausfüllen sollt. Falls ihr technisch dazu in der Lage seid, könnt ihr diese Aufgabe gerne zusammen erledigen, z.B. indem ihr nach dem Ausfüllen des ABs jemanden aus eurer Gruppe anruft oder auf anderem Weg kontaktiert und dann eure Lösungen vergleicht.
In der zweiten Stunde besprechen wir eure Ergebnisse in einer Videokonferenz: Ich werde aus jeder Gruppen jemanden aufrufen, der seine Ergebnisse vorstellt. Während ihr eure Ergebnisse vorstellt, wird das vollständig ausgefüllte Viertel des ABs eingeblendet sein, welches zu eurer Gruppe gehört. Diese Lösung findet ihr auch im unteren Kasten
Distanzunterricht Dienstag, 27.04.
Ihr habt in der letzten Videokonferenz gehört, dass die Esterkondensation im Gleichgewicht mit der Esterhydrolyse steht (sofern am Reaktionsraum keine Manipulationen vorgenommen werden - dazu später mehr). Das bedeutet: In einem Rundkolben, indem sich Essigsäureethylester, Essigsäure und Ethanol befinden, findet permanent die Reaktion einiger Säure- mit Alkoholmolekülen zum Ester statt, gleichzeitig reagieren aber auch einige Ester-Moleküle zurück zur Säure und dem Alkohol. Es handelt sich also um eine Gleichgewichtsreaktion. Falls ihr das noch nicht vollständig verstanden habt, lest jetzt im Buch (noch einmal) die S. 124.
- Hier gibt es den passenden Hefteintrag als pdf-Datei: Hier klicken (Bitte ausdrucken und einkleben oder ins Heft abschreiben)
- Heute sollt ihr einen Versuch zu Hause durchführen, der das dynamische Gleichgewicht einer solchen Gleichgewichtsreaktion simulieren kann
Distanzunterricht Dienstag, 20.04.
In der heutigen Einheit soll es um einen typischen Reaktionstyp gehen, an dem Carbonsäuren beteiligt sind. Ihr braucht dazu später das Schulbuch und das unten verfügbare Arbeitsblatt (das nicht zwangsläufig ausgedruckt werden muss).
Distanzunterricht Dienstag, 13.04.
Hallo 10d!
Also wieder Distanzunterricht... Na ja,... Was will man machen.
Um euch wieder auf Betriebstemperatur zu bringen: Vor den Ferien haben wir zum einen über das Erstellen guter PowerPoint-Präsentationen gesprochen. Behaltet das im Hinterkopf! Ihr werdet alle in diesem Schuljahr noch ein Referat halten. Zur Not auch von zu Hause aus per Videokonferenz.
Zum anderen haben wir begonnen über Carbonsäuren zu sprechen. Dazu habt ihr ein Übungsblatt bekommen. Auf der einen Seite war eine Wiederholungseinheit zu anorganischen Säuren aus der 9. Jahrgangsstufe. Diese Seite haben wir im Unterricht bereits verbessert. Die zweite Seite enthielt weitere Arbeitsaufträge, die wir noch nicht besprochen haben. Hier zunächst noch einmal das Arbeitsblatt, falls es euch nicht mehr zur Verfügung steht, die Vorderseite enthält schon eine Musterlösung:
Distanzunterricht Dienstag, 09.03.
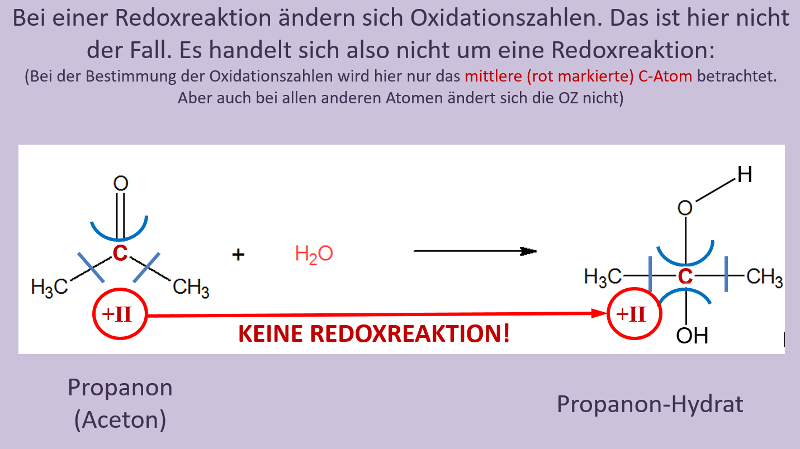
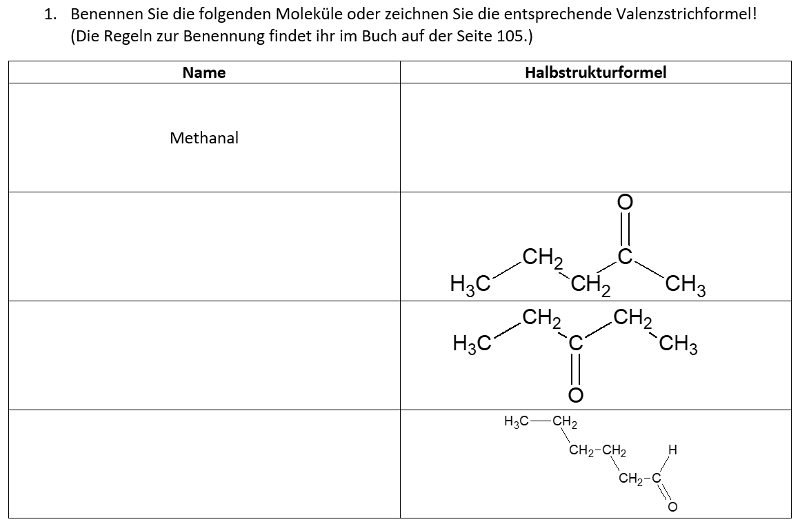
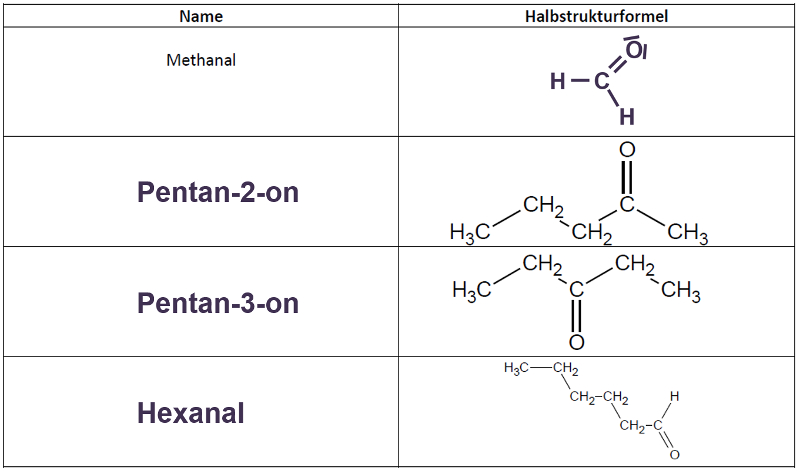
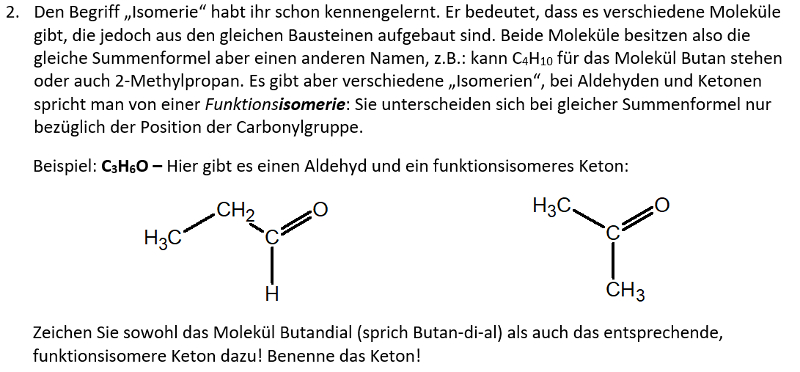
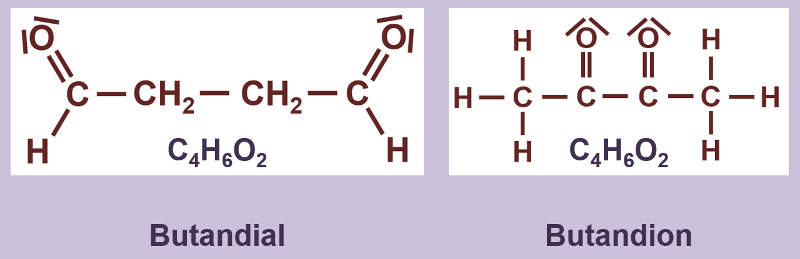
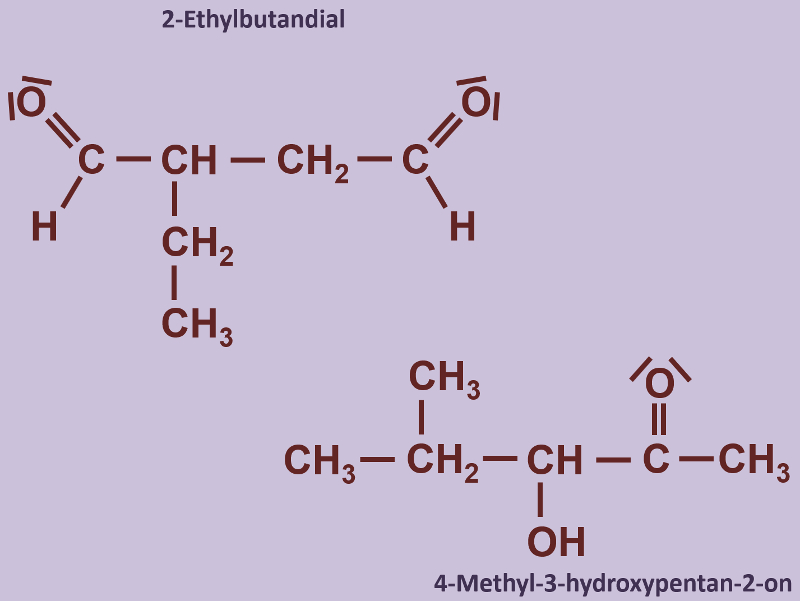
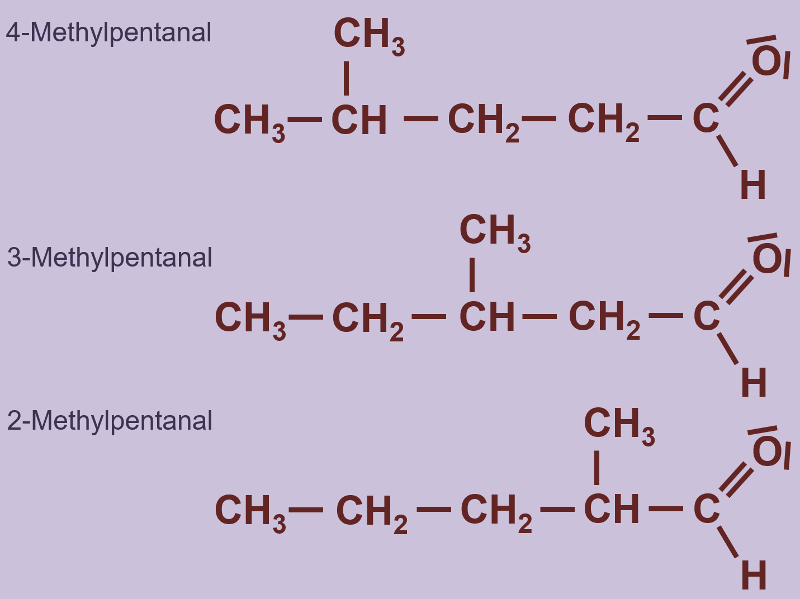
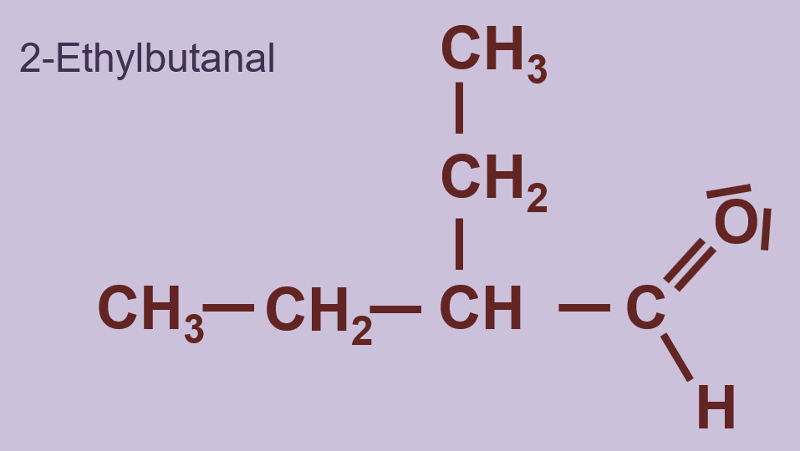
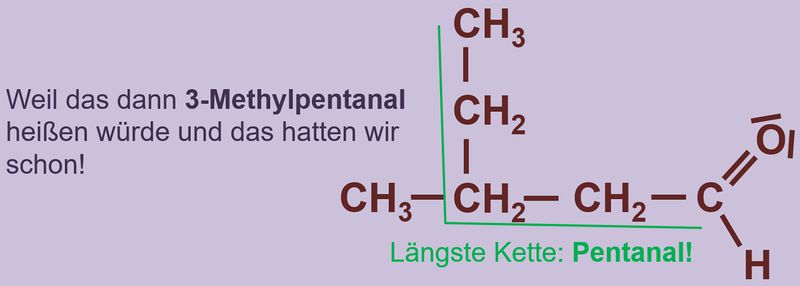
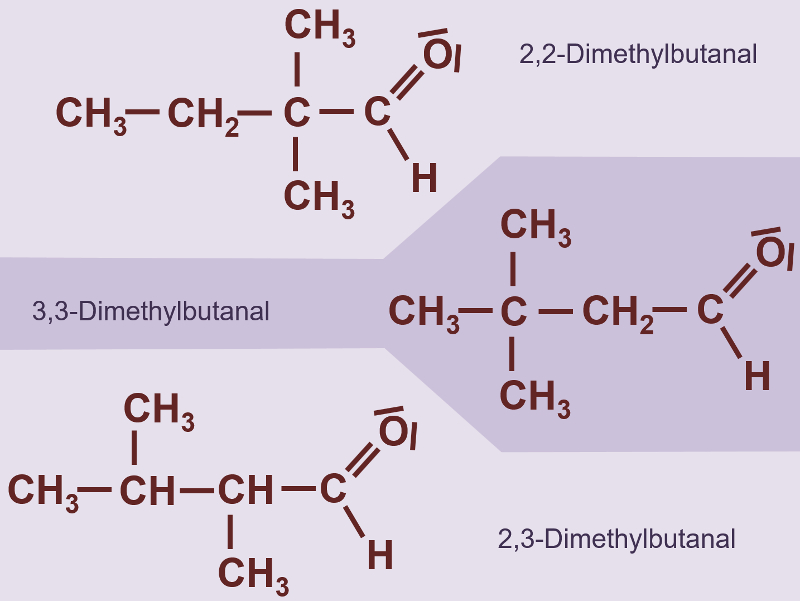
Heute ein paar Aufgaben zum Abschluss der Thematik "Aldehyde und Ketone"
Wir hören uns am Mittwoch in einer Videokonferenz
Distanzunterricht Mittwoch, 03.03.
Videokonferenz zur Besprechung der letzten Online-Einheit: Bildung von Acetalen und Ketalen.
Hier die entsprechenden Folien zu den in der Konferenz besprochenen Aufgaben: pdf-Datei
Distanzunterricht Dienstag, 02.03.
- Das folgende Video dauert 33min.
- Nach 21:00min sollt ihr das Video anhalten, im Buch etwas lesen und danach eine Aufgabe lösen. Wenn ihr das erledigt habt, könnt ihr solange Pause machen, bis die 45 Minuten der ersten Chemie-Stunde um wären.
- Schaut dann den Rest des Videos. Zum Schluss werden weitere Aufgaben gestellt. Bitte bearbeitet diese Aufgaben und haltet sie für die nächste Videokonferenz am Mittwoch bereit!
- Auch wenn das Video lang ist, solltet ihr alle Aufgaben in den 90 Minuten, die uns im Unterricht zur Verfügung stehen würden, locker erledigen können.
- Es sollten dann immer noch ein paar Minuten Zeit sein, das Wetter zu genießen oder ein paar Dehn-Übungen o.ä. durchzuführen!
Distanzunterricht Dienstag, 23.02.
- In der ersten Stunde sollt ihr einige Aufgaben zu Aldehyden und Ketonen lösen. Ladet dazu zunächst den Hefteintrag von letzter Stunde herunter, sofern ihr das noch nicht getan habt: pdf-Datei. Druckt ihn aus und klebt ihn ins Heft oder schreibt ihn ab.
- Lest den Hefteintrag durch. Solltet ihr Verständnisschwierigkeiten haben, empfehle ich die S. 102 - 104 im Buch bevor ihr weiter macht!
- In der zweiten Stunde sollt ihr anhand eines Videos chemische Reaktionen kennenlernen, mit denen man Aldehyde und Keton voneinander auf Stoffebene unterscheiden kann!
- Zunächst aber die Aufgaben:
Distanzunterricht Mittwoch, 17.02.
Der Hefteintrag zum Thema von letzter Stunde (Carbonylverbindungen)ist jetzt verfügbar: pdf-Datei
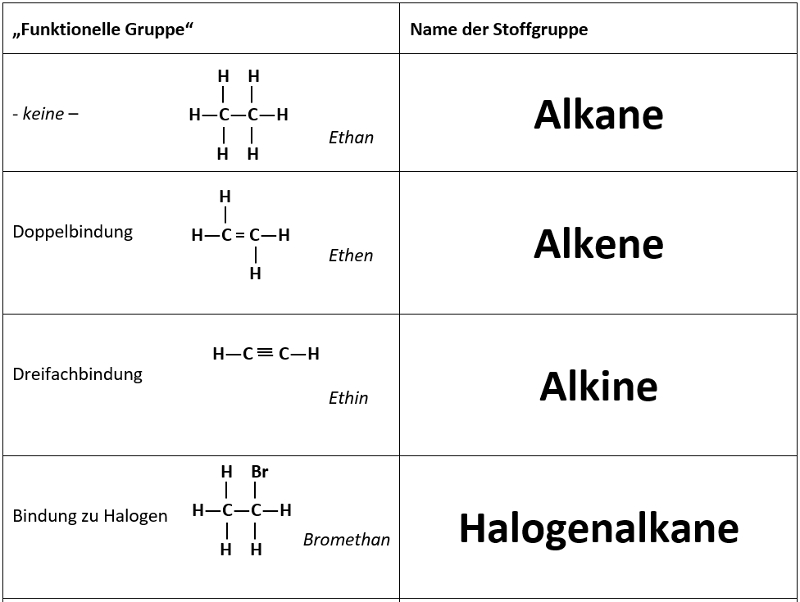
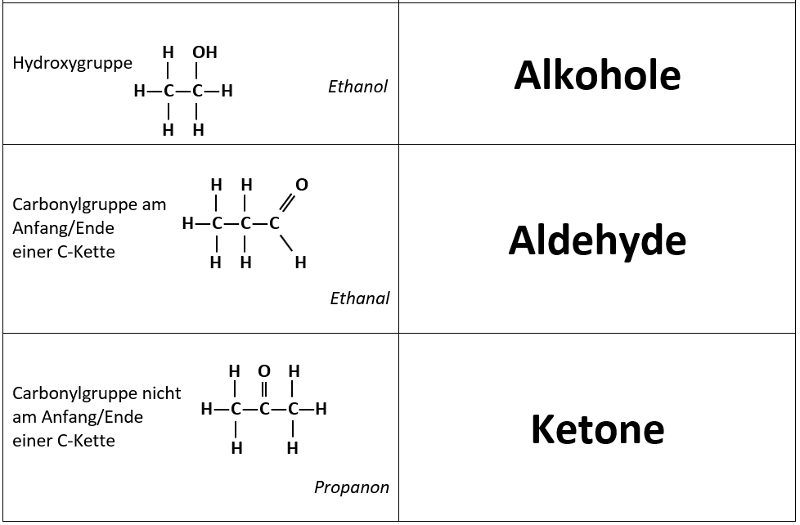
Heute mal eine etwas andere Aufgabe. Ihr habt in den letzten Unterrichtseinheiten die Carbonyl-Verbindungen kennengelernt, also organische Stoffe, die eine Doppelbindung zu einem Sauerstoff-Atom enthalten. Man unterscheidet Aldehyde, bei denen diese Carbonyl-Gruppe am Ende einer Kohlenstoffkette hängt und Ketone, bei denen die Carbonyl-Gruppe nicht am Ende einer Kohlenstoffkette hängt. Als Reinstoffe sind viele Aldehyde und Ketone reizend oder sogar sehr giftig, in kleinen Mengen kommen sie aber z.B. in Lebensmitteln vor und verleihen ihnen einen typischen Geschmack oder Geruch.
Eure Aufgabe für heute:
- Sucht bei euch zu Hause Lebensmittel oder andere Stoffe, die Carbonylverbindungen enthalten.
- Stellt mindestens fünf schön nebeneinander auf den Tisch.
- Macht kleine Schildchen, auf denen der Name der Carbonylverbindung steht, die in dem Stoff enthalten ist.
- Fotografiert das! Schickt mir das Foto als Antwort auf den Arbeitsauftrag im Schulmanager (kommt am Anfang der Unterrichtsstunde).
- Hinweise: Bevor ihr das Foto macht, stellt an der Kamera die Qualität/Auflösung niedriger ein. Oft schickt ihr Fotos, deren Dateigröße gigantisch ist. In einer so hohen Auflösung wird das Bild aber nie gebraucht!
- Noch mehr Hinweise: Wenn ihr Lebensmittel anschneidet oder Verpackungen öffnet, stellt sicher, dass sie anschließend auch verzehrt werden!
Ein Beispiel, wie eine solche Kollage aussehen könnte, findet ihr im Arbeitsauftrag, der über den Schulmanager kommt
Eine kleine Hilfestellung mit Beispielen von Carbonylverbindungen in Lebensmitteln. Ihr könnt auch auf der Zutaten- oder Inhaltsstoff-Liste von z.B. Lebensmitteln oder Kosmetikprodukten nach Carbonyl-Verbindungen suchen. Die Strukturformeln für die hier genannten Verbindungen findet ihr z.B. in eurem Buch auf S. 109 oder ihr klickt auf den Link, der zu einer Wikipedia-Seite führt (ihr braucht den ganzen Wikipedia-Artikel natürlich nicht zu lesen, aber der Abschnitt "Vorkommen" ist oft interessant):
- Vanillin (z.B. enthalten in: Vanille und damit natürlich in allen Produkten, die Vanille o. Vanillezucker enthalten), https://de.wikipedia.org/wiki/Vanillin Wikipedia-Link]
- Benzaldehyd (z.B. enthalten in: Bittermandelöl und damit natürlich in allen Produkten, die Bittermandelöl enthalten), Wikipedia-Link
- Zimtaldehyd (z.B. enthalten in: Zimtrinde und damit natürlich in allen Produkten, die Zimt enthalten), Wikipedia-Link
- Himbeerketon (z.B. enthalten in: Ratet doch mal! - Richtig: In Himbeeren!), Wikipedia-Link
- Muscon (z.B. enthalten in: Moschus - ein Sekret von Tieren, heutzutage aber eher künstlich hergestellt. Viele Kosmetikprodukte wie Seifen und Parfums enthalten Moschus), Wikipedia-Link
- Campher (wird aus einem Baum gewonnen und extrem vielseitig verwendet. Häufig ist es in Medizinprodukten gegen Erkältungsbeschwerden zu finden), Wikipedia-Link
Distanzunterricht Dienstag, 16.02.
Videokonferenz zur Klärung offener Fragen in den Bereichen
- Oxidation von Alkoholen
- Carbonylverbindungen
- Hefteintrag zum Thema: pdf-Datei
Distanzunterricht Mittwoch, 10.02.
Für diese Einheit benötigt ihr euer Schulbuch, Stift und Zettel. Dauer: 30 - 45min.
Heute sollt ihr eine neue Stoffklasse kennenlernen. So richtig "neu" ist sie nicht. Ihr habt den Namen der charakteristischen Molekülgruppe schon bei der Oxidation von Alkoholen kennengelernt: Sowohl bei der Oxidation von sekundären Alkoholen als auch bei der von primären Alkoholen entsteht im ersten Schritt ein Molekül, in dem eine Doppelbindung zwischen einem C- und einem O-Atom vorkommt. Diese Gruppe heißt "Carbonyl-Gruppe".
Wie ihr bei den Alkoholen gesehen habt, spielt der Ort im Molekül, an dem eine Hydroxy-Gruppe gebunden ist, teilweise eine Rolle für das Reaktionsverhalten (prim. und sek. Alkohole lassen sich oxidieren, tert. Alkohole nicht). Bei Molekülen mit einer Carbonylgruppe gibt es ebenfalls deutliche Unterschiede im Reaktionsverhalten, je nachdem, ob die Carbonylgruppe am Ende der C-Kette oder irgendwo in der Mitte sitzt. Daher unterscheidet man bei "Carbonyl-Verbindungen" die Aldehyde (Carbonylgruppe sitzt am Ende einer C-Kette) und die Ketone (Carbonylgruppe sitzt nicht am Ende einer C-Kette).
Distanzunterricht Dienstag, 09.02.
Ihr bekommt um 07:50 Uhr einen Arbeitsauftrag über den Schulmanager. Antwortet bis spätestens 08:15 Uhr auf diesen Auftrag! Der Arbeitsauftrag enthält auch die Anweisung zum Schreiben eines Übungs-Tests. Führt diese Anweisungen exakt aus. Danach geht es so weiter:
- Ihr dürft euch nun gegenseitig korrigieren: Wer Lust hat, sucht sich eine Korrekturpartnerin bzw. einen Korrekturpartner. Ihr könnt auch z.B. zu dritt zusammenarbeiten (s. Bild). Wenn ihr niemanden findet oder ihr das nicht möchtet, könnt ihr eure Arbeit auch selbst korrigieren. Ihr erhaltet dazu um 08:45 Uhr einen weiteren Arbeitsauftrag über den Schulmanager, der die Lösung enthält.
- Schickt eurer Korrekturpartnerin bzw. eurem Korrekturpartner das Foto eurer Lösung. Dieses Foto muss nicht unbedingt ausgedruckt werden, ihr dürft aber natürlich, wenn ihr wollt. Die Korrektur funktioniert auch, wenn ihr das Foto z.B. in Powerpoint einfügt und dann mit der Maus etwas hineinmalt, Sachen durchstreicht oder mit Textfeldern Bemerkungen einfügt. In der Farbe ROT bitte! Es muss klar erkennbar sein, welche BE erreicht wurden, welche fehlen. Schickt eurer Korrekturpartnerin bzw. eurem Korrekturpartner die korrigierte Arbeit zurück.
- Wenn ihr eure korrigierte Arbeit wieder erhalten habt, dürft ihr mit GRÜNER Farbe die Korrektur korrigieren, also z.B. wenn ihr mit einem BE-Abzug nicht einverstanden seid. Dieser Schritt entfällt natürlich, wenn ihr euch selbst korrigiert
- Von eurer (doppelt) korrigierten Arbeit schickt ihr ein Foto als Antwort auf den Arbeitsauftrag, mit dem die Musterlösung kam bis 09:30 Uhr.
- Achtung: Das Korrigieren der ersten Aufgabe ist schwierig! Bsp.: Wenn jemand die geflossenen Elektronen falsch bestimmt hat, dann sind natürlich alle weiteren Schritte auch falsch! – Trotzdem würde ich nur eine BE abziehen, dafür, dass die Elektronen falsch sind. Man muss dann alle weiteren Schritte noch einmal nachprüfen, ob diese als Folgefehler zählen.
Zeitmanagement: Bis ihr alles gelesen habt, die Morgenrückmeldung gegeben habt und bereit seid, vergehen wahrscheinlich 10min. Für den Test braucht ihr ca. 20 Minuten. Bis ihr eure Korrekturpartnerinnen bzw. -partner gefunden habt und eure Lösungen hin- und hergeschickt habt, noch mal 10min. Das heißt, die erste Stunde ist rum.
Um 08:45 Uhr kommt die Musterlösung. Die Korrektur kann etwas dauern, bei vielen Fehler durchaus auch 20 Minuten. Zurückschicken, selbst noch einmal korrigieren, mir schicken, dauert noch mal 10min. Offiziell bleiben also noch 15 Minuten der Stunde übrig: Ich empfehle für diese Zeit Dehnübungen oder die Teilnahme am Rhythmus-Projekt der Sportfachschaft: Oben rechts auf der WIKI-Startseite: Hier klicken
Distanzunterricht Mittwoch, 03.02.
Zunächst der Hefteintrag von der letzten Einheit. Schreibt diesen entweder ab oder druckt ihn aus und klebt ihn in euer Heft: pdf-Datei
In der folgenden Einheit geht es um die Frage, ob man generell alle Alkohole oxidieren kann. Schaut zunächst das Video (ca. 19min.) und bearbeitet dann die Aufgaben!
Distanzunterricht Dienstag, 02.02.
Antwortet bis spätestens 08:15 Uhr auf den Auftrag im Schulmanager! Anschließend bearbeitet die Aufgaben, die euch mit dem Hefteintrag letzte Stunde geschickt wurden. Falls ihr das Dokument nicht mehr findet: Hier die pdf-Datei.
Um 09:00 Uhr wählt ihr euch in eine BBB-Konferenz ein, Link ist im Arbeitsauftrag um 07:50 Uhr enthalten! In der Konferenz werden wir die Aufgaben besprechen.
Distanzunterricht Mittwoch, 27.01.
Besprechung der letzten Online-Einheit: Aufstellen von Redoxgleichungen. Neu: Ermitteln der Oxidationszahlen bei organischen Molekülen (Buch, S. 85). Hefteintrag wurde mit einer umfangreichen Hausaufgabe verschickt. Die Hausaufgabe ist zu erledigen bis Dienstag, 02.02., 09:00 Uhr, d.h. ihr dürft die 1. (Chemie-)Unterrichtsstunde an diesem Tag dafür verwenden.
Distanzunterricht Dienstag, 26.01.
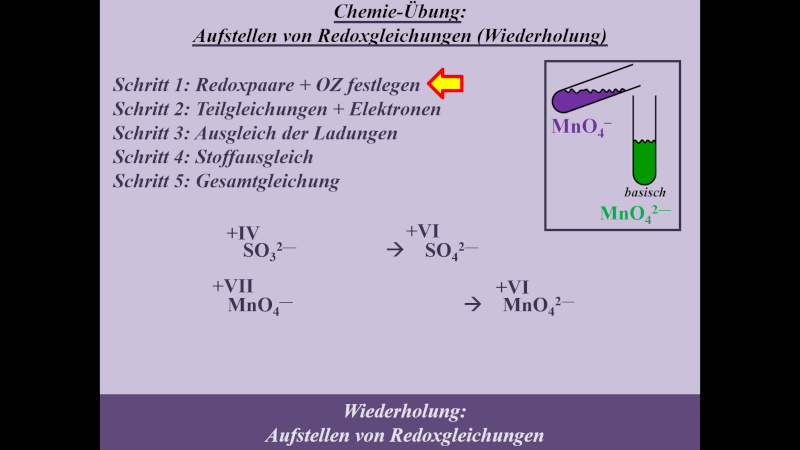
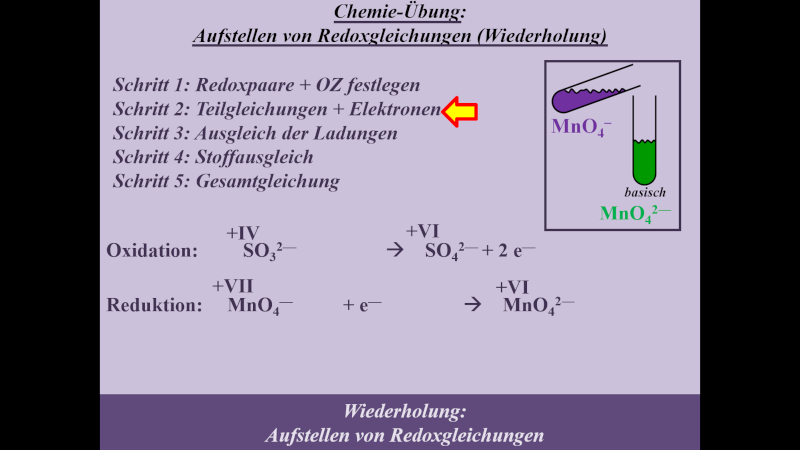
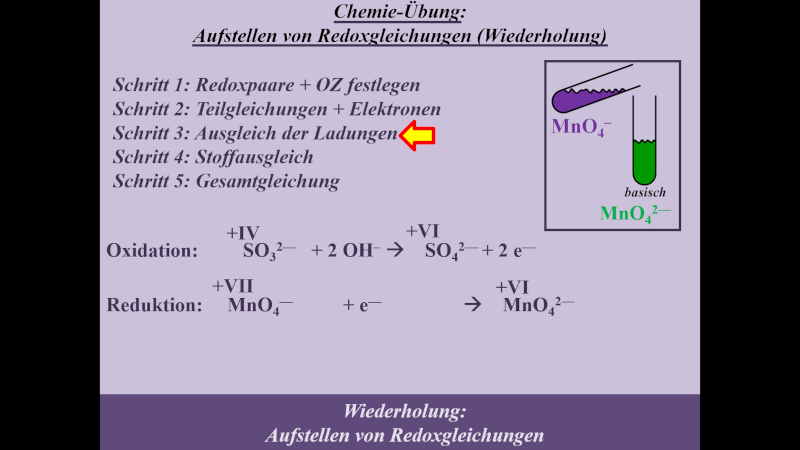
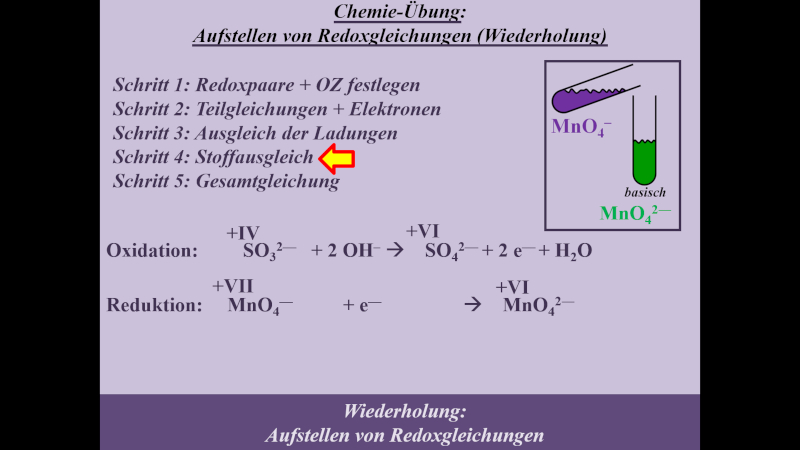
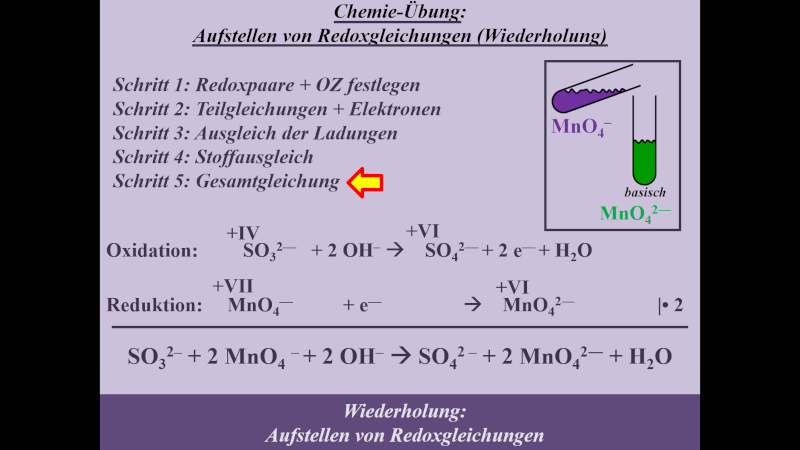
Die folgende Einheit soll auf das chemische Reaktionsverhalten von Alkoholen hinführen. Dazu ist eine Wiederholung von Unterrichtsstoff aus dem letzten Schuljahr nötig: Die Redoxreaktionen. Das folgende Video wiederholt alles, was für die folgenden Stunden wichtig ist. Es ist sehr ausführlich und schreitet langsam voran. Wahrscheinlich werden sich einige von euch langweilen. Aber auch diejenigen unter euch, die letztes Jahr unter Umständen große Probleme beim Aufstellen von Redoxgleichungen hatten: Das Video erklärt wirklich jeden einzelnen Schritt, den man machen muss. Das Video dauert fast 30min. Danach sollt ihr selbst weitere Aufgaben lösen. Dazu benötigt ihr ein Arbeitsblatt, welches ihr am besten schon vor dem Anschauen des Videos ausdruckt oder in einem separaten Fenster öffnet
- Hier gibt es das Arbeitsblatt: pdf-Datei (Neue Version hochgeladen. Bei der Aufgabe 2 war ein Fehler: Es muss MnO42- heißen, nicht MnO2-)
Distanzunterricht Mittwoch, 19.01.
Ihr habt gestern sehr gut mitgearbeitet, daher heute eine etwas weniger anspruchsvolle Stunde. Mit dem folgenden Link gelangt ihr auf eine Seite von BR alpha (Ein TV-Sender, der zum Bayerischen Rundfunk gehört):
Trinkalkohol
Diese Seite besitzt sieben Unterkapitel, die ihr dort auf der rechten Seite der Homepage anklicken könnt:
1. Alkoholische Gärung in der Brauerei
2. Die alkoholische Gärung im Labor
3. Was macht Ethanol zu einem Alkohol
usw.
Zu jedem Kapitel gibt es einen kurzen Film (insgesamt ca. 35 Minuten) und darunter ein Quiz. Ich vertraue darauf, dass ich ihr euch heute alleine mit dieser Seite 45 Minuten beschäftigen könnt. Wer noch eine etwas anspruchsvollere Aufgabe braucht, bearbeitet bitte die folgende Aufgabe (Kontrolle in der nächsten Stunde am Di, 26.01.): pdf-Datei
Distanzunterricht Montag, 18.01.
Hallo 10d!
In der letzten Woche kam es vor allem in der 1. Stunde zu Problemen bei manchen Videokonferenzen. Höchstwahrscheinlich ist der Server überlastet, an dem Problem wird gearbeitet. Solange verzichte ich auf die Videokonferenz in der 1. Stunde, ich kann mit euch ja auch in der zweiten Stunde sprechen. Der Zeitplan für heute sieht also so aus:
- Um 07:50 Uhr solltet ihr einen Arbeitsauftrag über den Schulmanager erhalten haben, auf den ihr bis spätestens 08:15 Uhr antwortet. Das dient zunächst als Anwesenheitskontrolle. Erhalte ich keine Rückmeldung von euch, melde ich euch im Sekretariat als fehlend (was vermutlich dazu führt, dass eure Eltern informiert werden).
- Ihr arbeitet bis 09:00 Uhr alleine hier an diesem Arbeitsauftrag im WIKI
- Dann starte ich eine BBB-Konferenz und wir besprechen, was ihr hier geschafft habt.
Für diesen Arbeitsauftrag benötigt ihr euer Buch und einen Zettel mit Stift.
Distanzunterricht am Mittwoch, 13.01.
Distanzunterricht am Dienstag 12.01.
Arbeitsauftrag wurde über Schulmanager verschickt. Nach einer Einführungsphase sollt ihr in Gruppen an euren Ergebnissen zur Recherche von Haushaltsgegenständen aus Kunststoff und ihren Alternativen arbeiten. Das entsprechende Arbeitsblatt wurde ebenfalls über den Schulmanager verschickt. Falls ihr aus technischen Gründen nicht an der Videokonferenz teilnehmen könnt, bearbeitet das Arbeitsblatt alleine, ihr könnt es hier noch einmal herunterladen:
pdf-Datei
Distanz-Lernen am Mittwoch 16.12. (ALLE)
Arbeitsauftrag für Donnerstag, 10.12. (nur Gruppe B)
Arbeitsauftrag für Mittwoch, 09.12. (nur Gruppe A)
Arbeitsauftrag für Donnerstag, 03.12. (nur Gruppe A)
Arbeitsauftrag für Mittwoch, 02.12. (nur Gruppe B)
Quarantäne-Einheit 2
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Quarantäne-Einheit 1: Aufgaben
Für diese Einheit benötigt ihr: Euer Schulbuch, Zettel und Stift, eine Internetverbindung und Ruhe. Die Bearbeitungsdauer sollte 30 Minuten nicht wesentlich übersteigen.