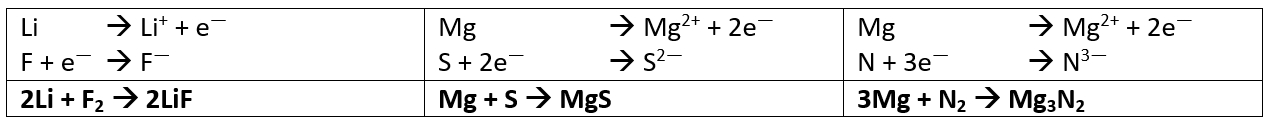|
|
| (40 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) |
| Zeile 1: |
Zeile 1: |
| ==Distanzunterricht ab Januar== | | ==Distanzunterricht nach den Osterferien== |
| === Distanzunterricht Montag, 22.02. ===
| | Im Archiv: [[9e_2020_21/Chemie/Archiv| Hier klicken]] |
| | | == Distanzunterricht ab Januar == |
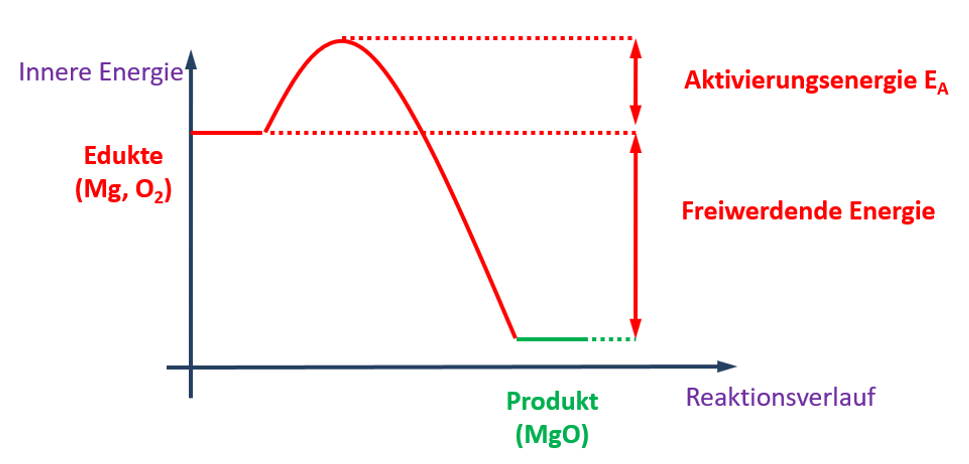
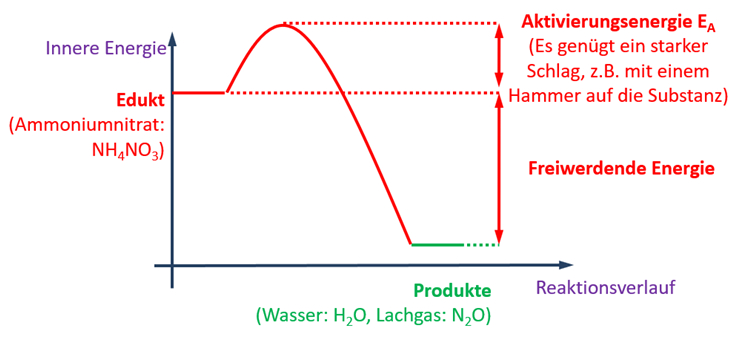
| In den letzten beiden Einheiten habt ihr euch unter anderem mit Säuren im Haushalt beschäftigt. Ich fasse zusammen:<br>
| | Im Archiv: [[9e_2020_21/Chemie/Archiv| Hier klicken]] |
| Auf '''Stoffebene '''(was man sehen, fühlen, messen kann) wisst ihr:
| | == Distanzlernen vor Weihnachten == |
| * Säuren schmecken sauer (<span style="color:#F00">ACHTUNG: Nur manche Säuren, z.B. aus Lebensmitteln sind genießbar. Viele im Labor verwendete Säuren sind hochgiftig bzw. stark ätzend</span>)
| | Im Archiv: [[9e_2020_21/Chemie/Archiv| Hier klicken]] |
| * Säuren färben einige Farbstoffe (Indikatoren) auf charakteristische Art und Weise.
| |
| Auf '''Teilchenebene'''(das, was man sich vorstellen muss) wisst ihr:
| |
| * Säuren enthalten ein Wasserstoffatom, das über eine stark polare Atombindung gebunden ist.
| |
| * Durch eine heterolytische Bindungstrennung kann aus dieser Bindung ein Proton abgespalten werden (Ein Proton = Ein Wasserstoffatom ohne Elektron)
| |
| * Es muss ein Partner vorhanden sein, der dieses Proton aufnimmt (z.B. Wasser)
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">Fall noch nicht geschehen: '''Verbesserung der Hausaufgabe'''</span>
| |
| |Inhalt=
| |
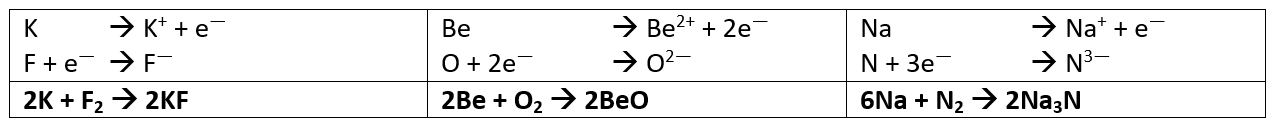
| Wenn neutrale Säuren ein oder mehrere Proton(en) abspalten, bleiben negativ geladene Säurereste zurück. '''Die Namen dieser Säurereste müsst ihr auswendig lernen!''' Diese negativ geladenen Molekül-Ionen können Salze bilden, genau wie ihr es in der 8. Jahrgangsstufe gelernt habt. Der Unterschied besteht nur darin, dass ihr letztes Jahr wahrscheinlich nur "einfache" Atom-Ionen kennengelernt habt. Also einzelne Atome, die Elektronen abgegeben oder aufgenommen haben und daher geladen waren.<br>
| |
| Die Säurereste, die ihr jetzt kennengelernt habt, bestehen aus mehreren Atomen, die fest miteinander verbunden sind. Es handelt sich also um Moleküle. Und wenn solche Teilchen eine Ladung tragen, spricht man von Molekül-Ionen. Das folgende Bild vergleicht noch einmal schematisch einen Salzkristall, der nur aus Atomionen besteht (links: Natriumchlorid) und ein Salz, welches Säurereste als negativ geladene Anionen enthält (rechts: Calciumsulfat): <br>
| |
| <br>[[Datei:C9NTG_Vgl_Salz8_SalzSäurerest.jpg]]<br>
| |
| <br>
| |
| Eure Hausaufgabe war es, auf dem Arbeitsblatt in den letzten beiden Tabellen die chemische Formel bestimmter Salze aus dem Namen abzuleiten, bzw. den Namen aus der chemischen Formel abzuleiten. Falls ihr das Arbeitsblatt nicht mehr findet: Hier die [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB.pdf| pdf-Datei]]). Solltet ihr bei der Erledigung dieser Hausaufgabe keine Probleme hattet, dann könnt ihr die folgenden Tipps überspringen. Andernfalls öffnet die pdf-Datei mit den leeren Tabellen und versucht es mit Hilfe der Tipps erneut:<br>
| |
| <br>
| |
| '''Die ersten drei: Kaliumsulfat, Aluminiumphosphat, Natriumcarbonat''' - sind eigentlich einfach
| |
| {{Lösung versteckt|
| |
| Falls ihr die Lösung nicht sofort erkennt:
| |
| * Überlegt welche Ionen Kalium bildet (erkennt man anhand der Position im PSE)
| |
| * Der Begriff "...sulfat" ist eindeutig. Ähnlich wie eine Vokabel müsst die chemische Formel dafür auswendig kennen - oder nachschlagen.
| |
| {{Lösung versteckt|
| |
| * K bildet einfach positiv geladene Ionen: K<sup>+</sup>
| |
| * ...sulfat bedeutet SO<sub>4</sub><sup>2-</sup>
| |
| * Der letzte Schritt ist die Überlegung, in welchem Verhältnis diese beiden Ionen zusammengesetzt werden müssen, damit ein insgesamt "nicht geladenes", neutrales Salz entsteht: 2 K<sup>+</sup>-Teilchen und 1 SO<sub>4</sub><sup>2-</sup>-Teilchen. Damit lautet die Formel K<sub>2</sub>SO<sub>4</sub> (Die Ladungen werden in der chemischen Gleichung für ein Salz nicht mehr geschrieben).
| |
| <br>
| |
| Für die anderen beiden solltet ihr das jetzt alleine hinbekommen!
| |
| {{Lösung versteckt|
| |
| * Aluminiumphosphat:
| |
| ** Al bildet dreifach positiv geladene Ionen: Al<sup>3+</sup>
| |
| ** ...phosphat bedeutet PO<sub>4</sub><sup>3-</sup>
| |
| ** Die Formel muss also lauten AlPO<sub>4</sub>
| |
| * Natriumcarbonat:
| |
| ** Na bildet einfach positiv geladene Ionen: Na<sup>+</sup>
| |
| ** ...carbonat bedeutet CO<sub>3</sub><sup>2-</sup>
| |
| ** Die Formel muss also lauten Na<sub>2</sub>CO<sub>3</sub>
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 2|Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Die nächsten zwei: Magnesiumdihydrogenphosphat, Aluminiumsulfat'''
| |
| {{Lösung versteckt|
| |
| * geht im Prinzip geht genauso:
| |
| * Mg bildet zweifach positiv geladene Ionen: Mg<sup>2+</sup>
| |
| * ...dihydrogenphosphat bedeutet H<sub>2</sub>PO<sub>4</sub><sup>-</sup>
| |
| * Jetzt taucht allerdings ein Problem auf: Ein neutrales Salz entsteht, wenn pro Mg<sup>2+</sup>-Teilchen '''zwei '''H<sub>2</sub>PO<sub>4</sub><sup>-</sup>-Teilchen vorliegen. Um das in einer chemischen Formel anzuzeigen, benutzt man Klammern:<br>
| |
| <br>
| |
| Mg(H<sub>2</sub>PO<sub>4</sub>)<sub>2</sub><br>
| |
| <br>
| |
| O.k., jetzt ihr: Aluminiumsulfat!
| |
| {{Lösung versteckt|
| |
| * Aluminiusulfat:
| |
| ** Al bildet dreifach positiv geladene Ionen: Al<sup>3+</sup>
| |
| ** ...sulfat bedeutet SO<sub>4</sub><sup>2-</sup>
| |
| ** Damit ein neutrales Salz entsteht braucht man 2 Al<sup>3+</sup> und 3 SO<sub>4</sub><sup>2-</sup>: Die Formel muss also lauten Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}
| |
| <br>
| |
| '''Die letzten zwei: Calciumnitrat, Ammoniumhydrogencarbonat'''
| |
| {{Lösung versteckt|
| |
| * Calciumnitrat:
| |
| ** Ca bildet zweifach positiv geladene Ionen: Ca<sup>2+</sup>
| |
| ** ...nitrat bedeutet NO<sub>3</sub><sup>-</sup>
| |
| ** Die Formel muss also lauten Ca(NO<sub>3</sub>)<sub>2</sub>
| |
| <br>
| |
| Vielleicht wisst ihr bei der letzten Aufgabe nicht, was Ammonium... bedeutet. Das ist die Bezeichnung für ein positiv geladenes Molekül: NH<sub>4</sub><sup>+</sup>. Der Rest funktioniert genauso.
| |
| {{Lösung versteckt|
| |
| * Ammoniumhydrogencarbonat:
| |
| ** Ammonium... bedeutet NH<sub>4</sub><sup>+</sup>
| |
| ** ...hydrogencarbonat bedeutet HCO<sub>3</sub><sup>-</sup>
| |
| ** Die Formel muss also lauten NH<sub>4</sub>HCO<sub>3</sub> oder NH<sub>4</sub>(HCO<sub>3</sub>)
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}
| |
| <br><br>
| |
| Die zweite Tabelle ist deutlich einfacher, weil man keine mathematischen Überlegungen anstellen muss!
| |
| {{Lösung versteckt|
| |
| Hast Du alle Zellen ausgefüllt?
| |
| {{Lösung versteckt|
| |
| Sicher?
| |
| {{Lösung versteckt|
| |
| [[Datei:SäBa_Salznamen_abgel_Säurerest.jpg]]
| |
| |Jaaa!!!|Lösung ausblenden}}<br>
| |
| |Ja!|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Die "Gegenspieler" der Säuren'''</span>
| |
| |Inhalt=
| |
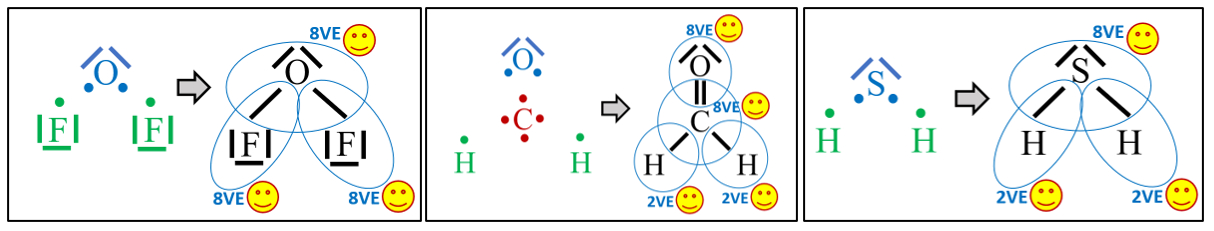
| Die folgenden Abbildungen zeigen alle die Abspaltung eines Protons: <br>
| |
| [[Datei:SäBa2_Heterolyse_divDarstellungen.jpg|600px]]<br>
| |
| <br>
| |
| Diese Reaktion habt ihr als "typisch" für <span style="color:#F00">'''Säuren'''</span> kennengelernt. Sehen kann man diesen Vorgang zwar nicht direkt, aber mit Hilfe von bestimmten Farbstoffen (den Indikatoren) kann man darauf schließen. Wenn ihr den Versuch von letzter Stunde mit dem Hagebutten-Tee, bzw. dem Blaukrautsaft gemacht habt, dann solltet ihr folgendes Ergebnis erhalten haben: <br>
| |
| <span style="color:#F00">'''Säuren'''</span> färben die Indikatoren in bestimmter Art und Weise, durch Zugabe von Waschpulver wird die Wirkung aber wieder aufgehoben. Im <span style="color:#00F">'''Waschpulver'''</span> schein also ein Stoff enthalten zu sein, der eine Art "Gegenspieler" der <span style="color:#F00">'''Säuren'''</span> ist. <br>
| |
| Verlassen wir mal die Stoffebene (also das was man sehen, fühlen, messen kann - hier: die Farben des Indikators) und überlegen theoretisch auf Teilchenebene, was für eine Eigenschaft dieser <span style="color:#00F">'''Stoff im Wachpulver'''</span> haben sollte: Wenn die Farbänderung des Indikators durch <span style="color:#F00">'''Säuren'''</span> hervorgerufen wird durch die
| |
| <span style="color:#F00">Abspaltung eines Protons</span> - was könnte der <span style="color:#00F">'''Stoff im Waschpulver'''</span> dann auf Teilchenebene wohl "machen", damit das keine Auswirkungen hat? Oder die Auswirkungen rückgängig machen kann?
| |
| | |
| {{Lösung versteckt|
| |
| Anderes Beispiel: Nehmt an, im Pausenhof gibt es kleines Kind, das auf dem Boden sitzt und Karten spielt. Ein böser Teenager (Säure) kommt vorbei und setzt dem kleinen Kind eine Spinne auf die Schulter (Abgabe eines Protons). Das Kind fängt an zu schreien (Indikator verfärbt sich). Jetzt soll ein guter Teenager (Stoff aus dem Waschpulver) vorbeikommen, der dazu führt, dass das Kind nicht mehr schreit (Indikator färbt sich wieder zurück). Was hat der gute Teenager (Stoff aus dem Waschpulver) wohl getan?
| |
| {{Lösung versteckt|
| |
| Er hat wohl dem Kind die Spinne wieder von der Schulter genommen. Was bedeutet das jetzt für Säuren: Wenn die Abgabe eines Protons in diesem Beispiel für das Draufsetzen der Spinne auf das Kind steht, was bedeutet dann das Wegnehmen der Spinne wohl auf Teilchenebene für den Stoff aus dem Waschpulver?
| |
| {{Lösung versteckt|
| |
| Der Stoff aus dem Waschpulver muss in der Lage sein, ein Proton aufzunehmen! - Solche Stoffe nennt man ganz allgemein '''"Basen"'''
| |
| |Lösung|Lösung ausblenden}}
| |
| |Tipp2|Lösung ausblenden}}
| |
| |Tipp1|Lösung ausblenden}}
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Beispiel'''</span>
| |
| |Inhalt=
| |
| Ein einfaches Molekül, dass in der Lage ist, <span style="color:#00F">ein Proton aufzunehmen</span> ist <span style="color:#00F">NH<sub>3</sub></span> (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen:<br>
| |
| [[Datei:SäBa2_NH3_AufnahmeProton.jpg|600px]]<br> | |
| <br>
| |
| | |
| {{Lösung versteckt|
| |
| Das Ammoniak-Molekül NH<sub>3</sub> stellt sein freies Elektronen-Paar für eine Atombindung mit einem Proton zur Verfügung
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Was ist der Unterschied zwischen dieser neu gebildeten Atombindung im Vergleich zu einer "normalen" Atombindung, wie ihr sie früher kennengelernt habt?
| |
| <br>
| |
| {{Lösung versteckt|
| |
| Bei der Bildung einer Atombindung sind wir in den vorangegangenen Einheiten davon ausgegangen, dass jeder Partner ein Elektron zur Verfügung stellt. Hier stammen aber beide Elektronen der Atombindung nur vom Stickstoff-Atom. Das Proton hat kein Elektron zur Bindung beigetragen.
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">"Hausaufgabe"</span>
| |
| |Inhalt=
| |
| 1. Formuliert die Aufnahme '''eines Protons''' auf Teilchen-Ebene von folgenden Basen:
| |
| * Hydrogencarbonat-Ion
| |
| * Sulfid-Ion
| |
| [[Datei:SäBa2_HCO3minus_VSF.jpg|200px]] [[Datei:SäBa2_S2minus_VSF.jpg|200px]]<br>
| |
| Bitte wirklich erst auf "Lösung" klicken, wenn ihr diesen chemischen Vorgang auf ein Stück Papier gezeichnet habt!
| |
| {{Lösung versteckt|
| |
| Hast Du wirklich die Lösung schon gezeichnet?
| |
| {{Lösung versteckt|
| |
| [[Datei:SäBa2_HA_ML.jpg|600px]]<br>
| |
| Beim Hydrogencarbonat-Ion könnte es sein, dass ihr ein anderes freies Elektronenpaar für die Bindung zum Proton verwendet habt. Das ist aber falsch! Das Proton wird immer über eines der drei freie Elektronenpaare gebunden, die am Sauerstoff mit der negativen Ladung sitzen (im Bild blau markiert). Schon allein aufgrund der elektrischen Ladung dort, wird das positiv geladene Proton dort hin gezogen.<br>
| |
| Beim Sulfid-Ion ist egal, welches Elektronenpaar verwendet wird, das Ergebnis ist faktisch immer das selbe.
| |
| |Ja!|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| 2. Lest im Buch die S. 106!
| |
| 3. Bearbeitet die Aufgabe 1 schriftlich. Es sollten jetzt noch keine 45 min. um sein, so dass ihr diese Aufgabe gut im Rahmen der Unterrichtssstunde erledigen könnt. Ich werde in der näc hsten Videokonferenz einzelne Personen ihre Lösung vorlesen lassen.
| |
| <br>
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
| <br>
| |
| === Distanzunterricht Donnerstag, 18.02., 8. Std. ===
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">Versuche mit Indikatoren</span>
| |
| |Inhalt=
| |
| ''Für diesen Versuch benötigt ihr:''
| |
| * Einen '''Indikator '''(z.B. Blaukrautsaft oder Hagebutten-Tee - ihr dürft natürlich auch beide ausprobieren)
| |
| ** Herstellung des Blaukraut-Indikators: (siehe auch Online-Einheit vor Weihnachten): Schneidet zwei bis drei Blätter eines frischen Rotkohls-Kopfes klein, übergießt die Stücke mit wenig Wasser uns lasst diesen Ansatz 10 Minuten stehen. Gelegentlich umrühren.
| |
| ** Herstellung des Hagebutten-Indikators: Einfach einen Hagebutten-Teebeutel mit heißem Wasser übergießen und 10min. warten.
| |
| * eine Säure, z.B. Zitronensaft oder Essig
| |
| * Waschpulver (nur eine Prise)
| |
| <br>
| |
| ''Theoretischer Hintergrund:''<br>
| |
| '''Säuren''' haben in der Chemie einen '''Gegenspieler'''. Das bedeutet, es gibt Substanzen, welche die Wirkung von Säuren aufheben können. Was dabei auf Teilchenebene passiert, betrachten wir nächste Woche. Heute sollt ihr dieses "Gegenspieler-Prinzip" in einem Versuch auf Stoffebene kennenlernen.<br>
| |
| <br>
| |
| ''Versuchsdurchführung mit '''Blaukrautsaft''' als Indikator'':<br>
| |
| * Gebt etwas von eurem Blaukrautsaft in ein durchsichtiges Gefäß.
| |
| * Je nachdem, wie intensiv gefärbt euer Saft ist, könnt ihr ihn auch etwas verdünnen. Durch ein mit dem Saft gefülltes, normales Wasserglas solltet ihr problemlos hindurchschauen können.
| |
| * Die Farbe dieses (verdünnten Blaukraut-Saftes) sollte zunächst violett sein.
| |
| * Tropft ganz wenig Zitronensaft oder Essig dazu.
| |
| * Ihr solltet einen deutlichen '''Farbumschlag '''nach rot erkennen.
| |
| * Bis hierhin nichts neues. Das habt ihr auch vor Weihnachten schon mal gemacht. Gebt die Hälfte dieses Zitronen/Essig-Blaukrautsaftes in ein zweites Glas und streut jetzt eine Prise Waschpulver dazu. Macht vom Ergebnis ein Foto (es sollten beide Gläser zu erkennen sein)
| |
| * Versucht nun mit Zitronensaft wieder die rote Farbe zu erzeugen und dann mit Waschpulver wieder rückgängig zu machen!
| |
| <br>
| |
| ''Versuchsdurchführung mit '''Hagebutten-Tee''' als Indikator'':<br>
| |
| * Gebt etwas von eurem Hagebutten-Tee in ein durchsichtiges Gefäß.
| |
| * Die Farbe dieses Hagebutten-Tees sollte zunächst rot sein.
| |
| * Streut jetzt eine Prise Waschpulver dazu
| |
| * Ihr solltet einen deutlichen '''Farbumschlag '''nach grün/braun erkennen.
| |
| * Versucht nun mit Zitronensaft wieder die rote Farbe zu erzeugen und dann mit Waschpulver wieder rückgängig zu machen!
| |
| <br>
| |
| {{Lösung versteckt|
| |
| [[Datei:SäBa_Ind_Hagebutte_ZitrWaschp.jpg]]
| |
| |Bei mir sieht das so aus|Lösung ausblenden}}<br>
| |
| | |
| ''Ergebnis'':<br>
| |
| Waschpulver enthält offensichtlich einen Stoff, der in der Lage ist, die von Säuren hervorgerufene Farbänderung wieder rückgängig zu machen. Solche Stoffe nennt man '''Basen'''.
| |
| <br><br>
| |
| ''Aufräumen'':<br>
| |
| Den Rest den Rotkohls legt ihr wieder dorthin, wo ihr ihn her habt. Zitronenreste in Müll. Essig zurück stellen. Inhalt der Gläser in Abguss, Gläser in Spülmaschine oder selbst spülen, abtrocken und zurück in den Schrank. Mit einem feuchten Tuch über die Arbeitsfläche wischen, trockenen. Fertig!
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Verbesserung der Hausaufgabe'''</span>
| |
| |Inhalt=
| |
| Solltet ihr heute noch keine 90min. mit Chemie verbracht haben, verbessert bitte die Hausaufgabe (die beiden untersten Tabellen auf dem AB - falls ihr es nicht mehr habt: [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB.pdf| pdf-Datei]]). Notiert euch, welche Aufgaben ihr falsch hattet, dann können wir in der nächsten Videokonferenz am Donnerstag (25.02.)schauen, wo die Probleme lagen.<br>
| |
| <br>
| |
| '''Die ersten drei: Kaliumsulfat, Aluminiumphosphat, Natriumcarbonat''' - sind eigentlich einfach
| |
| {{Lösung versteckt|
| |
| Falls ihr die Lösung nicht sofort erkennt:
| |
| * Überlegt welche Ionen Kalium bildet (erkennt man anhand der Position im PSE)
| |
| * Der Begriff "...sulfat" ist eindeutig. Ähnlich wie eine Vokabel müsst die chemische Formel dafür auswendig kennen - oder nachschlagen.
| |
| {{Lösung versteckt|
| |
| * K bildet einfach positiv geladene Ionen: K<sup>+</sup>
| |
| * ...sulfat bedeutet SO<sub>4</sub><sup>2-</sup>
| |
| * Der letzte Schritt ist die Überlegung, in welchem Verhältnis diese beiden Ionen zusammengesetzt werden müssen, damit ein insgesamt "nicht geladenes", neutrales Salz entsteht: 2 K<sup>+</sup>-Teilchen und 1 SO<sub>4</sub><sup>2-</sup>-Teilchen. Damit lautet die Formel K<sub>2</sub>SO<sub>4</sub> (Die Ladungen werden in der chemischen Gleichung für ein Salz nicht mehr geschrieben).
| |
| <br>
| |
| Für die anderen beiden solltet ihr das jetzt alleine hinbekommen!
| |
| {{Lösung versteckt|
| |
| * Aluminiumphosphat:
| |
| ** Al bildet dreifach positiv geladene Ionen: Al<sup>3+</sup>
| |
| ** ...phosphat bedeutet PO<sub>4</sub><sup>3-</sup>
| |
| ** Die Formel muss also lauten AlPO<sub>4</sub>
| |
| * Natriumcarbonat:
| |
| ** Na bildet einfach positiv geladene Ionen: Na<sup>+</sup>
| |
| ** ...carbonat bedeutet CO<sub>3</sub><sup>2-</sup>
| |
| ** Die Formel muss also lauten Na<sub>2</sub>CO<sub>3</sub>
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 2|Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Die nächsten zwei: Magnesiumdihydrogenphosphat, Aluminiumsulfat'''
| |
| {{Lösung versteckt|
| |
| * geht im Prinzip geht genauso:
| |
| * Mg bildet zweifach positiv geladene Ionen: Mg<sup>2+</sup>
| |
| * ...dihydrogenphosphat bedeutet H<sub>2</sub>PO<sub>4</sub><sup>-</sup>
| |
| * Jetzt taucht allerdings ein Problem auf: Ein neutrales Salz entsteht, wenn pro Mg<sup>2+</sup>-Teilchen '''zwei '''H<sub>2</sub>PO<sub>4</sub><sup>-</sup>-Teilchen vorliegen. Um das in einer chemischen Formel anzuzeigen, benutzt man Klammern:<br>
| |
| <br>
| |
| Mg(H<sub>2</sub>PO<sub>4</sub>)<sub>2</sub><br>
| |
| <br>
| |
| O.k., jetzt ihr: Aluminiumsulfat!
| |
| {{Lösung versteckt|
| |
| * Aluminiusulfat:
| |
| ** Al bildet dreifach positiv geladene Ionen: Al<sup>3+</sup>
| |
| ** ...sulfat bedeutet SO<sub>4</sub><sup>2-</sup>
| |
| ** Damit ein neutrales Salz entsteht braucht man 2 Al<sup>3+</sup> und 3 SO<sub>4</sub><sup>2-</sup>: Die Formel muss also lauten Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}
| |
| <br>
| |
| '''Die letzten zwei: Calciumnitrat, Ammoniumhydrogencarbonat'''
| |
| {{Lösung versteckt|
| |
| * Calciumnitrat:
| |
| ** Ca bildet zweifach positiv geladene Ionen: Ca<sup>2+</sup>
| |
| ** ...nitrat bedeutet NO<sub>3</sub><sup>-</sup>
| |
| ** Die Formel muss also lauten Ca(NO<sub>3</sub>)<sub>2</sub>
| |
| <br>
| |
| Vielleicht wisst ihr bei der letzten Aufgabe nicht, was Ammonium... bedeutet. Das ist die Bezeichnung für ein positiv geladenes Molekül: NH<sub>4</sub><sup>+</sup>. Der Rest funktioniert genauso.
| |
| {{Lösung versteckt|
| |
| * Ammoniumhydrogencarbonat:
| |
| ** Ammonium... bedeutet NH<sub>4</sub><sup>+</sup>
| |
| ** ...hydrogencarbonat bedeutet HCO<sub>3</sub><sup>-</sup>
| |
| ** Die Formel muss also lauten NH<sub>4</sub>HCO<sub>3</sub> oder NH<sub>4</sub>(HCO<sub>3</sub>)
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}
| |
| <br><br>
| |
| Die zweite Tabelle ist deutlich einfacher, weil man keine mathematischen Überlegungen anstellen muss!
| |
| {{Lösung versteckt|
| |
| Hast Du alle Zellen ausgefüllt?
| |
| {{Lösung versteckt|
| |
| Sicher?
| |
| {{Lösung versteckt|
| |
| [[Datei:SäBa_Salznamen_abgel_Säurerest.jpg]]
| |
| |Jaaa!!!|Lösung ausblenden}}<br>
| |
| |Ja!|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Donnerstag, 18.02., 6. Std.===
| |
| | |
| Heute mal eine etwas andere Aufgabe. Ihr habt in den letzten Unterrichtseinheiten einige Dinge über '''Säuren '''gelernt. Hauptsächlich, dass sie auf Teilchen-Ebene in der Lage sind, '''ein Proton (oder mehrere) abzuspalten'''. Aber auch, dass sie in der Lage sind bestimmte '''Farbstoffe umzufärben'''. Die meisten Säuren, die man im Unterricht der 9. Jahrgangsstufe bespricht, sind relativ aggressiv und daher gefährlich, wie z.B.: Schwefelsäure, Salzsäure oder Salpetersäure. <br>
| |
| Es gibt aber eine ganze Reihe von Säuren, die in kleinen Mengen in Lebensmitteln vorkommen und (in der Regel) positive Auswirkungen auf den Geschmack haben. Wenn ihr schon einmal Kochsendungen gesehen habt, dann kennt ihr vielleicht solche Sätze wie <br>
| |
| * „Diese Barbecue-Sauce mit Rhabarber besticht durch ein feines Säurespiel“ oder
| |
| * „Ein leichtes Gericht mit schönem Säurespiel, das Gusto auf mehr macht…“ oder
| |
| * „…süß und von öliger Textur, fein und sehr edel mit elegantem Säurespiel und nachhaltigem Fruchtgeschmack.“
| |
| <br>
| |
| '''Eure Aufgabe für heute: '''
| |
| * Sucht bei euch zu Hause Lebensmittel, die Säuren enthalten.
| |
| * Stellt '''mindestens fünf''' schön nebeneinander auf den Tisch.
| |
| * Macht kleine Schildchen, auf denen der Name der Säure steht, die in dem Lebensmittel enthalten ist.
| |
| * Fotografiert das! Schickt mir das Foto als Antwort auf den Arbeitsauftrag im Schulmanager (kommt am Anfang der Unterrichtsstunde)
| |
| * ''Hinweise:'' Bevor ihr das Foto macht, stellt an der Kamera die Qualität/Auflösung niedriger ein. Oft schickt ihr Fotos, deren Dateigröße gigantisch ist. In einer so hohen Auflösung wird das Bild aber nie gebraucht!
| |
| * ''Noch mehr Hinweise:'' Wenn ihr Lebensmittel anschneidet oder Verpackungen öffnet, stellt sicher, dass sie anschließend auch verzehrt werden!
| |
| <br>
| |
| Ein Beispiel, wie eine solche Kollage aussehen könnte, findet ihr im Arbeitsauftrag, der über den Schulmanager kommt<br>
| |
| <br>
| |
| Eine kleine Hilfestellung mit Beispielen von Säuren in Lebensmitteln. Ihr könnt aber auch auf der Zutaten- oder Inhaltsstoff-Liste von Lebensmitteln nach Säuren suchen:
| |
| * '''Zitronensäure '''(enthalten in: Zitrusfrüchten)
| |
| * '''Milchsäure '''(enthalten in: Milch und Milchprodukten)
| |
| * '''Essigsäure '''(enthalten in: Essig oder Essig haltigen Produkten, z.B. Senf)
| |
| * '''Äpfelsäure '''(enthalten in: Äpfeln – aber eigentlich in allen Zellen fast jedes Lebewesens)
| |
| * '''Weinsäure '''(enthalten in: Wein – Achtung! Fragt erst bei euren Eltern nach, ob ihr Wein verwenden dürft)
| |
| * '''Phosphorsäure '''(enthalten in: Cola)
| |
| * '''Ameisensäure '''(enthalten in: Honig)
| |
| * '''Kohlensäure '''(enthalten in: Erfrischungsgetränken)
| |
| | |
| | |
| === Distanzunterricht Dienstag, 09.02.===
| |
| In dieser Einheit ist von einem Arbeitsblatt die Rede: [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB.pdf| pdf-Datei]]. Ihr könnt es euch ausdrucken, um damit zu arbeiten, das ist aber nicht unbedingt nötig! Ihr könnt es auch nur in einem zweiten Fenster öffnen und die Lösungen für die Aufgaben auf ein Blatt schreiben. Am Ende der Lerneinheit (vermutlich Do, 11.02.) erhaltet ihr das komplett ausgefüllte Arbeitsblatt zum Herunterladen.<br>
| |
| Für diese Online-Einheit braucht ihr vorerst nur einen Zettel und einen Stift.
| |
| * Schaut zunächst das folgende Video.
| |
| * Vervollständigt dann die Tabellen, die im Video bereits angefangen wurden.
| |
| * Löst die weiteren Aufgaben hier im WIKI
| |
| * Im Anschluss an die Einheit könnt ihr einen Hefteintrag herunterladen, den ihr bitte ins Heft abschreibt oder ausdruckt und einklebt.
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Säuren auf Stoff- und Teilchenebene'''</span>
| |
| |Inhalt=
| |
| {{#ev:youtube|W_z2iXy23ao}}<br>
| |
| <br>
| |
| Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgabe(n): <br>
| |
| * Ergänzt auf dem AB die im Video bereits begonnen Tabellen. Für die Namen der Säure-Reste könnt ihr im Internet recherchieren (was aber umständlich ist, weil die Informationen oft sehr fachwissenschaftlich ausgedrückt sind) oder ihr verwendet euer Buch auf der S. 101.
| |
| | |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_Säuren_Protolysegleichungen.jpg]]
| |
| |Lösung für erste Tabelle|Lösung ausblenden}}<br>
| |
| | |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_Säuren_Protolysegleichungen2.jpg]]
| |
| |Lösung für zweite Tabelle|Lösung ausblenden}}<br>
| |
| | |
| Jetzt noch den Hefteintrag herunterladen:[[Spezial:FilePath/C9NTG_PP21_Säuren_Heft.pdf| pdf-Datei]] <br>
| |
| und bis zum nächsten Mal die Seiten 100 - 101 lesen!
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Montag, 08.02.===
| |
| Für diese Online-Einheit benötigt ihr ca. 30min. Solltet ihr tatsächlich 15min. oder mehr übrig haben, empfehle ich die Teilnahme am Rhythmus-Projekt der Sportfachschaft (s. Startseite des WIKIs: oben rechts.)<br>
| |
| <br>
| |
| Ihr benötigt für diese Einheit evtl. das Schulbuch, einen Zettel, Stift und eine einigermaßen stabile Internetverbindung. Langfristig wollen wir auf das Thema "Säuren" zusteuern. Heute allerdings zunächst eine "Überleitungs-Stunde", in der einige bereits bekannte Inhalte aufgearbeitet werden. Am Ende der Einheit könnt ihr einen Hefteintrag herunterladen, den ihr entweder in euer Heft abschreibt oder ausdruckt und einklebt.
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Einstieg/Wiederholung'''</span>
| |
| |Inhalt=
| |
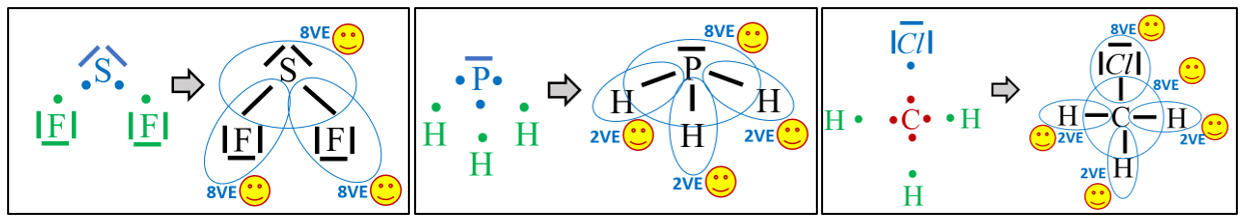
| Versucht im folgenden Bild '''möglichst genau''' zu beschreiben, was die eingekringelten Symbole bedeuten sollen. (In beiden Fällen wird das gleiche symbolisiert, es sind nur unterschiedliche Varianten.) In eurer Beschreibung sollte der Begriff "Elektronegativität (EN)" vorkommen. <br>
| |
| [[Datei:SäBa1_polAtombdg_Darstellung.jpg|400px]]<br>
| |
| Am besten macht ihr das wirklich schriftlich, damit ihr eure Lösung mit dem Lösungsvorschlag nachträglich gut überprüfen könnt!<br>
| |
| <br>
| |
| {{Lösung versteckt|
| |
| Die eingekreisten Symbole stehen für eine "polare Atombindung".<br>
| |
| Beide Begriffe, '''polar '''und '''Atombindung''', sollte man nun erklären. <br>
| |
| Eine '''Atombindung '''entsteht, wenn zwei Atome jeweils ein Elektron zur Verfügung stellen und dieses Elektronenpaar sich zwischen den beiden Atomkernen aufhalten kann und dadurch zu einer Anziehung der beiden Partner führt. <br>
| |
| '''Polar '''sind Atombindungen dann, wenn einer der beiden Bindungspartner in der Lage ist, das bindende Elektronenpaar stärker zu sich zu ziehen. Die beiden Elektronen haben dann eine hohe Aufenthaltswahrscheinlichkeit nicht genau in der Mitte zwischen den Atomkernen sondern bei dem Bindungspartner, der die höhere Elektronegativität (EN) hat. Der Keil, bzw. der Pfeil zeigen diese Verschiebung des Elektronenpaars hin zum elektronegativeren Partner an.
| |
| <br>
| |
| <br>
| |
| Wenn euch diese Begriffe nichts mehr sagen, dann lest jetzt sofort im Buch die Seiten 63 - 64 Mitte!
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Trennung von Atombindungen'''</span>
| |
| |Inhalt=
| |
| Schaut nun das folgende Video (ca. 15min.). Nach dem Video solltet ihr in der Lage sein, die Aufgaben darunter zu lösen!<br>
| |
| {{#ev:youtube|mNEBKOf8T44}}<br>
| |
| <br>
| |
| '''Aufgaben:'''<br>
| |
| * Formuliere eine chemische Gleichung für den Lösungsvorgang von Aluminiumchlorid
| |
| {{Lösung versteckt|
| |
| Ich hoffe, Du hast die richtige chemische Formel für Aluminiumchlorid?
| |
| {{Lösung versteckt|
| |
| * Nur so als Tipp: Aluminium steht in der 3. Hauptgruppe. Welche Ionen bildet es also?
| |
| * Chlor steht in der 7. Hauptgruppe. Bildet also welche Ionen?
| |
| * Was für eine Zusammensetzung muss ein Salz haben, das aus diesen Ionen aufgebaut ist und insgesamt neutral (also nicht geladen) sein soll?
| |
| {{Lösung versteckt|
| |
| * Al --> Al<sup>3+</sup> + 3e<sup>-</sup>
| |
| * Cl + e<sup>-</sup> --> Cl<sup>-</sup>
| |
| * Die chemische Formel für Aluminiumchlorid lautet daher AlCl<sub>3</sub>. Jetzt also bitte die Gleichung für den Lösungsvorgang!
| |
| {{Lösung versteckt|
| |
| [[Datei:AlCl3_gelöst_inWasser.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
| |Hab ich!|Lösung ausblenden}}
| |
| |Sicher!|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Ihr habt im Film die "heterolytische Bindungstrennung" kennengelernt. Erkläre, was dieser Begriff bedeutet. Schriftlich! Mit dem Stift auf ein Blatt, bitte!
| |
| {{Lösung versteckt|
| |
| Liegt in einem Molekül eine polare Atombindung zwischen zwei verschiedenen Atomen vor, dann kann diese Bindung getrennt werden, indem ein Partner beide Bindungselektronen bekommt, der andere gar keins.
| |
| |Lösung|Lösung ausblenden}}
| |
| | |
| Hier noch einmal die heterolytische Bindungstrennung in Form verschiedener chemischer Gleichungen: <br> | |
| [[Datei:SäBa1_heterolytBdgTrennung_Gleichung.jpg|600px]]<br>
| |
| <br> Dieser "Spezialfall" einer heterolytischen Bindungstrennung, bei der ein H<sup>+</sup>-Teilchen abgespalten wird, hat einen eigenen Namen. Nenne den Namen und erkläre seine Herkunft!
| |
| {{Lösung versteckt|
| |
| Protolyse: '''Lyse''' bedeutet hier Abspaltung. '''"Proto..."''' kommt hier von Proton: Ein Wasserstoffatom besteht nur aus einem Proton im Kern und einem Elektron in der Hülle. Wird das Elektron abgegeben, bleibt nur das positiv geladene Proton zurück. Daher "Protolyse": Abspaltung eines Protons
| |
| |Lösung|Lösung ausblenden}}
| |
| | |
| Stelle nach dem gleichen Muster die chemischen Gleichungen (beide Varianten: mit und ohne Valenzstrichformel) für die heterolytische Bindungstrennung für folgende Moleküle auf:<br>
| |
| * Hydrogenfluorid (HF)
| |
| * Iodsäure (HIO<sub>3</sub>)
| |
| * Schwefelsäure (H<sub>2<sub>SO</sub>4</sub>)
| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse.jpg|600px]]<br>
| |
| | |
| | |
| {{Lösung versteckt|
| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse_ML1.jpg|600px]]<br>
| |
| Vielleicht habt ihr bei der Schwefelsäure das andere Proton abgespalten. Das funktioniert. Es können sogar beide Wasserstoff-Teilchen gleichzeitig abgespalten werden. Stellt dafür (sofern ihr es noch nicht getan habt) die Gleichungen (mit und ohne Valenzstrichformeln) auf!
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| | |
| {{Lösung versteckt|
| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse_ML2.jpg|600px]]<br>
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| | |
| Ladet jetzt noch den Hefteintrag herunter, dann seid ihr für heute mit Chemie fertig! Hefteintrag als [[Spezial:FilePath/C9NTG_Heterolyse_Heft.pdf| pdf-Datei]].
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| | |
| | |
| === Distanzunterricht Donnerstag, 04.02.===
| |
| Videokonferenz: Rechnen mit molaren Größen<br>
| |
| * Aufgaben 13 auf AB in Gruppenarbeit
| |
| <br>
| |
| | |
| === Distanzunterricht Dienstag, 02.02.===
| |
| Verbessert gegenseitig eure Hausaufgabe (Buch, S. 42 - Aufgabe 6):
| |
| * Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
| |
| * Besorgt euch einen Rotstift.
| |
| * Macht ein Foto von eurer Hausaufgabe und schickt sie an eure Korrekturpartnerin bzw. euren Korrekturpartner.
| |
| * Druckt dann diese Lösungen, die ihr jetzt erhalten habt, aus. (Wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
| |
| * Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint/Paint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
| |
| * Beachtet dann die unten stehende Musterlösung und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler.
| |
| * Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon).
| |
| * Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
| |
| * Ihr erhaltet ca. um 13:30 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück.
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Lösungsvorschlag für die Hausaufgabe'''</span>
| |
| |Inhalt=
| |
| '''S. 42 Aufgabe 6:'''
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A426_ML_V3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Montag, 01.02.===
| |
| Ihr benötigt euer Buch auf der S. 42. Geht zum Lösen der Aufgabe systematisch vor, wie wir es in den letzten Einheiten immer geübt haben:
| |
| * Überlegt zunächst welche Größe '''gesucht '''ist!
| |
| * Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. N<sub>A</sub> immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u m<sub>a</sub>(X) sich jederzeit aus dem Periodensystem "ablesen" lassen)
| |
| * Wenn ihr eine '''passende Gleichung''' gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um!
| |
| * Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich '''über die chemische Gleichung''' das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B).
| |
| * Klickt erst auf "Lösung, wenn ihr tatsächlich den Tipp umgesetzt habt und etwas auf dem Papier stehen habt"
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Tipps zur Lösung'''</span>
| |
| |Inhalt=
| |
| '''Aufgabe 2:'''<br>
| |
| <br>
| |
| '''Tipp 1:''' Legt fest, welche Größe gesucht ist, welche Größen euch gegeben sind, und stellt die chemische Gleichung auf!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A422_ML_S1.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Findet eine Gleichung, in der die gesuchte Größe vorkommt und löst sie nach dieser Größe auf! Ihr solltet erkennen, dass in dieser Gleichung eine weitere Größe auftaucht, die nicht gegeben ist. Findet auch für diese Größe eine Gleichung und löst sie entsprechend auf!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A422_ML_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 3:''' Ein letztes Problem muss noch gelöst werden. Ihr könntet jetzt schon die Stoffmenge von Aluminium n(Al) ausrechnen, ihr braucht aber die Stoffmenge von n(O<sub>2</sub>). Den Zusammenhang zwischen diesen beiden Größen leitet man aus der chemischen Gleichung ab. Bisher war das immer '''sehr einfach''', bei dieser Gleichung ist es nur '''einfach''': Es funktioniert über '''die Verwendung eines Bruchs'''. Beispiel: Wenn ihr 1000 Kirschen erntet, dann braucht ihr noch 3 Zitronen und daraus kann Oma dann 9 Gläser Kirschmarmelade machen. Daraus lassen sich folgende Verhältnisse ableiten:<br>
| |
| [[Datei:C9NTG_chemR_A422_ML_S3z.jpg]]<br>
| |
| Findet nach genau dem selben Muster nun anhand der chemischen Gleichung einen Zusammenhang zwischen n(Al) und n(O<sub>2</sub>)!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A422_ML_S3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| <br>'''Tipp 4:''' Man kann nun die Stoffmenge von Aluminium ausrechnen ('''2. Gleichung'''), dann in die '''3. Gleichung''' einsetzen, um n(O<sub>2</sub>) auszurechnen und dieses Ergebnis schließlich in '''Gleichung 1''' einsetzen. Voilà! (wie der Franzose sagt... Habt ihr Französisch? - Ich nicht.)
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A422_ML_S4.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Aufgabe 3:'''<br>
| |
| <br>
| |
| '''Tipp 1:''' Legt fest, welche Größe gesucht ist, welche Größen euch gegeben sind, und stellt die chemische Gleichung auf!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S1.jpg]]<br>
| |
| Es sind hier zwei Größen verlangt, also auch zwei Rechnungen. Beginnt zunächst mit der Berechnung von m(NaCl)
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Ihr benötigt wieder eine Gleichung, in der die gesuchte Größe steckt und alle anderen gegeben oder berechenbar sind. Beachtet: Auch wenn die Stoffmenge von dem gesuchten Stoff nicht gegeben ist, kann man über das Stoffmengenverhältnis der chemischen Gleichung immer eine Beziehung herstellen!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 3:''' Eigentlich habt ihr alles, was ihr braucht! Berechnet zunächst n(Na). Über das Stoffmengenverhältnis gelangt ihr zu n(NaCl) und über die erste Gleichung zur gesuchten Masse m(NaCl)<br>
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| <br>'''Tipp 4:''' Zur zweiten gesuchten Größe: Findet eine Formel, in der die gesuchte Größe vorkommt und alle anderen Größen gegeben sind. Beachtet, dass ihr bei den vorangegangenen Rechnungen eine wichtige Größe bereits berechnet habt. Die dürft ihr jetzt natürlich verwenden und müsst sie nicht neu ausrechnen!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A423_ML_S4.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Aufgabe 9:'''<br>
| |
| <br>
| |
| '''Tipp 1:''' Diesmal etwas weniger kleinschrittig: Gesuchte Größe? Gegebene Größen? Chemische Gleichung? Gleichungen?
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A429_ML_S1.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Ausrechnen, Einsetzen, Einsetzen, Ausrechnen!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemR_A429_ML_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| Ich hoffe, die Tipps haben geholfen, die Aufgaben zu lösen. Macht jetzt die '''Aufgabe 6''' ohne Tipps (einer vielleicht: Eisen(III)-chlorid hat die chemische Formel FeCl<sub>3</sub>).<br>
| |
| Schreibt bitte sauber und ordentlich, eure Lösung müsst ihr morgen (Dienstag, 02.02.) einem Partner schicken und korrigieren lassen (ähnlich wie letzte Woche). Eine Musterlösung dazu wird morgen hier erscheinen. Ihr selbst müsst dann wieder die Korrektur überprüfen und von der doppelt korrigierten Version schickt ihr mir ein Foto oder eine pdf-Datei.
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Donnerstag, 28.01.===
| |
| Videokonferenz: Rechnen mit molaren Größen<br>
| |
| * Aufgaben 1, 2 und 7, 8, 9 auf AB bearbeitet
| |
| <br>
| |
| | |
| === Distanzunterricht Dienstag, 26.01.===
| |
| Verbessert gegenseitig eure Hausaufgabe:
| |
| * Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
| |
| * Besorgt euch einen Rotstift!
| |
| * Macht ein Foto von eurer Hausaufgabe (Aufgabe 10 und Aufgabe 12 auf dem AB) und schickt sie an eure Korrekturpartnerin bzw. euren Korrekturpartner!
| |
| * Druckt dann die Lösungen, die ihr jetzt erhalten habt aus (wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
| |
| * Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
| |
| * Geht zunächst auf dieser Seite Schritt für Schritt die Musterlösung durch und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler!
| |
| * Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon)
| |
| * Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
| |
| * Ihr erhaltet um 13:50 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück!
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Verbesserung der Hausaufgabe'''</span>
| |
| |Inhalt=
| |
| '''Aufgabe 10:''' Berechne die Stoffmenge an Schwefeltrioxid, die man benötigt, um mit 100g Wasser vollständig zur Schwefelsäure zu reagieren.<br>
| |
| <br>'''Tipp 1:''' Es geht hier um die Stoffmenge und eine Masse ist gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemRechnen_A10_S1.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Direkt lässt sich die Stoffmenge von Schwefeltrioxid mit dieser Gleichung nicht berechnen. Das geht nur, wenn alle anderen Größen der Gleichung bekannt wären, aber die Masse von Schwefeltrioxid ist unbekannt. Über die chemische Gleichung kann man die Stoffmenge von Schwefeltrioxid jedoch mit der Stoffmenge des Wassers in Beziehung setzen: Wie verhält sich die Stoffmenge (also die Anzahl der Teilchen) von Schwefeltrioxid zu der Stoffmenge (also der Anzahl der Teilchen) von Wasser?
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemRechnen_A10_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 3:''' Die Stoffmenge des Schwefeltrioxids lässt sich also durch die Stoffmenge des Wassers ausdrücken. Und die kann berechnet werden! Denn von Wasser hat man die Masse gegeben. Berechne zunächst die Stoffmenge des Wassers und schließe dann die Aufgabe ab!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemRechnen_A10_S3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Aufgabe 12:''' Im Labor soll Ammoniak aus den Elementen hergestellte werden (also aus H<sub>2</sub> und N<sub>2</sub>). Es gibt noch exakt 22,4L Stickstoff. Welche Stoffmenge an Wasserstoff benötigt man, um den gesamten Stickstoff zu Ammoniak umzusetzen.<br>
| |
| <br>'''Tipp 1:''' Es geht hier um die Stoffmenge. Darüber hinaus ist ein Volumen gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemRechnen_A12_S1.jpg]] | |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 2:''' Direkt lässt sich die Stoffmenge von Wasserstoff mit dieser Gleichung nicht berechnen, es fehlt das Volumen, V(H<sub>2</sub>). Aber wie immer kann über die chemische Gleichung die Stoffmengen der beteiligten Stoffe in Beziehung zueinander setzen. Stelle die chemische Gleichung auf und drücke dann die Stoffmenge des benötigten Wasserstoffs in der Stoffmenge des Stickstoffs aus!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemRechnen_A12_S2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>'''Tipp 3:''' Jetzt kann die Stoffmenge des Stickstoffs ausgerechnet werden und daraus die Stoffmenge des benötigten Wasserstoffs!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_chemRechnen_A12_S3.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| | |
| === Distanzunterricht Montag, 25.01.===
| |
| Videokonferenz: Rechnen mit molaren Größen<br>
| |
| * Bitte Hausaufgabe bereithalten: Ihr solltet die Aufgaben 1 - 4 auf der zweiten Seite dieses Arbeitsblattes bearbeiten: [[Spezial:FilePath/C9NTG_Quanti3_ML.pdf| Hier klicken]]<br>
| |
| * Neuer Unterrichtsstoff: Das molare Volumen (Bereits auf verteiltem Hefteintrag enthalten)
| |
| <br>
| |
| === Distanzunterricht Donnerstag, 21.01.=== | |
| Videokonferenz: Rechnen mit molaren Größen<br>
| |
| <br>
| |
| === Distanzunterricht Dienstag, 19.01.===
| |
| Videokonferenz: Rechnen mit molaren Größen<br>
| |
| <br>
| |
| === Distanzunterricht Montag, 18.01. ===
| |
| In den vorangegangenen Einheiten habt ihr einen historischen Einblick in die Probleme erhalten, die sich beim Arbeiten mit der Masse von Stoffportionen ergeben. Für die weiteren Einheiten sind diese historischen Aspekte erst einmal weniger interessant. Wir wollen in den nächsten Einheiten eher dahin kommen, dass in der Lage seid, z.B. folgende Aufgaben zu lösen:<br>
| |
| <br>
| |
| ''"Ein Auto verbraucht pro hundert gefahrene Kilometer im Durchschnitt 5,0L Benzin. Wie viel Gramm Kohlenstoffdioxid wird auf diesem Weg ausgestoßen."''<br>
| |
| <br>
| |
| Bis dahin müssen jedoch noch einige Dinge geklärt werden und wir fangen heute erst einmal mit kleinen Schritten an. Ihr benötigt für diese Einheit einen Stift, Zettel und euer Buch!<br>
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Wiederholung: Die Bestimmung der absoluten Atommasse'''</span>
| |
| |Inhalt=
| |
| Ihr solltet in der letzten Einheit bemerkt haben, dass die "frühen Chemiker" sehr daran interessiert waren, die Masse von einzelnen Atomen zu bestimmen. Diese Atommasse spielt eine wichtige Rolle bei der Berechnung von Mengeneinheiten, um chemische Reaktionen vollständig durchführen zu können. Nachdem es keine Waage gab, mit der man so kleine Massen bestimmen konnte, behalf man sich mit einer willkürlichen Größe: Die '''atomare Masseneinheit''' '''''u''''' wurde eingeführt. Man wusste zwar nicht, wie viel Gramm ein Teilchen wog, welches 1'''''u''''' schwer war, aber man konnte bestimmen wie viel '''''u''''' z.B. ein Sauerstoffatom und wie viel '''''u''''' ein Wasserstoffatom wog. So konnte man die Atome von unterschiedlichen Elementen vergleichen.<br>
| |
| Mit Hilfe von Massenspektrometern gelang es irgendwann, für die '''atomare Masseneinheit''' '''''u''''' einen Wert in Gramm zu bestimmen, es gilt:<br>
| |
| <br>
| |
| 1u = 1,66 x 10<sup>-24</sup>g <br>
| |
| <br>
| |
| Damit lassen sich nun schon ein paar einfache Aufgaben rechnen. Um zu unterscheiden, ob man von der '''Masse''' eines Teilchens in '''''g''''' oder der '''atomaren Masseneinheit''' in '''''u''''' spricht, gibt es die zwei Variablen '''m(X)''' für die "normale" '''Masse '''und '''m<sub>a</sub>(X)''' für die '''atomare Masseneinheit'''. X steht dabei für die Teilchen, das man betrachtet. Die folgenden Ausdrücke bedeuten dann folgendes:<br>
| |
| <br>
| |
| m(O-Atom) = 2,658 x 10<sup>-23</sup>g.
| |
| {{Lösung versteckt|
| |
| Die Masse eines Sauerstoffatoms beträgt zwei Komma sechs fünf acht mal zehn hoch minus dreiundzwanzig Gramm.
| |
| |spricht man|Lösung ausblenden}}<br>
| |
| <br>
| |
| m<sub>a</sub>(C-Atom) = 12,0u
| |
| {{Lösung versteckt|
| |
| Die Masse eines Kohlenstoffatoms beträgt zwölf Komma Null u.
| |
| |spricht man|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Test''':<br>
| |
| Schreibe als mathematische Gleichung: Misst man die Masse eines Bor-Atoms in atomaren Masseneinheiten, so erhält man 10,811u.
| |
| {{Lösung versteckt|
| |
| [[Datei:ma_Bor.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| Schreibe als mathematische Gleichung: Die Masse eines Sauerstoff-Moleküls (!) beträgt 5,313 x 10<sup>-23</sup> Gramm
| |
| {{Lösung versteckt|
| |
| [[Datei:m_O2.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| Mit Hilfe des oben beschriebenen Zusammenhangs zwischen der '''Masse in ''g''''' und der '''atomaren Masseneinheit in ''u''''' lassen sich die beiden Größen auch leicht ineinander umwandeln: <br>
| |
| <br>
| |
| [[Datei:Umrechnung_ma_m.jpg]]<br>
| |
| <br>
| |
| Berechne die Masse eines Sauerstoffmoleküls in '''''u'''''! (Die Masse in Gramm ist oben bereits angegeben)
| |
| {{Lösung versteckt|
| |
| [[Datei:ma_Ber_O2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| Nachdem ein unbekannter Stoff X im Massenspektrometer untersucht wurde, konnte die Masse eines Teilchens dieses Stoffes auf 4,79 x 10<sup>-22</sup>g bestimmt werden. Rechne diesen Wert in atomare Masseneinheiten um!
| |
| {{Lösung versteckt|
| |
| [[Datei:ma_Ber_StoffX.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| Man sollte meinen, nachdem man jetzt die atomare Masseneinheit auch in Gramm bestimmen kann, ist die Angabe in '''''u''''' doch nicht mehr nötig. Es war doch nur eine Hilfsgröße, solange man das Gewicht von Atomen noch nicht direkt bestimmen konnte. Die Einheit hat sich aber gehalten, denn sie ist (unter anderem) in folgendem Punkt ganz praktisch: Sie lässt sich einfacher schreiben! Nehmt an, ihr habt ein Molekül "XYZ", für das gilt: m<sub>a</sub>(XYZ) = 212,3u und m(XYZ) = 3,5 x 10<sup>-24</sup>g. <br>
| |
| Versucht beide Angaben in einem Word-Dokument zu schreiben! Das geht mit der atomaren Masseneinheit sehr leicht, mit der "normalen" Masse tut man sich deutlich schwerer. Dieses "Zehn hoch irgendwas" ist einfach umständlich.<br>
| |
| <br>
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br><br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Molekül- und Formelmassen'''</span>
| |
| |Inhalt=
| |
| Wenn ihr eure Hausaufgabe gemacht habt und das Buch auf den Seiten 34 - 35 gelesen habt, dann wisst ihr schon, dass man die Masse von Molekülen oder die Formelmasse von Salzen, gemessen in der atomaren Masseneinheit '''''u''''', ganz einfach bestimmen kann, indem man die Masseneinheiten der einzelnen Atome, die am Aufbau des Moleküls oder der Formelmasse beteiligt sind, zusammenzählt. Bsp.: Möchte man die Masse eines Schwefelsäure-Moleküls (H<sub>2</sub>SO<sub>4</sub>) wissen (in '''''u'''''), dann addiert man einfach die Masseneinheiten der am Aufbau beteiligten Atome, also: 2 x m<sub>a</sub>(H) + m<sub>a</sub>(S) + 4 x m<sub>a</sub>(O). <br>
| |
| [[Datei:ma_H2SO4_Berechnung.jpg]]<br>
| |
| <br>
| |
| Das leuchtet vermutlich den meisten ein, aber die große Frage ist doch: Woher weiß man die Werte für die einzelnen Atome? - Sie stehen im Periodensystem! Nehmt das Periodensystem im Buch auf der letzten Seite zur Hand. Ihr erkennt im oberen weißen Feld "Erklärungen", dass die Zahl links oberhalb des Elementsymbols die Atommasse in '''''u''''' angibt.<br>
| |
| Berechnet nun mit Hilfe des PSEs die Molekülmassen (in '''''u''''') von: <br>
| |
| * Adrenalin (ein Hormon, welches euer Körper in stressigen Situationen ausschüttet), chem. Formel: C<sub>9</sub>H<sub>13</sub>NO<sub>3</sub>
| |
| * Koffein (ein Stoff in Kaffee oder Cola, der anregend wirkt), chem. Formel: C<sub>8</sub>H<sub>10</sub>N<sub>4</sub>O<sub>2</sub>
| |
| * Indigo (ein Stoff zum Färben von Jeans), chem. Formel: C<sub>16</sub>H<sub>10</sub>N<sub>2</sub>O<sub>2</sub>
| |
| {{Lösung versteckt|
| |
| Adrenalin C<sub>9</sub>H<sub>13</sub>NO<sub>3</sub>: <br>
| |
| [[Datei:ma_Ber_Adrenalin.jpg]]<br>
| |
| Solltet ihr das nicht richtig haben, dann überprüft genau, wo der Fehler lag und rechnet die anderen beiden Stoffe noch einmal nach!
| |
| {{Lösung versteckt|
| |
| Koffein C<sub>8</sub>H<sub>10</sub>N<sub>4</sub>O<sub>2</sub>: <br>
| |
| Indigo C<sub>16</sub>H<sub>10</sub>N<sub>2</sub>O<sub>2</sub>: <br>
| |
| [[Datei:ma_Ber_KoffeinIndigo.jpg]]<br>
| |
| |Hab ich|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Das Mol'''</span>
| |
| |Inhalt=
| |
| Mit dem nun verfügbaren Atomgewicht könnte man theoretisch schon arbeiten. Betrachten wir noch einmal das Beispiel aus der letzten Einheit. Es ging um die chemische Reaktion: Eisen reagiert mit Schwefel zu Pyrit: <br>
| |
| <br>
| |
| Fe + 2 S --> FeS<sub>2</sub><br>
| |
| <br>
| |
| Diese chemische Gleichung sagt aus, dass man doppelt so viele Schwefel-Atome wie Eisenatome braucht, damit alles miteinander reagiert und nichts übrig bleibt. Angenommen ihr habt einen Teelöffel voll Eisenpulver und wollte exakt die Menge Schwefel dazugeben, die nötig ist, um alles vollständig in Pyrit umzuwandeln. Dann könnte man jetzt die Portion Eisen wiegen, mit Hilfe der Atommasse von Eisen ausrechnen, wie viele Atome das sind. Diese Anzahl verdoppeln und dann ausrechnen, welche Masse diese Anzahl an Schwefelatomen hat. Diese Menge könnte man dann abwiegen. Das folgende Bild veranschaulicht den Rechenweg: <br>
| |
| [[Datei:FeS2BerechnungohneMol.jpg]]<br>
| |
| Das wirkt noch etwas umständlich... <br>
| |
| Bei dieser Berechnung tauchen nämlich wieder sehr große, unhandliche Zahlen auf: Die Anzahl der Teilchen. Diese wird in der Chemie mit einem N(X) gekennzeichnet. Also z.B. kann man den Satz: "In meinem Zimmer liegen 3208 Legosteine auf dem Boden mathematisch so formulieren: <br>
| |
| <br>
| |
| N(Legosteine) = 3208<br>
| |
| <br>
| |
| Weil Atome so klein sind, befinden sich in den 6,0g Eisen einfach unglaublich viele Atome: Die Anzahl beträgt N(Fe) = 6,47 x 10<sup>22</sup>. Eine Zahl mit dreiundzwanzig Stellen (!), in Worten also ungefähr 600 Trilliarden Atome...<br>
| |
| Daher hat man sich etwas einfacheres ausgedacht: Man betrachtet einfach eine sehr große Menge an Teilchen und gibt dieser Anzahl einen bestimmten Namen. Das ist nicht so ungewöhnlich, wie es vielleicht im ersten Moment klingt. Ihr kennt z.B. sicher den Ausdruck "ein Dutzend" für die Anzahl 12. (Wo jetzt genau der Sinn darin liegt zu sagen, "Ich hole beim Bauern ein Dutzend Eier" anstatt "Ich hole beim Bauern zwölf Eier", kann ich euch auch nicht genau sagen. Aber das Phänomen gibt es eben. Fragt mal eure Oma ob sie den Begriff "Schock" noch kennt, für eine Anzahl an z.B. Eiern).<br>
| |
| In der Chemie hat man nun den Begriff '''"Mol"''' eingeführt. Das ist die Bezeichnung für eine bestimmte Anzahl an Teilchen, nämlich 6,022 x 10<sup>23</sup>. Man nennt diesen Wert auch Avogadro-Konstante N<sub>A</sub> = 6,022 x 10<sup>23</sup> '''''1/mol'''''<br>
| |
| <br>
| |
| '''Freiwilliger Test:'''<br>
| |
| * Besorgt euch eine Stoppuhr oder ruft die Funktion auf eurem Handy auf!
| |
| * Stoppt die Zeit, die ihr benötigt, um zehn mal "Sechs Komma null zwei zwei mal zehn hoch dreiundzwanzig" zu sagen!
| |
| * Stoppt die Zeit, die ihr benötigt, um zehn mal "Ein Mol" zu sagen!
| |
| Ergebnis? - Seht ihr, die Einheit "Mol" ist eben praktisch.
| |
| <br>
| |
| Warum jetzt ausgerechnet 6,022 x 10<sup>23</sup>? - Das ist genialer Schachzug der Chemiker gewesen. Diese Zahl wurde deshalb gewählt, weil dann die im PSE angegebene atomare Masseneinheit genau übereinstimmt mit der Masse in '''''g''''', die ein Mol dieser Teilchen wiegt. <br>
| |
| Nochmal langsam, zum mitschreiben: Die Zahl, die oben links bei den Elementsymbolen im PSE steht, gibt also nicht nur die Masse eines Atoms dieses Elements in '''''u''''' an, sondern gleichzeitig entspricht dieser Wert der Masse in '''''g''''' von einem Mol dieser Atome. - Wahnsinn! Diese Chemiker..., das sind vielleicht Teufelskerle!<br>
| |
| Und jetzt wieder ernst: Diese Größe, also die Masse, die ein Mol eines Stoffes in '''''g''''' wiegt, nennt man '''Molare Masse M(X)'''. Ein Beispiel: "Die molare Masse von Wasser, also diejenige Masse in Gramm, die ein Mol Wassermoleküle wiegen, beträgt 18'''''g/mol'''''." oder in Form einer mathematischen Gleichung: M(H<sub>2</sub>O) = 18'''''g/mol'''''.<br>
| |
| Die Variable, um eine Anzahl in Mol zu messen, nennt man '''"Stoffmenge"''', sie wird mit einem kleinen '''n(X)''' gekennzeichnet, die Einheit Mol wird abgekürzt mit '''''mol'''''. Wenn man also sagen möchte: "Ich habe heute 2 Mol Erdbeeren gepflückt, dann kann man das so formulieren: <br>
| |
| n(Erdbeeren) = 2mol (Dieser Wert ist völlig unrealistisch. So viele Erdbeeren gibt es auf der ganzen Welt nicht)<br>
| |
| <br>
| |
| '''Test''':<br>
| |
| Wie spricht man die folgende Gleichung aus: n(Sterne im Universum) = 0,1mol (Dieser Wert stimmt ungefähr)? Wie viele Sterne sind das?
| |
| {{Lösung versteckt|
| |
| * Die Anzahl der Sterne im Universum beträgt Null Komma Ein Mol.
| |
| * Das sind 6,022 x 10<sup>22</sup> oder auch 0,602 x 10<sup>23</sup>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| Schreibe als mathematische Gleichung: In der Sahara gibt es ungefähr Null Komma eins Mol Sandkörner.
| |
| {{Lösung versteckt|
| |
| [[Datei:nSand_gleich_01mol.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| | |
| '''Einfache Aufgaben'''<br>
| |
| * Es liegen 14,007'''''g''''' Stickstoffatome vor. Wie viel Mol sind das?
| |
| * Wie viel Gramm wiegen 2 Mol Kohlenstoffatome?
| |
| * Im Jahr 2018 wurden grob geschätzt 4 x 10<sup>11</sup> Äpfel auf der ganzen Welt geerntet. Wie viel Mol sind das?
| |
| {{Lösung versteckt|
| |
| * Der Wert der angegebenen Masse in g entspricht genau dem Wert, der im PSE links über dem Element steht, also ist das genau die Masse eines Mols Stickstoffatome
| |
| * Die Zahl links oberhalb des Kohlenstoffs im PSE lautet 12,000. Das ist die Masse in g, die ein Mol wiegen würde. Zwei Mol müssen dann das doppelte wiegen, also 24,0g.
| |
| * Als Hilfe: Das ist eine ähnliche Frage, wie man wissen will: "Wie viele Dutzend sind 7 Eier?". Man muss die tatsächliche Anzahl durch diejenige Anzahl teilen, die in einem Dutzende stecken, also 7 geteilt durch 12. Bei dem Beispiel mit den Äpfeln: 4 x 10<sup>11</sup> geteilt durch 6,022 x 10<sup>23</sup>. Ergibt 6,67 x 10<sup>-13</sup>mol.
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Systematische Zusammenfassung'''</span>
| |
| |Inhalt=
| |
| Die einfachen Berechnungen in den oberen Kästen waren mehr so... "freestyle". Viele von euch werden die Aufgaben relativ problemlos lösen können. Manche brauchen aber vielleicht etwas mehr Struktur. Diesen Personen empfehle ich das Buch (S. 35 - 38), die Hefteinträge (s. u.) und ganz knapp zusammengefasst die folgende Übersicht, die die bisher besprochenen Größen und ein paar Gleichungen zum Umrechnen enthält: <br>
| |
| [[Datei:Übersicht_Größen1.jpg]]<br>
| |
| <br>
| |
| '''Hausaufgabe''':
| |
| Auch wenn ihr zu der Gruppe gehört, die glaubt, bereits alles verstanden zu haben, lest ihr bitte als Hausaufgabe im Buch die folgenden Absätze und die Hefteinträge. Die Datei mit den Hefteinträgen haltet ihr bitte morgen Nachmittag bereit (z.B. geöffnet in einem Fenster auf dem PC, an dem ihr arbeitet). Wir machen eine Videokonferenz, besprechen noch einmal alles und lösen dann die in der pdf-Datei enthaltenen Aufgaben!
| |
| * Die Teilchenzahl (S. 36)
| |
| * Die Stoffmenge (S. 36-37)
| |
| * Teilchenzahl und Stoffmenge (S. 37)
| |
| * Teilchenzahl und Masse (S. 37)
| |
| * Molare Masse und molares Volumen (S. 38)
| |
| * Die molare Masse (S. 38)
| |
| * '''Hefteinträge''' zu dieser und letzter Stunde (Punkt 4 wurde noch nicht besprochen): [[Spezial:FilePath/C9_Quanti1_Hefteintrag_inkl_Aufg.pdf| pdf-Datei]]
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Donnerstag, 14.01. ===
| |
| <br>
| |
| Videokonferenz mit Besprechung der Ergebnisse vom Versuch der letzten Einheit.
| |
| | |
| | |
| === Distanzunterricht Dienstag, 12.01. ===
| |
| <br>
| |
| Bitte bearbeitet diese Einheit am besten von 14:00 Uhr bis 14:45 Uhr. Es handelt sich hier um einen kleinen "Versuch". Das Ergebnis eures Versuchs sollt ihr alle in ein einziges Dokument schreiben, damit man eure Ergebnisse vergleichen kann. Dies funktioniert am besten über ein Padlet: Das ist ein Online-Dokument, in das viele Nutzer auch gleichzeitig Sachen eintragen können. Ihr erhalten über den Schulmanager am Dienstag gegen 13:45 Uhr einen Arbeitsauftrag, in dem der Link zu diesem Padlet enthalten ist.<br>
| |
| Sollte der Schulmanager heute nachmittag (Dienstag, 12.01.) immer noch nicht funktionieren, dann erhaltet ihr hier eine .pdf-Datei, in der ein Link zu einer Excel-Tabelle verfügbar ist, in die ihr eure Werte eintragen könnt. Direkt ins Netz möchte ich diesen Link nicht stellen, da hier die Gefahr der unerlaubten Verwendung zu groß ist.
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Wiederholung'''</span>
| |
| |Inhalt=
| |
| Lasst euch das, was wir gestern (Montag) besprochen haben noch einmal kurz durch den Kopf gehen. Ihr könnt dazu auf dieser Seite etwas nach unten scrollen und die Fragen überfliegen, die im letzten Arbeitsauftrag behandelt wurden.<br>
| |
| Wie würdet ihr in höchstens drei Sätzen zusammenfassen, was ihr aus dieser letzten Einheit mitgenommen habt?
| |
| {{Lösung versteckt|
| |
| Möglich wäre z.B.:
| |
| * Ein Schokokuchen ist schon was leckeres...
| |
| * Auf "Vogelhäuschen selber bauen" hätte ich ja gar keinen Bock. Da kauf ich lieber eins.
| |
| * Eine Tonne Äpfel auf einem Anhänger??? Auf den Anhänger von meinem Onkel passen 16 Tonnen!
| |
| <br>
| |
| O.k., das könnten zwar auch Dinge gewesen sein, die euch durch den Kopf gegangen sind, aber jetzt mal in Bezug auf Chemie!
| |
| {{Lösung versteckt|
| |
| Möglich wäre z.B.:
| |
| * In chemischen Gleichungen spielt die '''Anzahl von Teilchen''' (Atomen, Molekülen, Salzeinheiten) eine Rolle
| |
| * Leider kann man solche Teilchen aber '''nicht abzählen'''
| |
| * Man müsste '''die Masse''' von diesen Teilchen wissen, damit man etwas damit anfangen kann
| |
| |Lösung|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Ihr sollt heute einen kleinen Versuch durchführen, mit dem man die Masse von kleinen Teilchen ziemlich genau bestimmen kann, auch wenn man sie nicht direkt wiegt. Mit einzelnen Atomen oder Molekülen könnt ihr natürlich nicht arbeiten, daher nehmen wir andere "kleine Teilchen". Ihr benötigt also:
| |
| * '''Entweder '''Reiskörner '''oder '''trockene Erbsen '''oder '''trockene Linsen '''oder''' sonst irgendetwas kleines (Reißnägel, Büroklammern etc.)
| |
| * Eine Küchenwaage
| |
| * Geduld
| |
| <br>
| |
| Die Objekte, die ihr euch aussucht, sollten so klein (und leicht) sein, dass eine Küchenwaage '''"nichts"''' anzeigt, wenn man '''eins''' dieser Objekte darauf legt. Zählt jetzt so viele Teilchen ab (z.B. 100, evtl. aber auch 1000), dass eure Küchenwaage einen "vernünftigen Wert" anzeigt, ich würde empfehlen so um die 10 Gramm.<br>
| |
| Ihr könnt auch umgekehrt vorgehen: Wiegt exakt 10,0g ab und bestimmt dann die in dieser Menge enthaltene Anzahl an Objekten.<br>
| |
| Berechnet aus diesen beiden Werten (Anzahl und Gewicht) das '''Gewicht eines Teilchens'''. Recherchiert dann im Internet ob ihr einen Wert findet, der euer Ergebnis bestätigt (oder auch widerlegt). Wenn ihr Pflanzenteile genommen habt, dann werdet ihr wahrscheinlich sehr schnell auf Wikipedia fündig. Als Suchtipp kann ich euch auch den Begriff "Tausendkornmasse" empfehlen.<br>
| |
| Tragt euer Ergebnis in das Padlet ein. Den Link findet ihr im Arbeitsauftrag des Schulmanagers! <br>
| |
| Sollte der Schulmanager heute nachmittag (Dienstag, 12.01.) immer noch nicht funktionieren, dann erhaltet ihr hier eine .pdf-Datei, in der ein Link zu einer Excel-Tabelle verfügbar ist, in die ihr eure Werte eintragen könnt. Direkt ins Netz möchte ich diesen Link nicht stellen, da hier die Gefahr der unerlaubten Verwendung zu groß ist.
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| | |
| === Arbeitsauftrag für Montag, 11.01. ===
| |
| Bitte bearbeitet von 09:45 Uhr bis 10:10 Uhr die folgenden Aufgaben. Ihr benötigt dazu euer Schulbuch! Um 10:15 Uhr starten wir eine Konferenz, um die gestellten Aufgaben zu verbessern! (Den Link für die Konferenz habt ihr per Schulmanager bekommen)
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Einleitende Gedanken'''</span>
| |
| |Inhalt= | |
| Nehmt an, ihr sei bei Freunden zum Geburtstag eingeladen und es gibt Kuchen (ich gebe zu, in Zeiten von "Corona" kein sehr praxisnahes Beispiel...). Der Kuchen schmeckt sehr lecker und ihr wollt ihn "nachmachen". Dann fragt ihr vermutlich nach dem '''Rezept '''(oder ihr recherchiert im Internet).<br>
| |
| Anderes Beispiel: Nehmt an, ihr seht beim Spazierengehen in einem Garten ein sehr schönes Vogelhäuschen, in dem viele verschiedene Vogelarten gerade fressen. Ihr wollt dieses Vogelhäuschen '''nachbauen '''und recherchiert im Internet nach der '''Bauanleitung'''.<br>
| |
| Worin unterscheiden sich die Bauanleitung für das Vogelhäuschen von dem Rezept für einen Kuchen?
| |
| {{Lösung versteckt|
| |
| * Beim Kuchenrezept sind die Angaben für die Zutaten in der Regel in Gramm (also einer Gewichtseinheit) angegeben.
| |
| * Bei der Bauanleitung werden eher Stückzahlen genannt.
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Wie schaut das bei chemischen Reaktionen aus? Eine '''chemische Gleichung''' ist im Prinzip ja auch eine '''"Anleitung"''', an die man sich halten kann, wenn man einen bestimmten Stoff herstellen will. Nehmt an, ihr wollt FeS<sub>2</sub> (Pyrit) herstellen. Ihr findet im Internet dazu die folgende '''chemische Gleichung''': <br>
| |
| <br>
| |
| Fe + 2 S --> FeS<sub>2</sub><br>
| |
| <br>
| |
| Was bedeutet das genau? Sprich diese '''chemische Gleichung''' in einem schönen, deutschen Satz aus! Beachte, dass auch der vorkommende Koeffizient (die Zahl '''2''' vor dem S) in Deinem Satz vorkommt!
| |
| {{Lösung versteckt|
| |
| Es gibt hier mehrere Möglichkeiten, z.B.: "Ein Eisenatom reagiert mit zwei Schwefelatomen zu einem Pyrit-Teilchen"
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Bitte übt dieses "Übersetzen" noch ein paar Mal mit diesen Gleichungen:<br>
| |
| <br>
| |
| * 2 H<sub>2</sub> + O<sub>2</sub> --> 2 H<sub>2</sub>O<br>
| |
| <br>
| |
| * 4 Al + 3 O<sub>2</sub> --> 2 Al<sub>2</sub>O<sub>3</sub> (Aluminiumoxid)<br>
| |
| <br>
| |
| * 2 H<sub>2</sub>O<sub>2</sub> (Wasserstoffperoxid) --> 2 H<sub>2</sub>O + O<sub>2</sub><br>
| |
| <br>
| |
| {{Lösung versteckt|
| |
| * Zwei Wasserstoffmoleküle reagieren mit einem Sauerstoffmolekül zu zwei Wasser-Molekülen.
| |
| * Vier Aluminiumatome reagieren mit drei Sauerstoffmolekülen zu zwei Aluminiumoxid-Einheiten. (Aluminiumoxid ist ein Salz, d. h. ganz viele pos. geladene Kationen und ganz viele neg. geladene Anionen finden sich zu einem riesigen Gitter zusammen, ein "einzelnes Al<sub>2</sub>O<sub>3</sub>-Teilchen" gibt es nicht.
| |
| * Zwei Wasserstoffperoxid-Moleküle zerfallen zu zwei Wassermolekülen und einem Sauerstoffmolekül.
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Man sieht, bei chemischen Gleichungen wird eher so vorgegangen, wie bei der Bauanleitung für Vogelhäuschen: Es geht hier um die '''Anzahl '''bestimmter Teilchen. Leider nützt einem das im Labor nichts! Nehmen wir wieder die erste Gleichung:
| |
| <br>
| |
| Fe + 2 S --> FeS<sub>2</sub><br>
| |
| <br>
| |
| Sie besagt also, dass man pro Eisenatom zwei Schwefelatome verwenden muss, um eine vollständige Reaktion zu Pyrit zu erhalten. Wenn man "mehr" Pyrit haben will, kann man auch 1000 Eisenatome verwenden, dann braucht man eben 2000 Schwefelatome. Reicht das immer noch nicht, kann man auch 80 Quadrillionen Eisenatome nehmen, dann muss man die eben mit 160 Quadrillionen Schwefelatomen reagieren lassen. So weit so gut, aber warum nützen einem diese Überlegungen nichts? <br>
| |
| {{Lösung versteckt|
| |
| Weil man keine Möglichkeit hat, im Labor Atome (oder Moleküle oder andere Teilchen) '''abzuzählen'''!
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Nehmt an, ihr habt ein "Häufchen Eisenpulver", welches ihr mit Schwefel komplett zu Pyrit umwandeln wollt. Die '''Anzahl '''der Eisenatom in dem Häufchen könnt ihr also nicht abzählen, aber welche Größe lässt sich im Labor oder auch zu Hause sehr leicht bestimmen?
| |
| <br>
| |
| {{Lösung versteckt|
| |
| Das Gewicht oder besser: '''Die Masse'''!
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| O.k., man kann das Häufchen Eisenpulver also auf die Waage legen und z.B. feststellen, es wiegt 3,0g. Das ist zwar einfach, nützt einem aber wieder nicht viel! Damit ich mit Hilfe der chemischen Gleichung abschätzen kann, wie viel Schwefel ich für die Reaktion brauche, muss ich wissen, wie viele Eisenatome in diesen 3,0g drin sind! Welche Größe würde dieses Problem lösen?
| |
| {{Lösung versteckt|
| |
| Habt ihr wirklich schon eine Lösung gefunden? Vielleicht noch ein einfacheres Beispiel: Ein Landwirt lädt im Herbst alle Äpfel seiner Streuobstwiese auf den Anhänger seines Traktors. Alle Äpfel zusammen wiegen genau eine Tonne (1000kg). Er möchte wissen, wie viele Äpfel das ungefähr sind. Welche Größe braucht er für diese Berechnung?
| |
| <br>
| |
| {{Lösung versteckt|
| |
| Die Masse eines Apfels! - Oder im ersten Beispiel: Die Masse eines Eisenatoms.
| |
| |Lösung|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| Früher gab es keine Möglichkeit die Masse eines einzelnen Eisenatoms zu bestimmen. Heute geht das. Man verwendet dazu Massenspektrographen. In eurem Buch ist ein solches Gerät schematisch abgebildet. Nehmt euer Buch zur Hand auf S. 34. Betrachtet zunächst die Abbildungen 1 und 2, lest dann den Abschnitt "Wie vergleicht und ermittelt man Atommassen?" ganz unten auf der Seite 34. Lest wirklich nur diesen Absatz, nicht das was vorher steht und auch nicht, was danach kommt!<br>
| |
| Beschreibt nun laut mit Worten die Abbildungen!
| |
| <br>
| |
| Wenn ihr das getan habt, solltet ihr euch für die Videokonferenz vorbereiten! Ruft über den Link im Schulmanager den BBB-Raum auf und loggt euch ein. Sollte es noch deutlich vor 10:10 Uhr, dürft ihr euch gerne erst einen Kaffee holen (oder was man als Neuntklässer eben so trinkt zum Frühstück...). Bis gleich!
| |
| <br>
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| | |
| ==Distanzlernen vor Weihnachten==
| |
| | |
| === Arbeitsauftrag für Donnerstag, 17.12. ===
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Ein (freiwilliger) Versuch'''</span>
| |
| |Inhalt=
| |
| Mit der einen Gruppe von euch habe ich bereits nach der Schulaufgabe einen kurzen Versuch durchgeführt, der zeigen konnte, dass es Farbstoffe gibt, die ihre Farbe ändern, wenn sie mit Säuren in Berührung kommen. Unser nächstes Thema im Unterricht wird sich genau um diese '''Säuren '''und ihre "Gegenspieler" die '''Basen''' drehen. Farbstoffe, die auf Säuren oder Basen reagieren, nennt man '''Säure-Base-Indikatoren'''. Davon findet man auch viele in der Natur und dazu ein kleiner Versuch.
| |
| <br>
| |
| <br>
| |
| Ihr benötigt:
| |
| * Blaukraut/Rotkohl (frisch oder aus der Konserve)
| |
| * Zitronensaft
| |
| * Natron oder Kernseife
| |
| <br>
| |
| Zupft ein paar Blätter vom Rotkohl ab, schneidet sie sehr klein und gebt die Schnipsel in ein Glas mit Wasser. Wartet 5 min.<br>
| |
| Solltet ihr keinen frischen Rotkohl zu Hause haben, dann könnt ihr auch den Saft aus einem Glas eingemachten Rotkohl nehmen. Bitte sprecht aber mit euren Eltern ab, dass das geöffnete Glas dann auch gegessen wird. Falls ihr weder frischen Rotkohl noch welchen im Glas zu Hause habt, dann verschiebt den Versuch bitte!
| |
| [[Datei:SäBa4_Indikator_Blaukraut_V.jpg|800px]]<br>
| |
| Verteilt den so erzeugten violetten "Blaukraut-Saft" auf drei Gläser und verdünnt ihn mit Wasser. Gebt zum einen Glas Zitronensaft, zum anderen Natron oder Kernseife. Vergleicht die drei Gläser! Ihr könnt gerne auch andere Stoffe aus dem Haushalt ausprobieren und checken, welche Farbe der Blaukrautsaft annimmt.
| |
| | |
| {{Lösung versteckt|
| |
| [[Datei:SäBa4_Indikator_Blaukraut_E.jpg|800px]]<br>
| |
| |Ergebnis|Lösung ausblenden}}
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| ==Termine== | | ==Termine== |
| {{Box-spezial | | {{Box-spezial |