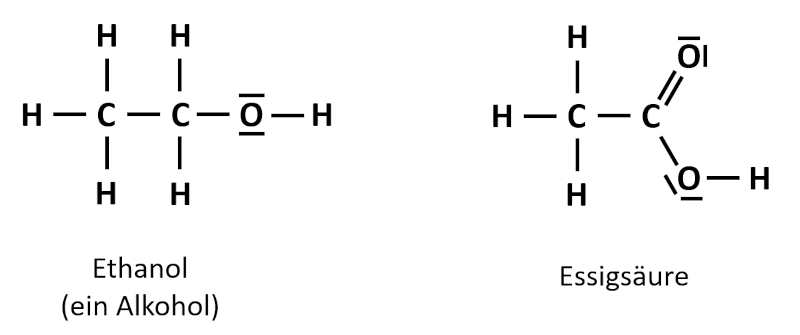Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
(weiter) Markierung: Quelltext-Bearbeitung 2017 |
(Sozialverhalten gelöscht und auf eigene Unterseite gezogen) Markierung: Quelltext-Bearbeitung 2017 |
||
| (214 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
== | |||
====<span style="color:#00A">'''Arbeitsaufträge vom 17.03., zu bearbeiten bis 20.03.'''</span>==== | |||
* Macht eine Pause – holt euch einen Kaffee (o.ä.)! | |||
</div> | |||
<br> | |||
<div style="border: 1px solid #080; background-color:#080; font-size:1px; height:8px; border-bottom:1px solid #080"></div> | |||
<div style="border: 1px solid #080; padding:7px; background-color:#CFC; padding:0.3em" "> | |||
===<span style="color:#080">'''Lösungsvorschläge'''</span>=== | |||
====<span style="color:#080">Für die Arbeitsaufträge vom 17.03.</span>==== | |||
{{versteckt| | |||
}} | |||
</div> | |||
<br><br> | |||
===<span style="color:#507">'''Corona-Sonderregeln Q11'''</span>=== | |||
Die folgenden Regeln bezogen sich auf die Situation der Q11 im Schuljahr 2020/2021. | |||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel= | ||
|Inhalt= | |Inhalt= | ||
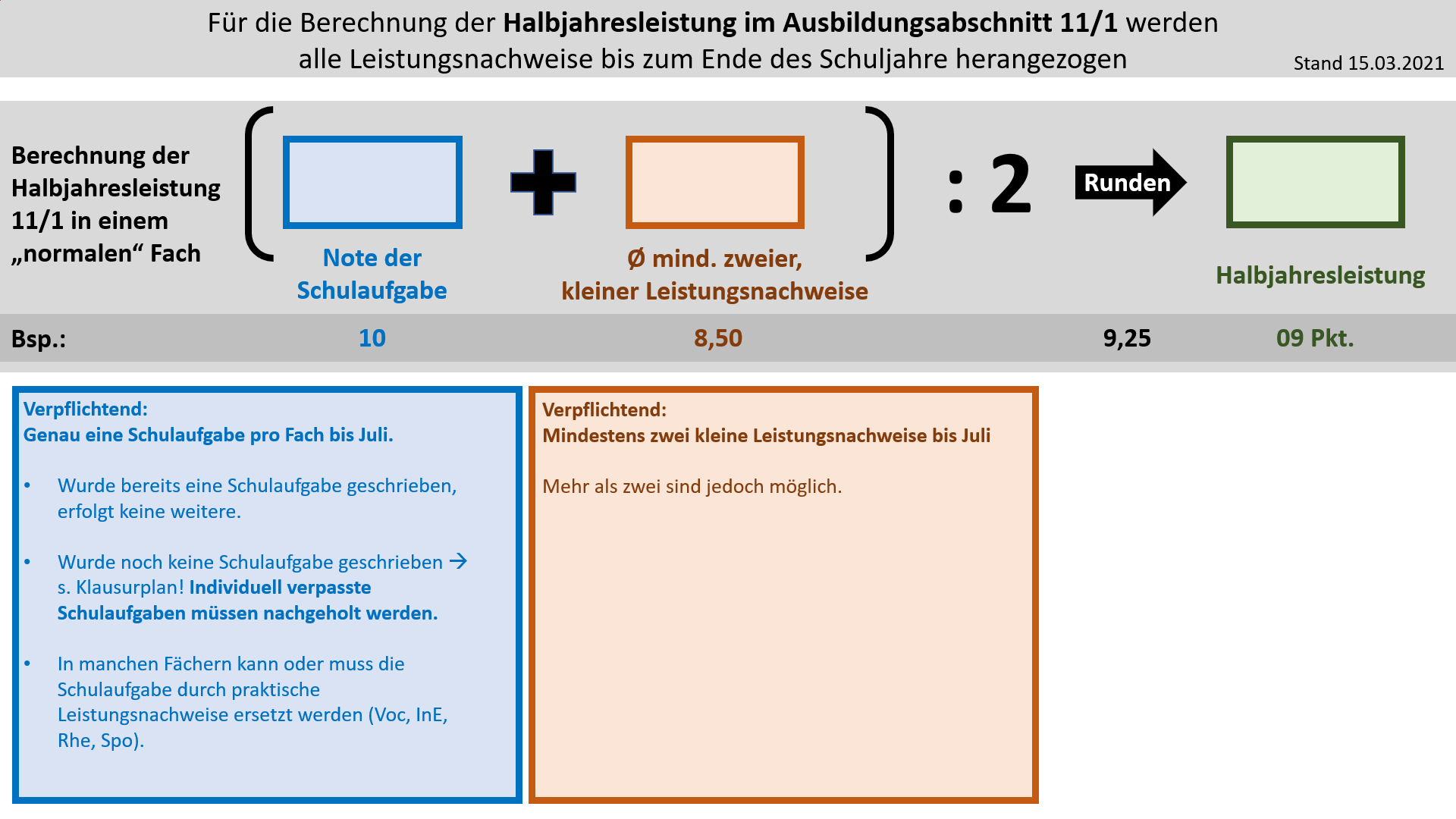
'''Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/1''' | |||
{{Lösung versteckt| | |||
[[Datei: | [[Datei:Cor_ab1503_HJL111.jpg]] | ||
|Anzeigen|Verbergen}} | |||
[[Datei: | <br> | ||
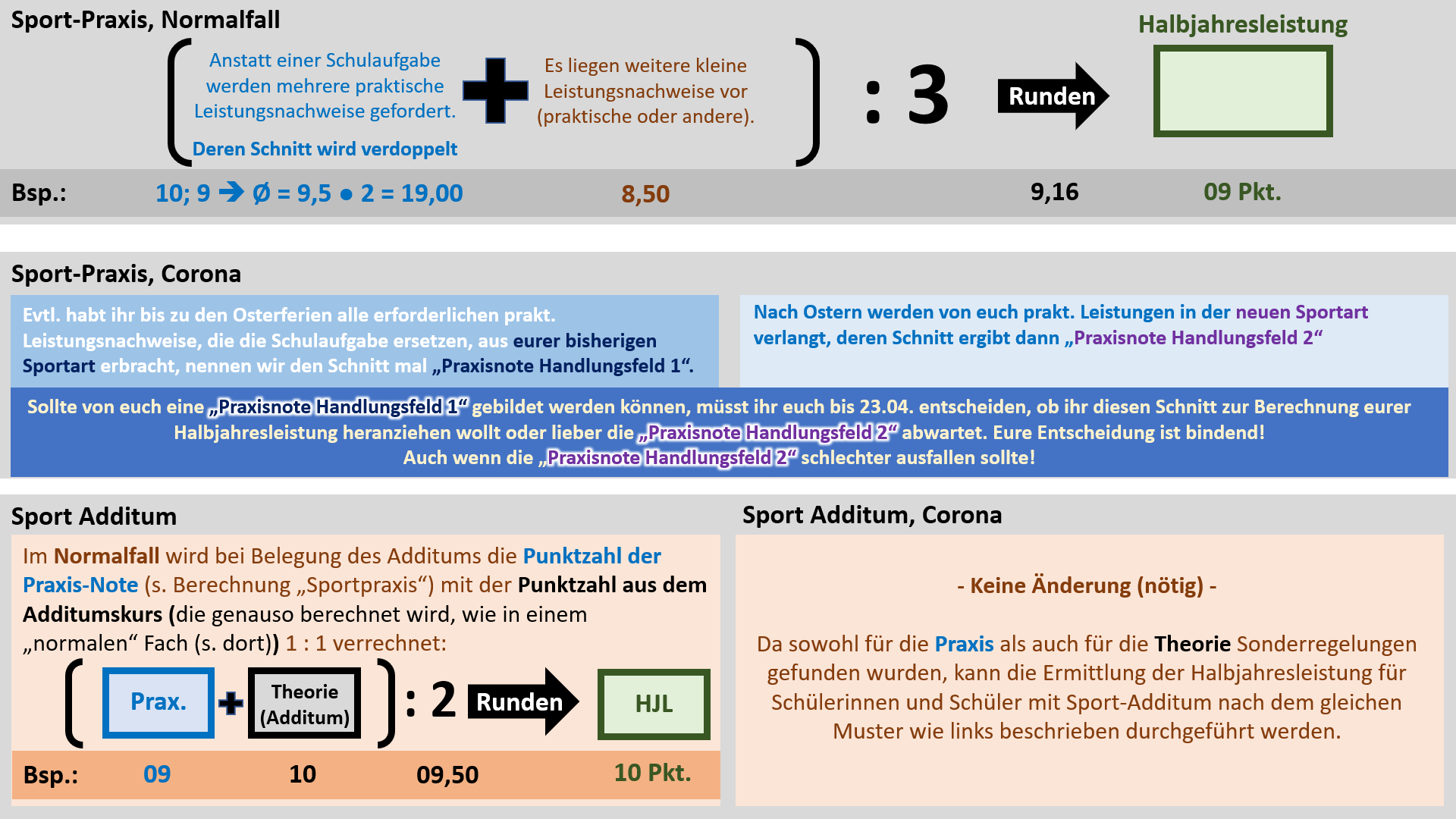
'''Regelungen für Sport''' | |||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_Sport_V2.jpg]]<br> | |||
'''Achtung, Termin geändert: Die Abgabe der Erklärung, welche großen praktischen Leistungsnachweise zählen sollen ist erst bis 18.05. erforderlich!''' | |||
<br> | |||
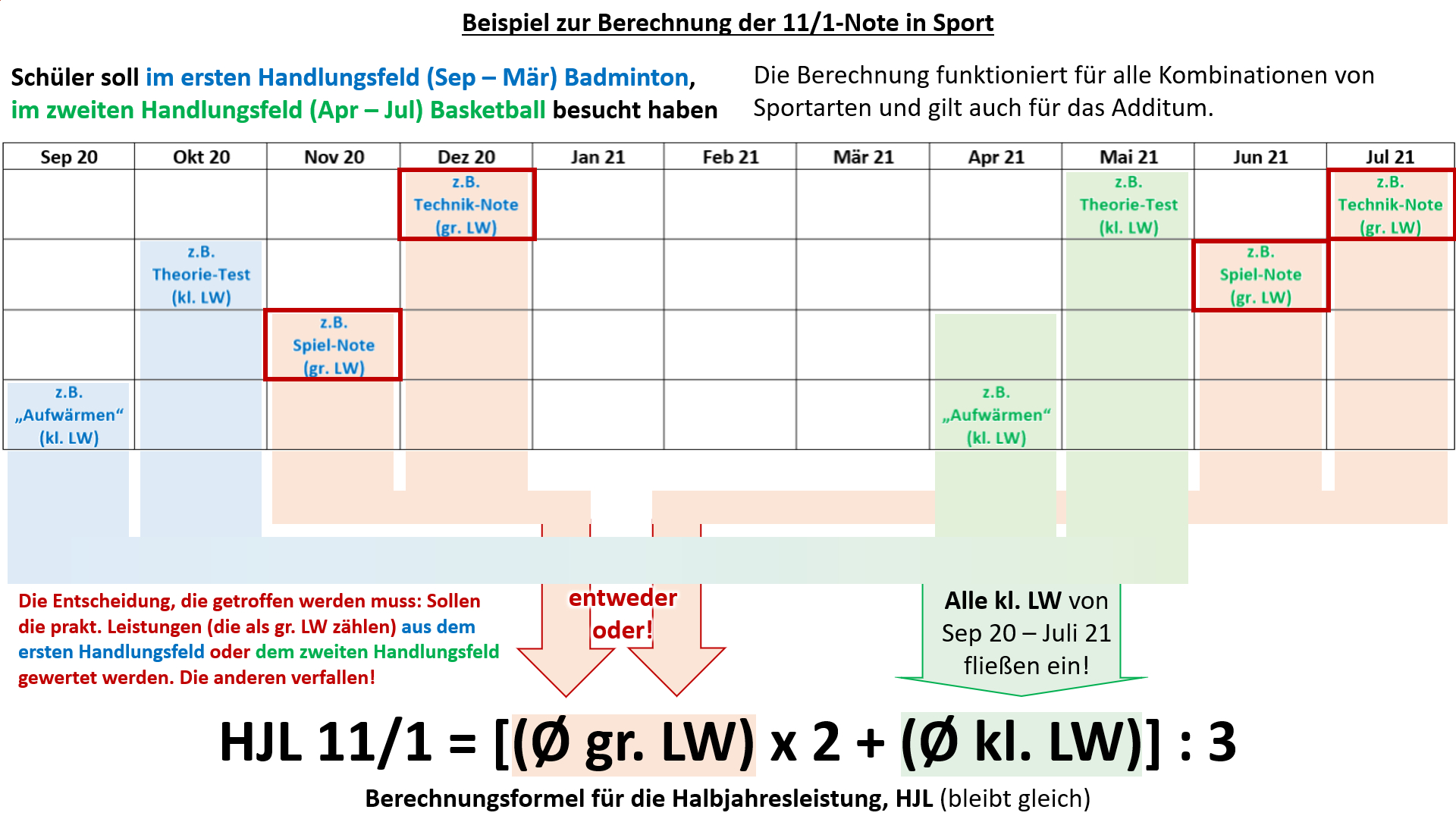
Hier noch einmal ein Beispiel, welches anhand der verschiedenen Leistungsnachweise im gesamten Schuljahr verdeutlichen soll, welche Wahl getroffen werden muss.<br> | |||
<br> | |||
[[Datei:Cor_ab1503_Sport_BspSJ.jpg]]<br> | |||
<br> | <br> | ||
Hinweis zur Logik, die hinter diesem Verfahren stecken soll: In allen anderen Fächern wird nur '''eine Schulaufgabe''' ('''großer Leistungsnachweis''') geschrieben. Entweder sie wurde bereits vor dem 15. März geschrieben oder sie wird erst noch geschrieben. In Sport liegt ein Sonderfall vor: Anstatt '''Schulaufgaben '''werden manche '''prakt. Leistungsnachweise''' als '''große Leistungsnachweise''' gewertet. Nachdem ab April die Sportart wechselt und dann auch wieder '''prakt. Leistungsnachweise''' absolviert werden, würden in Sport quasi '''"zwei Schulaufgaben"''' im ganzen Semester 11/1 vorliegen. Damit das nicht eintritt, muss entschieden werden, welche '''"Schulaufgabe"''', bzw. die '''prakt. Leistungsnachweise aus welchem Handlungsfeld''', gewertet werden sollen. Die kleinen Leistungsnachweise werden immer alle gewertet. Damit wird die Notensituation in Sport den anderen Fächern angeglichen.<br> | |||
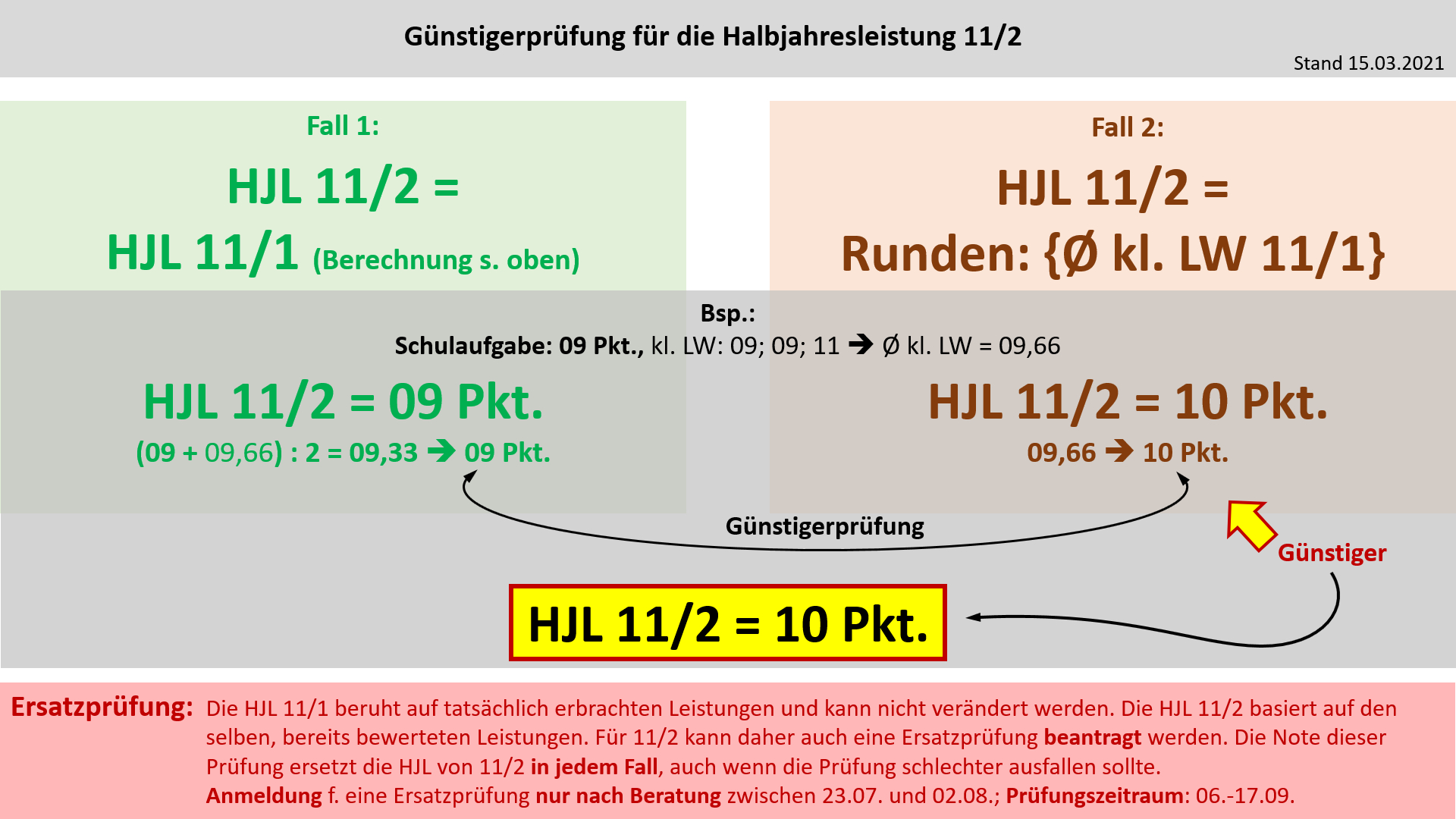
Ergänzung zur Notenbildung in 11/2: Für die Halbjahresleistung in 11/2 werden die selben Noten herangezogen, aus denen auch schon die Halbjahresleistung für 11/1 errechnet wurde. Ein häufiges Missverständnis ist, dass manche Noten zu 11/1 und manche zu 11/2 zählen würden. Dem ist nicht so. Es gibt keine 11/2-Noten! Alle Leistungsnachweise zählen zu 11/1!<br> | |||
|Anzeigen|Verbergen}} | |||
<br> | <br> | ||
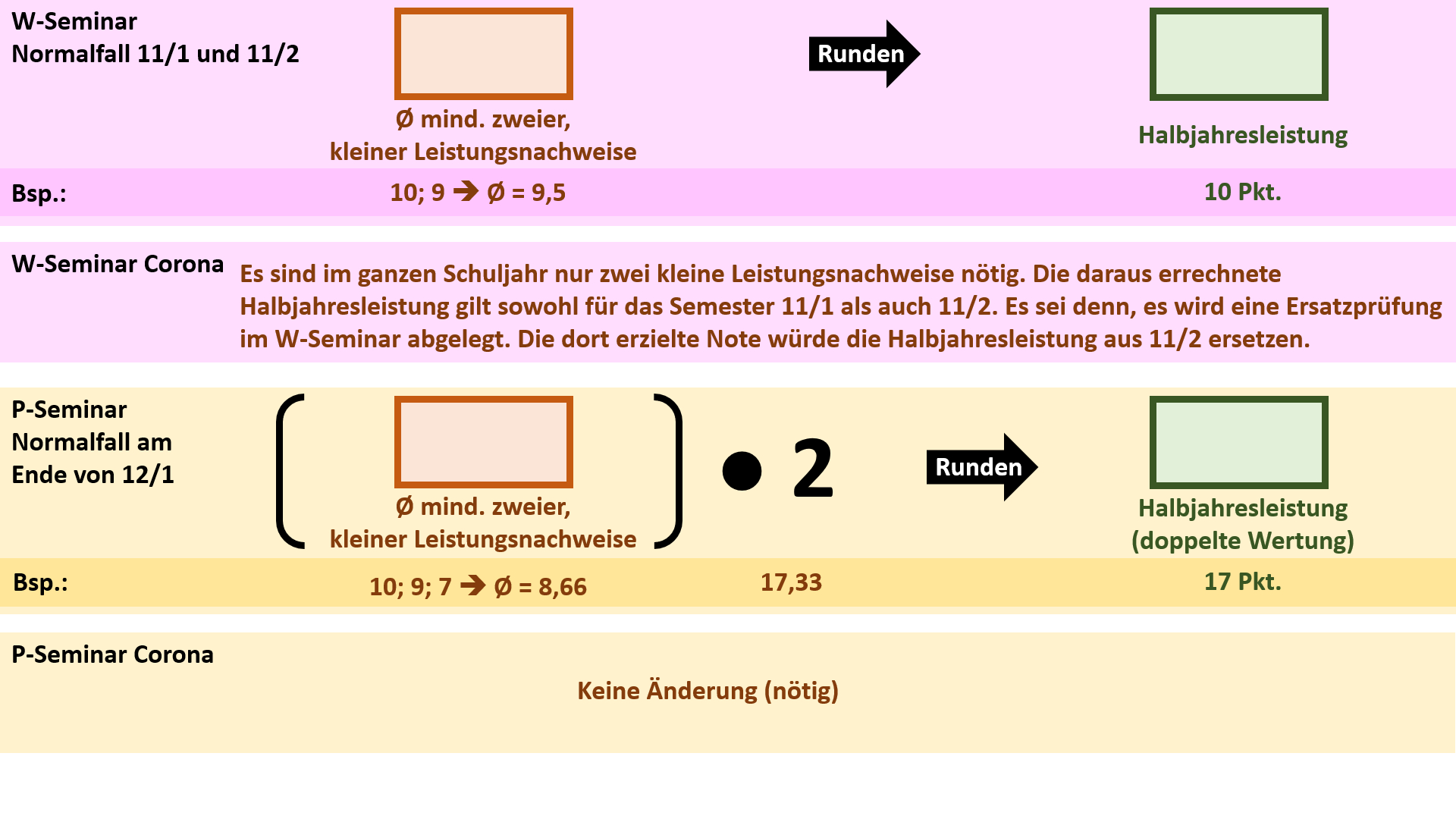
'''Regelungen für die Seminare''' | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Cor_ab1503_Seminare.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
| | '''Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/2''' | ||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_HJL112.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | <br> | ||
'''Zeitplan''' | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Cor_ab1503_Zeitplan_V2.jpg]]<br> | |||
| | '''Achtung, Termin geändert: Die Abgabe der Erklärung, welche großen praktischen Leistungsnachweise zählen sollen ist bis 18.05. erforderlich gewesen!''' | ||
<br> | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
|Farbe= #507 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #EDE | |||
|Hintergrund= #EDE | |||
}} | |||
=== Chemie: chemische Reaktionsgleichungen aufstellen === | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Nr. 1''': Ammoniak reagiert mit Sauerstoff zu Stickstoffmonooxid und Wasser.</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O | |||
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | ||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Ammoniak + Sauerstoff --> Stickstoffmonooxid + Wasser | |||
* | |||
{{Lösung versteckt| | |||
* Ammoniak (Trivialname, muss man auswendig wissen): '''NH<sub>3</sub>''' | |||
* Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' | |||
* Stickstoffmonooxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''NO''' | |||
* Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* NH<sub>3</sub> + O<sub>2</sub> --> NO + H<sub>2</sub>O | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
'''4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O''' | |||
|Lösung|Lösung ausblenden}} | |Ausgleichen|Lösung ausblenden}} | ||
| | |Chemische Formeln aufstellen|Lösung ausblenden}} | ||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Ammoniak''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Stickstoff- und drei Wasserstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= #080 | |||
|Farbe= # | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Nr. 2''': Benzol (C<sub>6</sub>H<sub>6</sub>) verbrennt (reagiert mit Sauerstoff) zu Kohlenstoffdioxid und Wasser</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | |||
2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | <br> | ||
'''oder Schritt für Schritt:''' | |||
<br> | <br> | ||
{{Lösung versteckt| | |||
Benzol + Sauerstoff --> Kohlenstoffdioxid + Wasser | |||
{{Lösung versteckt| | |||
* Benzol (Trivialname, müsst ihr aktuell noch nocht wissen, daher ist chem. Formel angegeben): '''C<sub>6</sub>H<sub>6</sub>''' | |||
* Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' | |||
< | * Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' | ||
* Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* C<sub>6</sub>H<sub>6</sub> + O<sub>2</sub> --> CO<sub>2</sub> + H<sub>2</sub>O | |||
< | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
'''2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O''' | |||
|Lösung|Lösung ausblenden}} | |Ausgleichen|Lösung ausblenden}} | ||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Kohlenstoffdioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Kohlenstoff- und zwei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 117: | Zeile 143: | ||
|Hintergrund= #DFB | |Hintergrund= #DFB | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Nr. 3''': Phosphortribromid und Wasser reagieren zu Diphosphortrioxid und Wasserstoffbromid.</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | |||
2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | <br> | ||
{{Lösung versteckt| | |||
Phosphortribromid + Wasser --> Diphosphortrioxid + Wasserstoffbromid | |||
{{Lösung versteckt| | |||
* Phosphortribromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''PBr<sub>3</sub>''' | |||
* Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* Diphosphortrioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''P<sub>2</sub>O<sub>3</sub>''' | |||
* Wasserstoffbromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''HBr''' | |||
* PBr<sub>3</sub> + H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + HBr | |||
{{Lösung versteckt| | |||
'''2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Disphosphortrioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus zwei Phosphor- und drei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 132: | Zeile 181: | ||
|Hintergrund= #DFB | |Hintergrund= #DFB | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">'''Nr. a)''' Aluminium und Chlor reagieren zu Aluminiumchlorid</span> | ||
|Inhalt= | |Inhalt= | ||
* | {{Lösung versteckt| | ||
* | 2 Al + 3 Cl<sub>2</sub> --> 2 Al<sub>2</sub>O<sub>3</sub> | ||
* | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | ||
<br> | |||
'''oder Schritt für Schritt:''' | |||
|Farbe= # | <br> | ||
{{Lösung versteckt| | |||
Aluminium + Chlor --> Aluminiumchlorid | |||
{{Lösung versteckt| | |||
* Aluminium (Element, nicht Bestandteil von HONClBrIF): '''Al''' | |||
* Chlor (Element, Bestandteil von HONClBrIF): '''Cl<sub>2</sub>''' | |||
* Aluminiumchlorid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** Chlor steht in der 7. Hauptgruppe --> bildet in Salzen immer 1fach negativ geladene Anionen: Cl<sup>-</sup> | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei Cl<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''AlCl<sub>3</sub>''' | |||
* Al + Cl<sub>2</sub> --> AlCl<sub>3</sub> | |||
{{Lösung versteckt| | |||
'''2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub>''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Aluminiumchlorid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 1fach negativ geladenen Chlorid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #007 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= #DFF | |Rahmenfarbe= #DFF | ||
|Hintergrund= #DFF | |Hintergrund= #DFF | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">'''Nr. d)''' Zink(II)-oxid reagiert mit Kohlenstoff zu Zink und Kohlenstoffdioxid</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | |||
2 ZnO + C --> 2 Zn + CO<sub>2</sub> | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Zink(II)-oxid + Kohlenstoff --> Zink + Kohlenstoffdioxid | |||
{{Lösung versteckt| | |||
* Zink(II)-oxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Zink steht in einer Nebengruppe. Welche Ionen Zink bildet ist daher nicht ganz klar. Die römische Zahl in der runden Klammer gibt aber die Ladung des Zink-Kations im Salz an: 2fach positiv --> Zn<sup>2+</sup> | |||
** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup> | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, muss pro Zn<sup>2+</sup>-Ion ein O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''ZnO''' | |||
* Kohlenstoff (Element, kein Bestandteil von HONClBrIF): '''C''' | |||
* Zink (Element, kein Bestandteil von HONClBrIF): '''Zn''' | |||
* Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' | |||
* ZnO + C --> Zn + CO<sub>2</sub> | |||
{{Lösung versteckt| | |||
'''2 ZnO + C --> 2 Zn + CO<sub>2</sub>''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Zinkoxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 2fach positiv geladenen Zink-Kationen und 2fach negativ geladenen Oxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= # | |||
|Farbe= #007 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">'''Nr. f)''' Aluminiumhydroxid reagiert zu Aluminiumoxid und Wasser</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | |||
2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Aluminiumhydroxid --> Aluminiumoxid + Wasser | |||
{{Lösung versteckt| | |||
* Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** "Hydroxid" ist ein feststehender Begriff für das Molekül-Ion OH<sup>-</sup>. | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei OH<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al(OH)<sub>3</sub>''' | |||
* Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup>. | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro zwei Al<sup>3+</sup>-Ionen drei O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al<sub>2</sub>O<sub>3</sub>''' | |||
* Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Aluminiumhydroxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 2fach negativ geladenen Hydroxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= # | |||
|Farbe= #007 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
=== Distanzunterricht Di, 11.05.=== | |||
Da ich heute (Di, 11.05.) und morgen (Mi, 12.05.) aufgrund des Abiturs stark in organisatorische Aufgaben an der Schule eingebunden bin, müsst ihr an diesen beiden Tagen leider alleine klar kommen. Vergesst aber auf keinen Fall am Dienstag bis spätestens 08:15 Uhr eure Rückmeldung auf den "Start-in-den-Tag"-Auftrag im Schulmanager!<br> | |||
<br> | <br> | ||
Ihr erhaltet hier '''drei Arbeitsaufträge''' für die '''drei Chemie-Unterrichtsstunden'''. Ich empfehle euch, jeden Arbeitsauftrag in der Zeit zu erledigen, die angegeben ist. Wenn ihr unbedingt eine andere Reihenfolge wählen wollt: Von mir aus. Für zwei Arbeitsaufträge erhaltet ihr auch im Schulmanager einen Auftrag, auf den ihr bitte eure entsprechend passende Lösung hochladet: | |||
* Dienstag, 1. Std. (08:00 - 08:45 Uhr): Knobelaufgaben auf S. 132 lösen - '''Abgabe eines Lösungsvorschlags im Schulmanager erforderlich'''! | |||
* Dienstag, 2. Std. (08:45 - 09:30 Uhr): Abschließende Rätsel zum gesamten bislang behandelten Stoff in org. Chemie | |||
* Mittwoch, 2. Std. (09:45 - 10:30 Uhr): Versuch "CO<sub>2</sub>-Löscher" durchführen und Aufgaben dazu bearbeiten - '''Abgabe eines Lösungsvorschlags im Schulmanager erforderlich'''! Achtung: Die Aufgaben lassen sich auch lösen, wenn man den Versuch nicht durchgeführt hat (z.B. weil ihr kein Backpulver, keinen Essig oder kein Teelicht zu Hause hattet)! | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">Versuch: '''Knobelaufgaben (Säuren und Ester)'''</span> | ||
|Inhalt= | |Inhalt= | ||
* | Löst in eurem Buch auf der Seite 132 die folgenden Aufgaben: | ||
* | * Nr. 1 | ||
* | * Nr. 2 | ||
* Nr. 3: Der Begriff "Disproportionierung" ist z.B. hier erklärt: [https://de.wikipedia.org/wiki/Disproportionierung Wikipedia] | |||
* Nr. 4 | |||
* Nr. 7: Evtl. hilft hier der folgende verlinkte Abschnitt: [https://de.wikipedia.org/wiki/Schweiß#Zusammensetzung_und_Eigenschaften_des_menschlichen_Schweißes Wikipedia]. Nur den verlinkten Abschnitt, nicht die ganze Seite lesen (also natürlich dürft ihr das, aber ihr müsst es nicht) | |||
* Nr. 8: '''Eisessig''' ist eine weitere Bezeichnung für '''reine Essigsäure'''. Diese hat einen Schmelzpunkt von 17°C. Bewahrt man Eisessig daher im Kühlschrank auf, liegt ein (kalter) Feststoff vor. | |||
<br> | |||
Versucht alle Lösungen auf ein Blatt zu bekommen --> Foto davon machen --> auf entsprechenden Arbeitsauftrag im Schulmanager hochladen! | |||
|Farbe= #007 | |||
|Farbe= # | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
== | {{Box-spezial | ||
|Titel=<span style="color:#007">'''Rätsel zum bisher behandelten Stoff'''</span> | |||
|Inhalt= | |||
[ | Der folgende Link leitet euch auf eine Seite unseres "alten RMG-Wikis". Dort habe ich vor Jahren eine "Grundwissens-Seite" angelegt. Ich bin noch nicht dazu gekommen, sie ins neue Wiki umzuziehen. | ||
* Zum einen zeigt euch die Seite kompakt, was ihr in diesem Schuljahr alles schon gelernt habt (bzw. haben solltet) ;) | |||
* Darüber hinaus sind einige einfachen Rätsel enthalten. Natürlich könnt ihr euch in einigen Fällen auch nur schnell die Lösung anzeigen lassen und danach sagen "Klar, hätte ich gewusst." Ich empfehle euch aber, euren Lösungsvorschlag zunächst wirklich aufzuschreiben und dann auf den Lösungsbutton zu klicken (sofern einer vorhanden ist). Erst dann könnt ihr euch wirklich sicher sein, dass ihr die korrekte Lösung gewusst hättet. | |||
* Hier geht´s zur Grundwissens-Seite: [http://rmg.zum.de/wiki/Grundwissen_Chemie:_10._Klasse_NTG Hier klicken] | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">Versuch: '''CO<sub>2</sub>-Löscher'''</span> | ||
|Inhalt= | |Inhalt= | ||
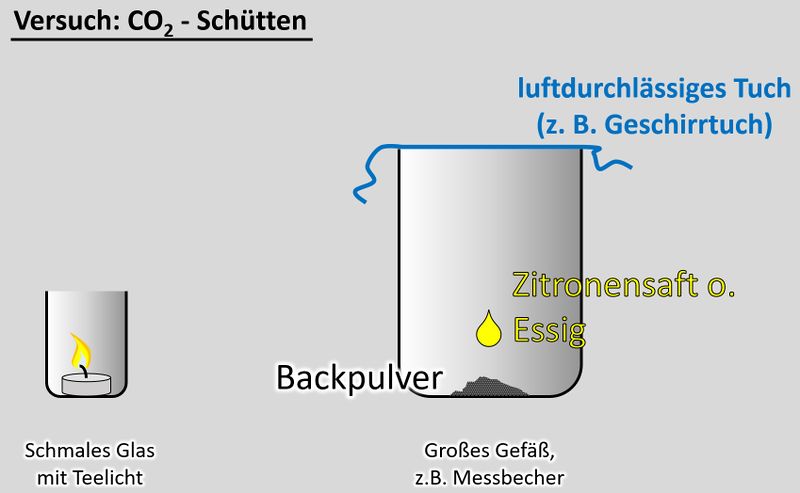
'''Ihr benötigt:''' | |||
* | * ein schmales Glas, in das gerade so ein Teelicht passt | ||
* | * ein Teelicht | ||
* | * ein größeres Gefäß, z.B. Messbecher | ||
* ein Geschirrtuch (o.ä.) | |||
* ein Päckchen Backpulver | |||
* Essig oder besser: Essigessenz | |||
<br> | <br> | ||
'''Durchführung''':<br> | |||
[[Datei:CO2Schütten_V.jpg|800px]]<br> | |||
* | * Entzündet das Teelicht im schmalen Glas | ||
* ''' | * Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit | ||
* Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden. | |||
* Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann). | |||
* Zieht nun '''vorsichtig '''das Geschirrtuch ab. Gießt nun das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen! | |||
<br> | <br> | ||
Eine | '''Beobachtung/Erklärung''':<br> | ||
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie das Ergebnis aussehen könnte. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:CO2Schütten_V1.gif]] | |||
| | |Video|Lösung ausblenden}} | ||
<br> | |||
Einen Teilprozess bei der Reaktion von Zitronensäure mit dem Hauptbestandteil des Backpulvers, Natriumhydrogencarbonat, kann man vereinfacht so formulieren: <br> | |||
<br> | |||
NaHCO<sub>3</sub> + H<sub>3</sub>O<sup>+</sup> --> CO<sub>2</sub> + 2 H<sub>2</sub>O + Na<sup>+</sup><br> | |||
<br> | |||
'''Aufgaben''' | |||
* Begründe unter Angabe von Oxidationszahlen, ob es sich bei diesem Vorgang um eine Redoxreaktion handelt! | |||
* Um die Oxidationszahlen in diesen Fällen zu bestimmen ist es zwar nicht nötig, die Valenzstrichformeln dieser Stoffe zu betrachten, trotzdem: Zeichne die Valenzstrichformel von NaHCO<sub>3</sub>, H<sub>3</sub>O<sup>+</sup>, CO<sub>2</sub> und 2 H<sub>2</sub>O | |||
* Falls es sich Deiner Meinung nach nicht um einen Redoxprozess handeln sollte, gib an, welcher Gruppe von chemischen Reaktionen man diesen Vorgang dann zuordnen könnte | |||
* Nimm zu dem folgenden Satz begründet Stellung: "In diesem Versuch tauchen C-Atome auf, also handelt es sich um organische Chemie" | |||
<br> | <br> | ||
|Farbe= # | Die vier Antworten passen locker auf ein Blatt --> Foto davon machen --> auf entsprechenden Arbeitsauftrag im Schulmanager hochladen! | ||
|Farbe= #007 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
=== Distanzunterricht Di, 11.05. === | |||
Ihr dürft heute zwischen zwei Versuchen wählen, die ihr durchführen sollt. Selbstverständlich dürft ihr auch beide machen, aber verpflichtend ist nur einer: | |||
* Den Versuch '''CO<sub>2</sub>-Löscher''' hattet ihr schon vor Weihnachten mal auf, damals aber freiwillig. Wenn ihr ihn damals nicht gemacht habt: Auf geht´s :). <br> Am Ende des Versuchs ist eine Aufgabe gestellt, die ihr bitte bearbeitet und als Antwort auf den Arbeitsauftrag im Schulmanager schickt. | |||
* Der Versuch '''Apfel oxidieren''' ist neu. Hier sollt ihr am Ende keine Aufgabe bearbeiten, sondern es geht darum, den Versuch in Form eines "wissenschaftlichen Versuchsprotokolls" möglichst sachlich zu dokumentieren. Denkt immer daran: Ein Versuchsprotokoll besteht aus den Teilen '''"Versuchsaufbau/Durchführung"''' (hier wird beschrieben, was man getan hat), '''"Ergebnisse"''' (hier dokumentiert man in Wort und Bild die Ergebnisse des Versuchs - ohne dafür schon eine "Erklärung" zu geben) und '''"Erklärung/Diskussion"''' (hier versucht man unter anderem, die Ergebnisse zu erklären). | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">'''CO<sub>2</sub>-Löscher'''</span> | ||
|Inhalt= | |Inhalt= | ||
''' | '''Ihr benötigt:''' | ||
''' | * ein schmales Glas, in das gerade so ein Teelicht passt | ||
* ein Teelicht | |||
* | * ein größeres Gefäß, z.B. Messbecher | ||
* | * ein Geschirrtuch (o.ä.) | ||
* | * ein Päckchen Backpulver | ||
* Essig oder besser: Essigessenz | |||
<br> | |||
'''Durchführung''':<br> | |||
[[Datei:CO2Schütten_V.jpg|800px]]<br> | |||
* Entzündet das Teelicht im schmalen Glas | |||
* Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit | |||
* Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden. | |||
* Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann). | |||
* Zieht nun '''vorsichtig '''das Geschirrtuch ab. Gießt nun das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen! | |||
<br> | <br> | ||
'''Beobachtung/Erklärung''':<br> | |||
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie das Ergebnis aussehen könnte. | |||
{{ | {{Lösung versteckt| | ||
[[Datei:CO2Schütten_V1.gif]] | |||
| | |Video|Lösung ausblenden}} | ||
[[Datei: | |||
<br> | <br> | ||
Einen Teilprozess bei der Reaktion von Zitronensäure mit dem Hauptbestandteil des Backpulvers, Natriumhydrogencarbonat, kann man vereinfacht so formulieren: <br> | |||
<br> | <br> | ||
NaHCO<sub>3</sub> + H<sub>3</sub>O<sup>+</sup> --> CO<sub>2</sub> + 2 H<sub>2</sub>O + Na<sup>+</sup><br> | |||
<br> | <br> | ||
<br> | <br> | ||
'''Aufgabe:'''<br> | |||
Begründet unter Angabe von Oxidationszahlen, ob es sich bei diesem Vorgang um eine Redoxreaktion handelt! <br> | |||
Lösungsvorschlag auf Blatt --> Foto machen --> Als Antwort auf Arbeitsauftrag im SM hochladen! | |||
|Farbe= # | |Farbe= #007 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Apfel oxidieren'''</span> | ||
|Inhalt= | |Inhalt= | ||
'''Material:'''<br> | |||
Ihr benötigt: | |||
* Einen Apfel | |||
* Zitronensaft (frisch oder auch nicht) | |||
* Eine Reibe oder ein Messer | |||
* etwas Geduld... | |||
<br> | <br> | ||
'''Durchführung:''' | |||
* Stellt Zitronensaft bereit (evtl. Zitrone auspressen). | |||
* Raspelt auf einer Reibe einen Apfel in kleine Stücke. Solltet ihr keine Raspel haben, dann schneidet den Apfel anders in so kleine Stücke wie möglich. | |||
* Verteilt die Apfelstücke auf zwei Untertassen. Das sind die beiden Ansätze, die ihr später miteinander vergleichen sollt. | |||
* Tropft auf den einen Ansatz Zitronensaft (nicht alles, ihr benötigt später den Saft noch einmal). | |||
* Stellt beide Ansätze für einige Minuten (20-30min) beiseite und vergleicht die Ansätze dann. | |||
<br> | <br> | ||
'''Dokumentation:''' | |||
Bei | Ich nehme an, ihr wisst was passiert: Die Apfelmasse wird braun. Dokumentiert euer Ergebnis, so gut ihr könnt! Achtet auf die Kriterien, die wir bereits besprochen haben: | ||
* Bei Fotos sollten keine Gegenstände des Hintergrundes zu sehen sein! | |||
* Wenn ihr keine Kamera habt, die für Nahaufnahmen geeignet ist, versucht es doch mit einer Skizze (tatsächlich mit Stift und Blatt oder auch am PC)! | |||
* Bilder brauchen dringend eine aussagekräftige Abbildungsbeschriftung! | |||
<br> | <br> | ||
'''Erklärung:''' | |||
* Recherchiert, woher die Braunfärbung kommt. Eine Seite im Internet, die relativ kurz und dabei verständlich ist, gibt es z.B. hier: [https://www.wochenblatt.com/natur-warum-wird-der-apfel-braun-12475358.html#:~:text=Zu%20viel%20frische%20Luft&text=Sauerstoff%20aus%20der%20Luft%20gelangt,Apfels%20bewirkt%20sie%20eine%20Braunfärbung. Zur Homepage] - Wenn sich die Seite öffnet, erscheint in der Regel zunächst ein Fenster, in dem "Privatsphäre-Informationen" angezeigt werden. Klickt auf "Einstellungen verwalten" unten links. Deaktiviert alle grünen Haken die bei "Legitimes Interesse" stehen (sollten 9 Stück sein). Ich bin mir ziemlich sicher: '''NIEMAND''' hat ein '''legitimes Interesse''' daran, eure Aktionen im Internet zu verfolgen! | |||
* Versucht die auf der Seite beschriebenen Zusammenhänge '''zeichnerisch''' darzustellen! - Im Text ist zum Beispiel von Chinonen die Rede. Deren chemische Formel wisst ihr zwar nicht, aber ihr könnt ja ein Symbol verwenden, z.B. eine geometrische Figur wie ein Sechseck. Vielleicht schafft ihr es auf diese Weise sogar so etwas ähnliches wie eine Redoxgleichung darzustellen (natürlich ohne Koeffizienten oder Indizes). | |||
* Auf der Seite steht, dass man die Braunfärbung von Äpfeln auch nachträglich mit Zitronensaft wieder aufheben kann. Probiert das! | |||
<br><br> | |||
Fertigt nun ein richtiges Versuchsprotokoll mit den einleitend beschriebenen Teilen (Durchführung, Ergebnisse, Erklärung) an. Es sollte alles auf eine Seite passen! --> Foto machen --> Als Antwort auf Arbeitsauftrag im Schulmanager hochladen | |||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 301: | Zeile 481: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
=== Distanzunterricht Donnerstag, 20.05., 8.Std.=== | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Oberflächenspannung des Wassers'''</span> | ||
|Inhalt= | |Inhalt= | ||
Zum Abschluss vor den Ferien ein Versuch zum Thema Wasser, den ihr sicher schon mal selbst ausprobiert habt: Lasst eine Büroklammer auf dem Wasser schwimmen!<br> | |||
<br> | |||
<br> | <br> | ||
'''benötigtes Material'''<br> | |||
* kleines Glas | |||
* Büroklammern | |||
* Wasser | |||
* Spülmittel | |||
'''Durchführung'''<br> | |||
* Verwendet ein kleines Glas, das ihr randvoll mit Wasser macht. | |||
* Legt eine Büroklammer auf den Glasrand und schiebt sie vorsichtig auf die Wasseroberfläche. | |||
* Die Büroklammer muss absolut trocken und fettfrei sein. | |||
* Mache ein Foto, bei dem mindestens drei Büroklammern auf der Wasseroberfläche schwimmen! | |||
* Gebt auf euren Finger einen Tropfen Spülmittel | |||
* Bringt den Tropfen auf die Wasseroberfläche mit der Büroklammern. Nicht direkt auf eine Büroklammer, sondern nur in die Nähe. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:C9NTG_Wasser_Oberflächenspannung.jpg]]<br> | |||
Diese Foto wäre nicht gültig, weil eine von den drei Büroklammern bereits untergegangen ist... | |||
|Beispiel|Lösung ausblenden}} | |||
'''Theorie'''<br> | |||
* Warum die Büroklammer schwimmt, wenn man sie vorsichtig auf die Wasseroberfläche legt ist in eurem Buch auf der S. 87, 2. Absatz in Verbindung mit der Abb. 6 erklärt! | |||
* Versucht andere kleine Gegenstände, die normalerweise untergehen, auf der Wasseroberfläche schwimmen zu lassen! | |||
* Warum hat es keinen Sinn diesen Versuch mit Öl anstatt mit Wasser durchzuführen? | |||
<br><br> | |||
'''Schöne Ferien euch allen!''' | |||
<br> | <br> | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 333: | Zeile 518: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
=== Distanzunterricht Dienstag, 18.05.=== | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#080"> | |Titel=<span style="color:#080">'''Fotosynthese'''</span> | ||
|Inhalt= | |Inhalt= | ||
In der letzten Biologie-Einheit ging es um den Umweltfaktor '''Temperatur'''. Ihr habt "Tiergeographische Regeln" kennengelernt, die einen Zusammenhang zwischen der Temperatur im Lebensraum und Körpermerkmalen bei Tieren herstellt. Bitte ladet euch den entsprechenden Hefteintrag dazu herunter, speichert ihn oder druckt ihn aus und klebt ihn ins Heft oder schreibt ihn einfach ab.<br> | |||
* | Heute soll es um einen anderen Umweltfaktor gehen: '''Licht'''. Auch Tiere werden teilweise sehr stark vom Licht beeinflusst, bevor wir dazu kommen, betrachten wir aber Pflanzen. Für sie ist die regelmäßige Versorgung mit Licht überlebensnotwendig.<br> | ||
* | Ihr habt sicherlich in eurer Schullaufbahn schon einmal die '''Fotosynthese''' besprochen, also den Prozess, bei dem Pflanzen mit Hilfe von Sonnenlicht die Stoffe Kohlenstoffdioxid und Wasser in Traubenzucker und Sauerstoff umwandeln. <br> | ||
Das folgende Video ist ziemlich alt. Die darin enthaltenen Versuche jedoch unschlagbar gut in Szene gesetzt. Schüler eines W-Seminars wollten mit mir diese Versuche schon einmal nachmachen und filmen, aber wir sind schlimm gescheitert. Umso größer ist die Anerkennung für die "Macher" des Videos.<br> | |||
Das Video zeigt nacheinander vier Versuche und dauert insgesamt ca. 18 Minuten. Stoppt das Video nach jeder Versuchseinheit und notiert euch: | |||
{{ | * Wie könnte eine "Überschrift" für den Versuch heißen? | ||
* Stellt den '''Versuchsaufbau''' grafisch dar (keinen Text, sondern nur einfache Skizzen). | |||
* Notiert in einem Satz das Ergebnis des Versuchs. | |||
* ''Zeitbedarf:'' Pro Versuch solltet ihr ca. 5 Minuten für die Bearbeitung der Aufgaben brauchen, im "schlimmsten" Fall also 20 Minuten. Mit Anschauen insgesamt 38 Minuten - müsste zu schaffen sein! :)<br> | |||
<br> | |||
{{#ev:youtube|J9KwbIdNXo0}} | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 361: | Zeile 544: | ||
<br> | <br> | ||
== | === Distanzunterricht Dienstag, 18.05. === | ||
Heute mal was kreatives! Aber schon auch eine fachliche Vorbereitung auf das letzte Kapitel in diesem Schuljahr: '''Biomoleküle'''.<br> | |||
< | In diesem letzten Kapitel sollt ihr vieles, was ihr über '''organische Verbindungen''' bisher gelernt habt auf Moleküle übertragen, die für Lebewesen eine wichtige Rolle spielen. Tatsächlich solltet ihr in '''Biologie '''über diese Moleküle bereits gesprochen haben. Und genau aus diesem Grund bekommt ihr jetzt auch diese Aufgabe gestellt: Verarbeitet euer bereits vorhandenes Wissen über die '''Kohlenhydrate''', '''Fette '''und '''Eiweiße '''zu einem ästhetisch anspruchsvollen, '''wissenschaftlichen Poster'''!<br> | ||
Wissenschaftliche Poster sind zu einem beliebten Mittel geworden, um kleinere (aber auch größere) Forschungsarbeiten übersichtlich und anschaulich zu präsentieren. Wenn ihr euch genauer über "wissenschaftliche Poster" informieren wollt, dann könnt ihr z.B. folgenden Links folgen: | |||
* Die Studienwerkstatt der Uni-Bremen hat ein pdf-Dokument mit etlichen Tipps zusammengestellt: [https://www.uni-bremen.de/fileadmin/user_upload/sites/studierwerkstatt/Leitfaden_wissenschaftliche_Poster_erstellen.pdf Hier klicken] | |||
* In dem pdf-Dokument sind auch zwei Seiten verlinkt, auf denen man bereits fertige wissenschaftliche Plakate anschauen kann: [https://www.geo.uni-halle.de/geooekologie/pr/poster/ Zum Beispiel hier] oder [https://projects.ncsu.edu/project/posters/ExamplePosters.html hier] | |||
* So ein richtig wahnsinnig schönes yt-Video habe ich auf die Schnelle leider nicht gefunden. Ihr könnt natürlich "wissenschaftliches Poster" bei Google oder Youtube eingeben und ihr werdet tausende von Treffern erhalten, aber die ersten fünf, die ich mir angeschaut habe, hatten alle irgendwelche Haken. | |||
Hier | <br> | ||
''' | <br> | ||
'''Ein paar einfache Tipps''': | |||
* Verwendet ein '''Präsentationsprogramm''', um ein Poster zu erstellen. Hier lassen sich Texte, Bilder, Grafiken etc. am einfachsten anordnen und formatieren. | |||
* '''Hochformat '''ist günstiger (Entwurf --> Foliengröße --> Benutzerdefinierte Foliengröße --> "4:3" und "Hochformat" auswählen) | |||
* Geht sparsam mit grellen '''Farben''' und/oder Kontrasten um. Bleibt am besten in einer "Farbfamilie". | |||
* Poster werden in der Regel relativ groß ausgedruckt (DIN A2, A1 oder sogar A0), daher könnt ihr auch sehr kleine '''Schriftgröße''' (10pt) verwenden. Diese sind immer noch gut lesbar. '''ABER ACHTUNG:''' | |||
* '''Niemand '''will ein Poster lesen, das Gigatonnen an '''Text''' enthält! Versucht eure fachlichen Inhalte gut zu '''veranschaulichen'''. | |||
<br> | |||
<br> | |||
'''Inhalt''': | |||
* Als Ausgangspunkt könnt ihr eure '''Biologie-Schulbuch''' verwenden (S. 18, 19) | |||
* Ihr könnt natürlich auch im Internet recherchieren. | |||
* Bleibt inhaltlich aber bei dem, was ihr schon gelernt (inzwischen aber vielleicht wieder vergessen) habt. | |||
* Zum Veranschaulichen eurer Inhalte könnt ihr selbst Fotos machen (z.B. von Nahrungsmitteln), selbst Symbole erstellen (ähnlich wie die Abbildungen auf S. 18 im Bio-Schulbuch) oder auch Grafiken aus dem Netz verwenden (z.B. Gehalt von ungesättigten Fettsäuren in verschiedenen Ölsorten) | |||
<br> | <br> | ||
Das folgende Plakat wurde mit PowerPoint erstellt und enthält keinerlei sinnvollen Inhalt. Es geht lediglich darum, zu zeigen, wie eine grundsätzliche Aufteilung aussehen könnte:<br> | |||
<br> | <br> | ||
[[Datei:C10NTG_PosterVorschlag.jpg|800px]]<br> | |||
<br> | <br> | ||
Verwendet nicht mehr als 90min. für diesen Arbeitsauftrag! Man kann sicher deutlich mehr Zeit investieren, um immer mehr Details zu erzeugen, aber ihr sollt auch lernen, mit der Ressource Zeit effektiv umzugehen. Ich empfehle daher zunächst das Plakat in Grundzügen zu entwerfen und je nach zur Verfügung stehender Zeit nach und nach Aspekte zu vertiefen, zu verfeinern oder optisch aufzuhübschen. Beim "linearen Arbeiten" (das heißt: Ich fange oben auf dem Plakat an und mache alles sofort super genau und super schön) kann es leicht passieren, dass die zur Verfügung stehende Zeit aufgebraucht ist und das Plakat aber noch lange nicht fertig wird. Das sollte nicht bessern.<br> | |||
Speichert die Präsentation als pdf-Datei ab und schickt sie mir als Antwort auf den Arbeitsauftrag im Schulmanager. Wir hören uns morgen (Mittwoch, 19.05.) in einer Videokonferenz. | |||
=== Distanzunterricht Montag, 17.05. === | |||
Heute ein paar anspruchsvollere Aufgaben zum Thema Redoxgleichungen. Notiert eure Lösungen bitte auf einem Blockblatt, wir besprechen alles am Donnerstag in der 6. Std.<br> | |||
'''Achtung:''' Bei sämtlichen hier besprochen Prozessen werden immer nur Teile der chemischen Gesamtgleichung betrachtet. Das vollständige Aufstellen einer Redoxgleichung, so dass auf beiden Seiten des Reaktionspfeils tatsächlich die gleiche Anzahl von Teilchen steht, erfordert etwas Geschick und wird erst nach den Pfingstferien besprochen! | |||
< | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#607">'''Redoxgleichungen'''</span> | ||
|Inhalt= | |Inhalt= | ||
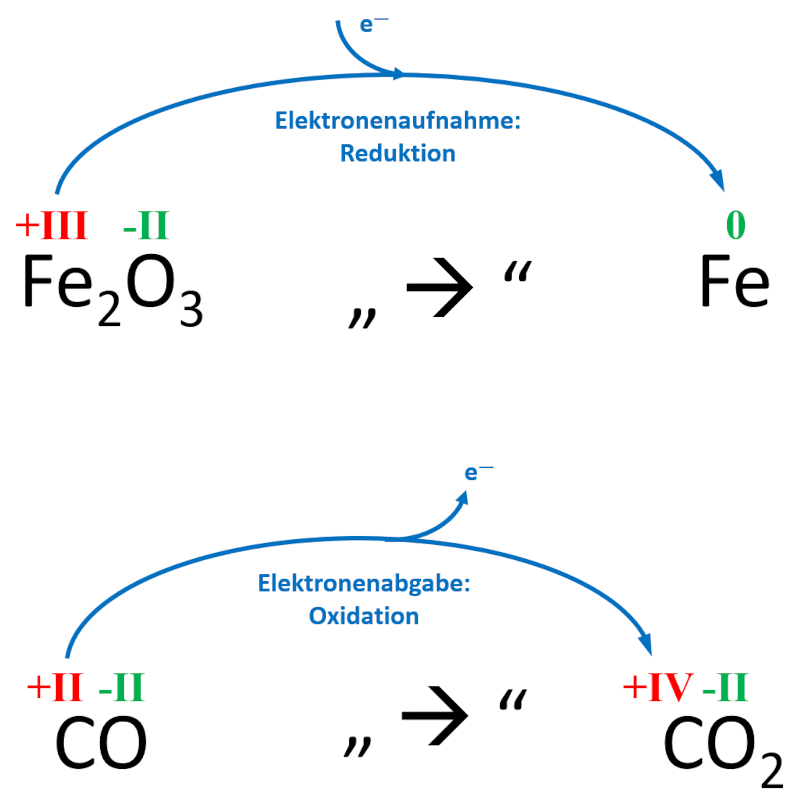
''' | '''Beispiel'''<br> | ||
Bei der Herstellung von reinem Eisen (Fe) strömt das Gas Kohlenstoffmonoxid (CO) durch heißes Eisenerz, welches hauptsächlich Eisenoxid (Fe<sub>2</sub>O<sub>3</sub>) enthält. Neben dem gewünschten Eisen entsteht auch Kohlenstoffdioxid (CO<sub>2</sub>)<br> | |||
Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:C9NTG_Redox_Bsp_Hochofen.jpg]]<br> | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
'''Aufgabe 1'''<br> | |||
Mangan (Mn) ist ein Element, welches gerne als "Chamäleon" bezeichnet wird. Das liegt daran, dass Manganverbindungen je nach Oxidationszahl des Mangans unterschiedliche gefärbt sind. Man kann also anhand der Farbe schon erkennen, welche OZ vorliegt. Schüttet man eine violette Lösung, die Permangant-Ionen enthält (MnO<sub>4</sub><sup>-</sup>) in eine saure Sulfit-Lösung (SO<sub>3</sub><sup>2-</sup>), so "verschwindet" die violette Farbe. Tatsächlich sind jedoch farblose Mn<sup>2+</sup>-Ionen entstand und gleichzeitig fand eine Umwandlung von Sulfit in Sulfat statt (SO<sub>3</sub><sup>2-</sup>).<br> | |||
Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! | |||
<br><br> | |||
'''Aufgabe 2''' (Bild: Abb. 1 auf S. 138 im Buch)<br> | |||
Wirft man ein Stück Kupfer (Cu) in Salpetersäure (HNO<sub>3</sub>), so löst es sich unter Entwicklung eines sehr giftigen, braunen Gases auf. Bei dem Gas handelt es sich um Stickstoffdioxid (NO<sub>2</sub>), das Kupfer selbst regiert zu Cu<sup>2+</sup>-Ionen.<br> | |||
Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! | |||
<br><br> | |||
'''Aufgabe 3''' (Bild: Abb. 1 auf S. 146 im Buch) <br> | |||
Im Labor kann man ein kleine Portion Kupfer(II)-oxid (CuO) in ein Glasrohr legen, durch das Wasserstoffgas (H<sub>2</sub>) strömt. Erhitzt man von außen das Kupfer(II)-oxid, so regiert es nach einiger Zeit mit dem vorbei strömenden Wasserstoff zu elementarem Kupfer (Cu). Gleichzeit entsteht bei dieser Reaktion Wasser (H<sub>2</sub>O).<br> | |||
Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! | |||
<br><br> | |||
'''Aufgabe 4''' (schwer, also wirklich: sehr schwer!)<br> | |||
Wenn die Verkehrspolizei heute überprüfen möchte, ob eine Autofahrerin bzw. ein Autofahrer Alkohol getrunken hat, dann muss die entsprechende Person in ein elektronisches Messgerät pusten. Das Gerät zeigt dann direkt einen Atemalkohol-Gehalt in Promille an. Früher gab es diese Technik noch nicht. Zwar musste man auch pusten, aber durch ein Röhrchen hindurch in einen Beutel, ähnlich wie ein Luftballon. In dem Röhrchen befand sich gelbes Kaliumdichromat (K<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub>). Wenn die autofahrende Person Alkohol in der Ausatemluft hatte, dann entstanden grüne Chrom(III)-Ionen (Cr<sup>3+</sup>). Der Alkohol reagierte dabei zur Essigsäure. Die folgende Abbildung zeigt die Valenzstrichformeln der beiden Verbindungen. Hier müsst ihr die Oxidationszahlen so bestimmen, wie ihr es ganz am Anfang gelernt habt: Durch Aufteilen der bindenden Elektronenpaare!<br> | |||
[[Datei:C9NTG_EthanolEssigsäure_Valenzstrich.jpg]]<br> | |||
<br> | |||
Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! | |||
Haltet eure Lösungen am Donnerstag in der Videokonferenz bereit! | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
| | |Hintergrund= #DCF | ||
''' | |||
''' | |||
''' | |||
''' | |||
|Farbe= # | |||
|Rahmen= | |||
|Rahmenfarbe= # | |||
|Hintergrund= # | |||
}} | }} | ||
== | === Präsentationstechnik === | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#607">'''Ein guter Vortrag mit einem Präsentationsprogramm'''</span> | ||
|Inhalt= | |Inhalt= | ||
'''Informationsquellen''' | |||
* Zunächst die im Unterricht besprochenen Bewertungskriterien: [[Spezial:FilePath/2018_Bewkrit_Ref.pdf|pdf-Datei]]<br> | |||
* Hier eine Internetseite, die ein einfach verständliches, klares Video enthält, in dem auf grundsätzlichen Anforderungen an ein Referat eingegangen wird. Im Video wird mehrfach erwähnt, dass man sich gut überlegen sollte, ob man wirklich ein Präsentationsprogramm verwendet. Diese Option habt ihr nicht. Es geht bei dieser Referats-Runde ja genau darum, gute Präsentationen '''mit einem Präsentationsprogramm''' zu gestalten. Trotzdem kann das Video sehr hilfreich sein: [https://herr-kalt.de/arbeitsmethoden/tipps-gute-vortraege Hier klicken] | |||
* Mit dem folgenden Link gelangt ihr zu einer Internetseite, auf der ihr euch durch eine (zugegeben sehr lange) Präsentation von Alexei Kapterev (ein prof. Redner-Coach) klicken könnt. Die Präsentation ist in englischer Sprache und plakativ, aber ich persönlich finde sie lustig: [https://www.slideshare.net/thecroaker/death-by-powerpoint/28-45_minutes_1_argument_2_argument_3_argument_Memorable_opening Hier klicken] | |||
<br> | |||
<br> | |||
'''Organisatorisches''' | |||
* Die Referate sollen '''10 Minuten''' dauern. Abweichungen von 2min. mehr oder weniger führen i.d.R. zu Punktabzug. | |||
* Das Referat entspricht einem '''angekündigten Leistungsnachweis''', daher: Wer anwesend ist, muss es halten! Wer fehlt, muss die üblichen Bestimmungen einhalten (Entschuldigung über den Schulmanager spätestens am zweiten Schultag nach Krankheitsbeginn). Im Krankheitsfall wird ein '''Ersatztermin''' festgelegt; das kann auch ein '''Freitagnachmittag''' sein, an dem das Referat nachgeholt werden muss. | |||
* Technik: Wenn ihr das Referat an der Schule haltet, solltet ihr eure Präsentation min. einen Tag vorher einmal an einem Rechner in der Schule '''ausprobieren'''. Wer die Präsentation am Tag des Referats nicht zum Laufen bekommt, muss eben auf die Visualisierung verzichten (= 0 Pkt. in diesem Bewertungs-Bereich). | |||
* Technik: Solltet ihr euch am Tag des Referats im Distanzunterricht befinden, haltet ihr das Referat von zu Hause aus. Dazu ist es erforderlich, dass ihr die Kamera aktiviert. Eine Bewertung ohne euch sehen zu können, ist nicht möglich. | |||
|Farbe= # | * Falls jemand sein Referat verschieben möchte: Rechtzeitig mit mir absprechen! - Was immer funktioniert: Wenn ihr einen '''Tauschpartner''' habt! | ||
<br> | |||
<br> | |||
'''Themenübersicht''' | |||
* Di 08.06., 1. Std.: KB - Thema: ???, OB - Thema: ???, LiB - Thema: ??? | |||
* Di 08.06., 2. Std.: LeB - Thema: ???, FB - Thema: ???, VD - Thema: ??? | |||
* Mi 09.06., 2. Std.: PD - Thema: ???, ME - Thema: ???, MG - Thema: ??? | |||
* Di 15.06., 1. Std.: CH- Thema: ???, EH - Thema: ???, BH - Thema: ??? | |||
* Di 15.06., 2. Std.: JaK - Thema: ???, JoK- Thema: ???, FL - Thema: ??? | |||
* Mi 16.06., 2. Std.: PM - Thema: ???, EN- Thema: ???, LP- Thema: ??? | |||
* Di 22.06., 1. Std.: AR - Thema: ???, LS - Thema: ???, EmS - Thema: ??? | |||
* Di 22.06., 2. Std.: ElS- Thema: ???, AT- Thema: ???, AW- Thema: ??? | |||
* Mi 23.06., 2. Std.: EW - Thema: ???, LW - Thema: ??? | |||
|Farbe= #607 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DCF | ||
|Hintergrund= # | |Hintergrund= #DCF | ||
}} | }} | ||
Aktuelle Version vom 13. März 2024, 16:44 Uhr
Arbeitsaufträge vom 17.03., zu bearbeiten bis 20.03.
- Macht eine Pause – holt euch einen Kaffee (o.ä.)!
Corona-Sonderregeln Q11
Die folgenden Regeln bezogen sich auf die Situation der Q11 im Schuljahr 2020/2021.
Chemie: chemische Reaktionsgleichungen aufstellen
Distanzunterricht Di, 11.05.
Da ich heute (Di, 11.05.) und morgen (Mi, 12.05.) aufgrund des Abiturs stark in organisatorische Aufgaben an der Schule eingebunden bin, müsst ihr an diesen beiden Tagen leider alleine klar kommen. Vergesst aber auf keinen Fall am Dienstag bis spätestens 08:15 Uhr eure Rückmeldung auf den "Start-in-den-Tag"-Auftrag im Schulmanager!
Ihr erhaltet hier drei Arbeitsaufträge für die drei Chemie-Unterrichtsstunden. Ich empfehle euch, jeden Arbeitsauftrag in der Zeit zu erledigen, die angegeben ist. Wenn ihr unbedingt eine andere Reihenfolge wählen wollt: Von mir aus. Für zwei Arbeitsaufträge erhaltet ihr auch im Schulmanager einen Auftrag, auf den ihr bitte eure entsprechend passende Lösung hochladet:
- Dienstag, 1. Std. (08:00 - 08:45 Uhr): Knobelaufgaben auf S. 132 lösen - Abgabe eines Lösungsvorschlags im Schulmanager erforderlich!
- Dienstag, 2. Std. (08:45 - 09:30 Uhr): Abschließende Rätsel zum gesamten bislang behandelten Stoff in org. Chemie
- Mittwoch, 2. Std. (09:45 - 10:30 Uhr): Versuch "CO2-Löscher" durchführen und Aufgaben dazu bearbeiten - Abgabe eines Lösungsvorschlags im Schulmanager erforderlich! Achtung: Die Aufgaben lassen sich auch lösen, wenn man den Versuch nicht durchgeführt hat (z.B. weil ihr kein Backpulver, keinen Essig oder kein Teelicht zu Hause hattet)!
Distanzunterricht Di, 11.05.
Ihr dürft heute zwischen zwei Versuchen wählen, die ihr durchführen sollt. Selbstverständlich dürft ihr auch beide machen, aber verpflichtend ist nur einer:
- Den Versuch CO2-Löscher hattet ihr schon vor Weihnachten mal auf, damals aber freiwillig. Wenn ihr ihn damals nicht gemacht habt: Auf geht´s :).
Am Ende des Versuchs ist eine Aufgabe gestellt, die ihr bitte bearbeitet und als Antwort auf den Arbeitsauftrag im Schulmanager schickt. - Der Versuch Apfel oxidieren ist neu. Hier sollt ihr am Ende keine Aufgabe bearbeiten, sondern es geht darum, den Versuch in Form eines "wissenschaftlichen Versuchsprotokolls" möglichst sachlich zu dokumentieren. Denkt immer daran: Ein Versuchsprotokoll besteht aus den Teilen "Versuchsaufbau/Durchführung" (hier wird beschrieben, was man getan hat), "Ergebnisse" (hier dokumentiert man in Wort und Bild die Ergebnisse des Versuchs - ohne dafür schon eine "Erklärung" zu geben) und "Erklärung/Diskussion" (hier versucht man unter anderem, die Ergebnisse zu erklären).
Distanzunterricht Donnerstag, 20.05., 8.Std.
Distanzunterricht Dienstag, 18.05.
Distanzunterricht Dienstag, 18.05.
Heute mal was kreatives! Aber schon auch eine fachliche Vorbereitung auf das letzte Kapitel in diesem Schuljahr: Biomoleküle.
In diesem letzten Kapitel sollt ihr vieles, was ihr über organische Verbindungen bisher gelernt habt auf Moleküle übertragen, die für Lebewesen eine wichtige Rolle spielen. Tatsächlich solltet ihr in Biologie über diese Moleküle bereits gesprochen haben. Und genau aus diesem Grund bekommt ihr jetzt auch diese Aufgabe gestellt: Verarbeitet euer bereits vorhandenes Wissen über die Kohlenhydrate, Fette und Eiweiße zu einem ästhetisch anspruchsvollen, wissenschaftlichen Poster!
Wissenschaftliche Poster sind zu einem beliebten Mittel geworden, um kleinere (aber auch größere) Forschungsarbeiten übersichtlich und anschaulich zu präsentieren. Wenn ihr euch genauer über "wissenschaftliche Poster" informieren wollt, dann könnt ihr z.B. folgenden Links folgen:
- Die Studienwerkstatt der Uni-Bremen hat ein pdf-Dokument mit etlichen Tipps zusammengestellt: Hier klicken
- In dem pdf-Dokument sind auch zwei Seiten verlinkt, auf denen man bereits fertige wissenschaftliche Plakate anschauen kann: Zum Beispiel hier oder hier
- So ein richtig wahnsinnig schönes yt-Video habe ich auf die Schnelle leider nicht gefunden. Ihr könnt natürlich "wissenschaftliches Poster" bei Google oder Youtube eingeben und ihr werdet tausende von Treffern erhalten, aber die ersten fünf, die ich mir angeschaut habe, hatten alle irgendwelche Haken.
Ein paar einfache Tipps:
- Verwendet ein Präsentationsprogramm, um ein Poster zu erstellen. Hier lassen sich Texte, Bilder, Grafiken etc. am einfachsten anordnen und formatieren.
- Hochformat ist günstiger (Entwurf --> Foliengröße --> Benutzerdefinierte Foliengröße --> "4:3" und "Hochformat" auswählen)
- Geht sparsam mit grellen Farben und/oder Kontrasten um. Bleibt am besten in einer "Farbfamilie".
- Poster werden in der Regel relativ groß ausgedruckt (DIN A2, A1 oder sogar A0), daher könnt ihr auch sehr kleine Schriftgröße (10pt) verwenden. Diese sind immer noch gut lesbar. ABER ACHTUNG:
- Niemand will ein Poster lesen, das Gigatonnen an Text enthält! Versucht eure fachlichen Inhalte gut zu veranschaulichen.
Inhalt:
- Als Ausgangspunkt könnt ihr eure Biologie-Schulbuch verwenden (S. 18, 19)
- Ihr könnt natürlich auch im Internet recherchieren.
- Bleibt inhaltlich aber bei dem, was ihr schon gelernt (inzwischen aber vielleicht wieder vergessen) habt.
- Zum Veranschaulichen eurer Inhalte könnt ihr selbst Fotos machen (z.B. von Nahrungsmitteln), selbst Symbole erstellen (ähnlich wie die Abbildungen auf S. 18 im Bio-Schulbuch) oder auch Grafiken aus dem Netz verwenden (z.B. Gehalt von ungesättigten Fettsäuren in verschiedenen Ölsorten)
Das folgende Plakat wurde mit PowerPoint erstellt und enthält keinerlei sinnvollen Inhalt. Es geht lediglich darum, zu zeigen, wie eine grundsätzliche Aufteilung aussehen könnte:

Verwendet nicht mehr als 90min. für diesen Arbeitsauftrag! Man kann sicher deutlich mehr Zeit investieren, um immer mehr Details zu erzeugen, aber ihr sollt auch lernen, mit der Ressource Zeit effektiv umzugehen. Ich empfehle daher zunächst das Plakat in Grundzügen zu entwerfen und je nach zur Verfügung stehender Zeit nach und nach Aspekte zu vertiefen, zu verfeinern oder optisch aufzuhübschen. Beim "linearen Arbeiten" (das heißt: Ich fange oben auf dem Plakat an und mache alles sofort super genau und super schön) kann es leicht passieren, dass die zur Verfügung stehende Zeit aufgebraucht ist und das Plakat aber noch lange nicht fertig wird. Das sollte nicht bessern.
Speichert die Präsentation als pdf-Datei ab und schickt sie mir als Antwort auf den Arbeitsauftrag im Schulmanager. Wir hören uns morgen (Mittwoch, 19.05.) in einer Videokonferenz.
Distanzunterricht Montag, 17.05.
Heute ein paar anspruchsvollere Aufgaben zum Thema Redoxgleichungen. Notiert eure Lösungen bitte auf einem Blockblatt, wir besprechen alles am Donnerstag in der 6. Std.
Achtung: Bei sämtlichen hier besprochen Prozessen werden immer nur Teile der chemischen Gesamtgleichung betrachtet. Das vollständige Aufstellen einer Redoxgleichung, so dass auf beiden Seiten des Reaktionspfeils tatsächlich die gleiche Anzahl von Teilchen steht, erfordert etwas Geschick und wird erst nach den Pfingstferien besprochen!