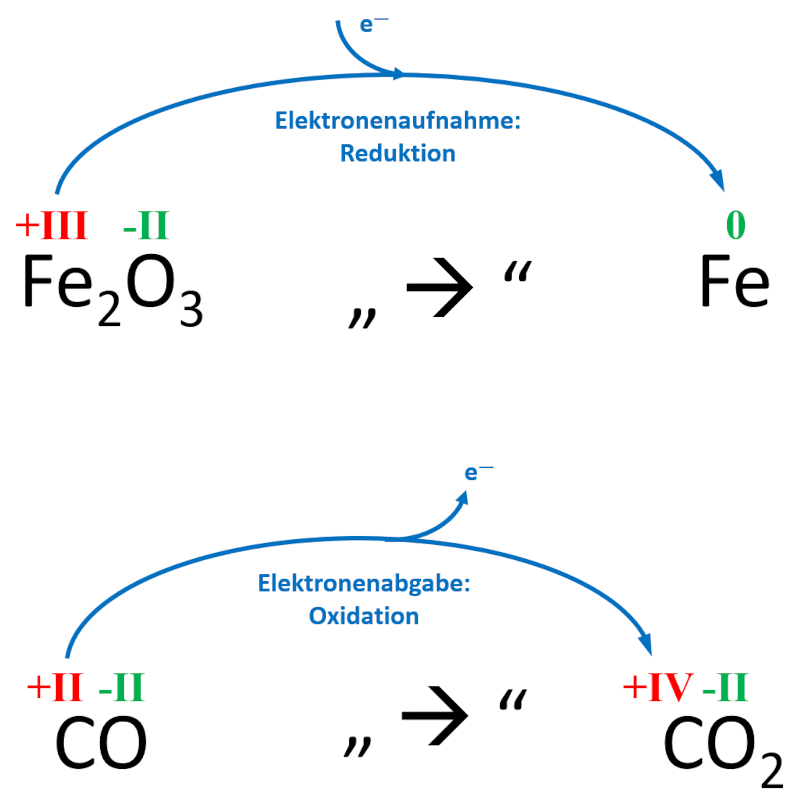
|
|
| (74 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) |
| Zeile 1: |
Zeile 1: |
| === Distanzunterricht Montag, 08.03. ===
| |
| Heute ein paar Aufgaben zum Abschluss der Thematik
| |
|
| |
|
| | ====<span style="color:#00A">'''Arbeitsaufträge vom 17.03., zu bearbeiten bis 20.03.'''</span>==== |
| | |
| | * Macht eine Pause – holt euch einen Kaffee (o.ä.)! |
| | |
| | </div> |
| <br> | | <br> |
| {{Box-spezial
| | <div style="border: 1px solid #080; background-color:#080; font-size:1px; height:8px; border-bottom:1px solid #080"></div> |
| |Titel=<span style="color:#607">'''Pflicht: Knobelecke im Buch'''</span>
| | <div style="border: 1px solid #080; padding:7px; background-color:#CFC; padding:0.3em" "> |
| |Inhalt=
| | ===<span style="color:#080">'''Lösungsvorschläge'''</span>=== |
| Löst die folgenden Aufgaben im Buch auf der S. 112:
| | ====<span style="color:#080">Für die Arbeitsaufträge vom 17.03.</span>==== |
| * A1
| | {{versteckt| |
| * A3
| |
| * A4 - Bevor ihr diese Aufgabe löst, lest im Buch S. 93
| |
| * A5
| |
| * A7
| |
| * A9
| |
| * A10
| |
| <br><br> | |
| Die Lösung für die Aufgaben gibt es hier in einer pdf-Datei: [[Spezial:FilePath/C10NTG_25_Knobel112_ML.pdf|Hier klicken]]
| |
| * Bitte erst anschauen, wenn ihr tatsächlich alle Aufgaben selbst probiert habt!
| |
| * Bitte nicht ausdrucken sondern Papier sparen! - Verbessert eure eigene Lösung mit Rotstift. Das prägt sich auch besser ein, als nur die Musterlösung zu besitzen.
| |
| * Bitte beachtet auch, dass die Reihenfolge der Lösungskärtchen von rechts nach links läuft (was einen bestimmten Grund hat, für euch aber irrelevant ist)
| |
|
| |
|
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
|
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Kür: Ein paar schwierigere Aufgaben zur Acetal- und Ketalbildung'''</span>
| |
| |Inhalt=
| |
| * Arbeitsblatt als [[Spezial:FilePath/C10NTG_25_AcetalKetal_ÜA.pdf|pdf-Datei]]. Bitte nicht ausdrucken, sondern Papier sparen!
| |
| * Lösungsvorschlag als [[Spezial:FilePath/C10NTG_25_AcetalKetal_ÜA_ML.pdf|pdf-Datei]]. Bitte nicht ausdrucken, sondern Papier sparen!
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }} | | }} |
| Wir hören uns am Mittwoch in einer Videokonferenz
| | </div> |
| | | <br><br> |
|
| |
|
| === Distanzunterricht Montag, 08.03. === | | ===<span style="color:#507">'''Corona-Sonderregeln Q11'''</span>=== |
| Verbessert heute bitte alle Aufgaben, die in den Videokonferenzen noch nicht verbessert wurden!
| | Die folgenden Regeln bezogen sich auf die Situation der Q11 im Schuljahr 2020/2021. |
|
| |
|
| <br>
| |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Neutralisationsgleichungen'''</span> | | |Titel= |
| |Inhalt= | | |Inhalt= |
| * Hier gibt es die Lösung zum Arbeitsblatt vom 01.03. (falls ihr es nicht mehr habt, hier die [[Spezial:FilePath/C9NTG_PP23_NeutralisationAB_Corona.pdf|pdf-Datei]])
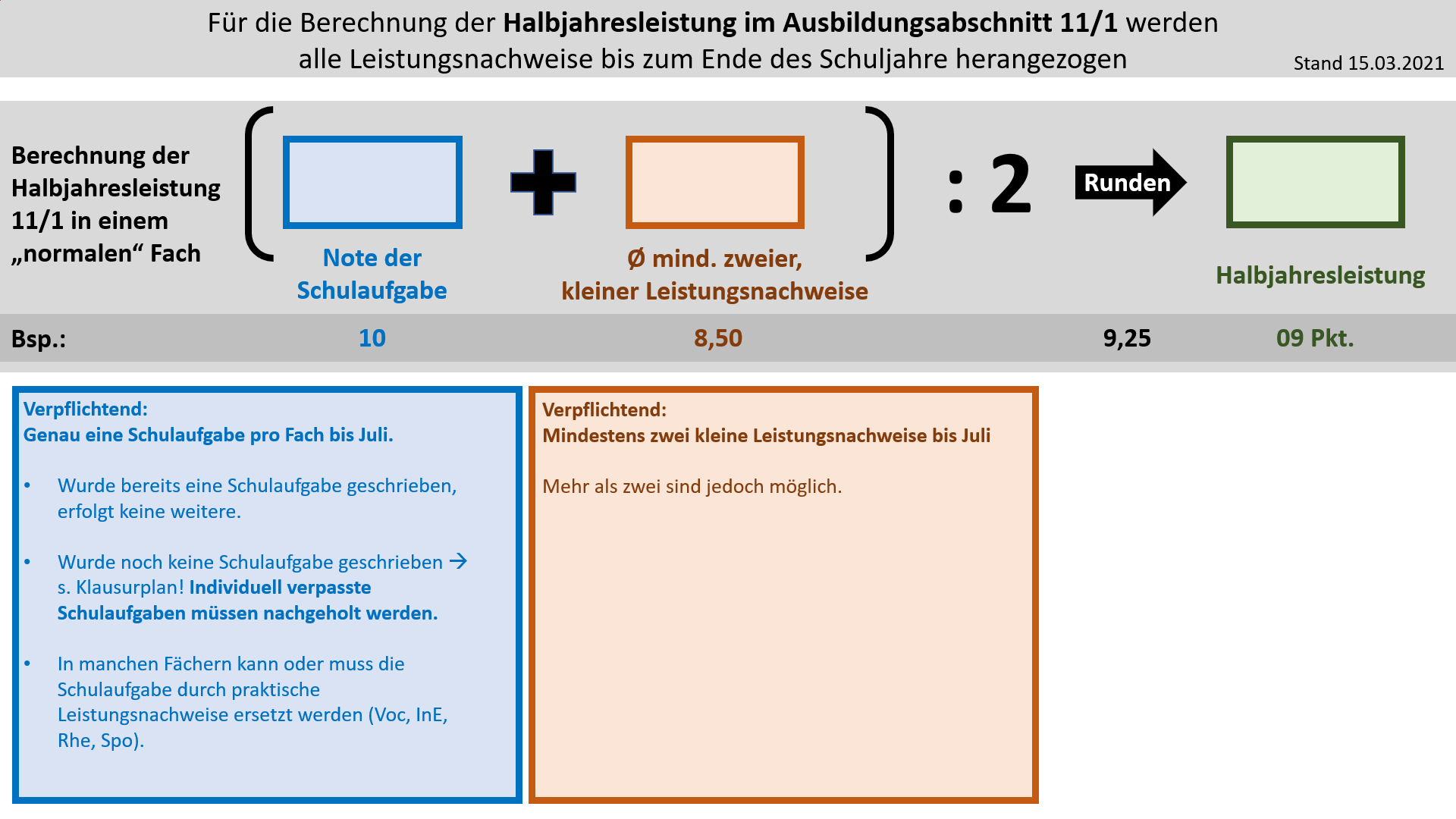
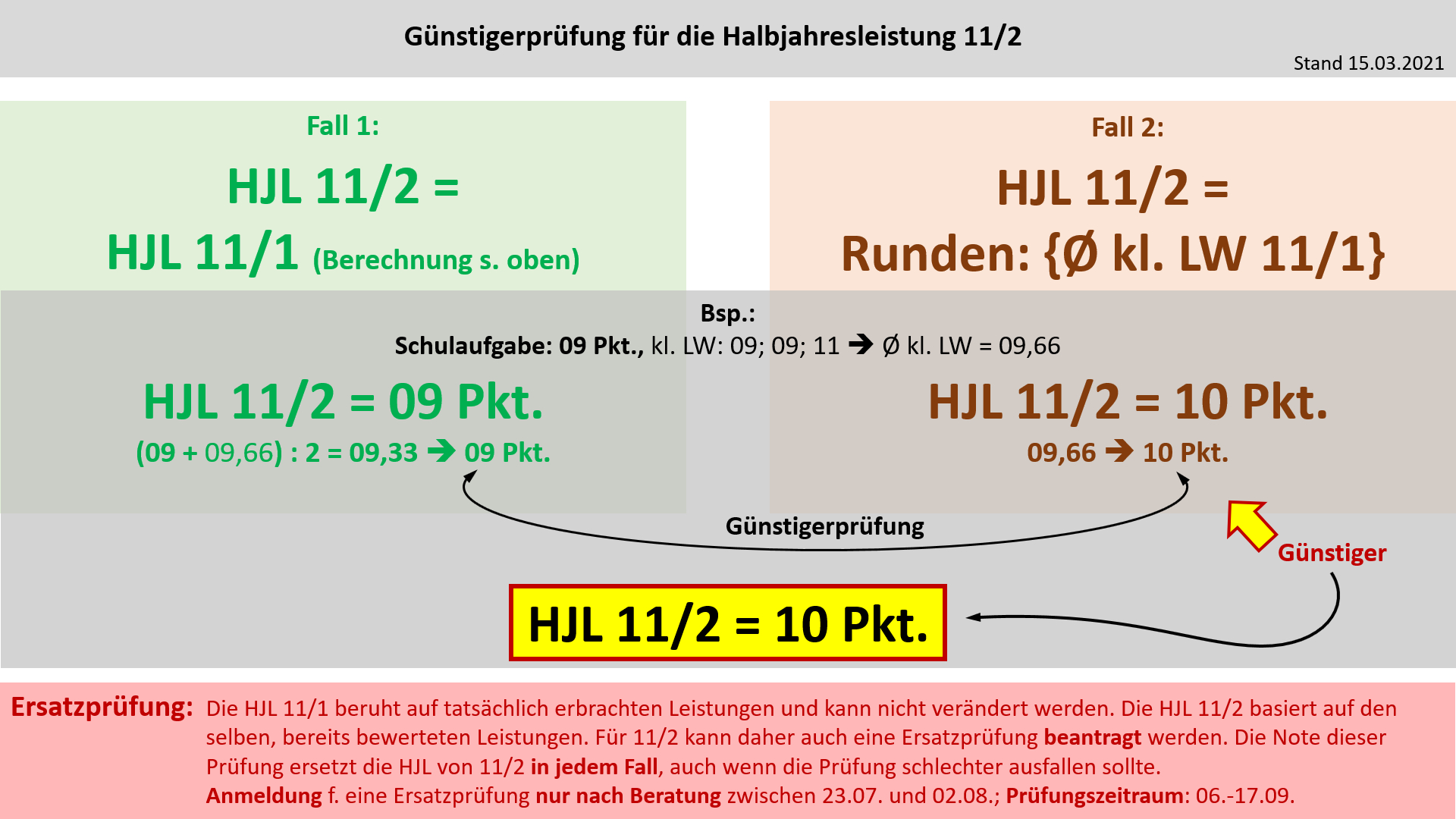
| | '''Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/1''' |
| * Bitte versucht die Aufgaben auf jeden Fall erst selbst zu lösen, bevor ihr auf "Lösung" klickt! - Eigentlich solltet ihr diese Hausaufgabe ja auch schon längst erledigt sein.
| | {{Lösung versteckt| |
| | | [[Datei:Cor_ab1503_HJL111.jpg]] |
| | |Anzeigen|Verbergen}} |
| | <br> |
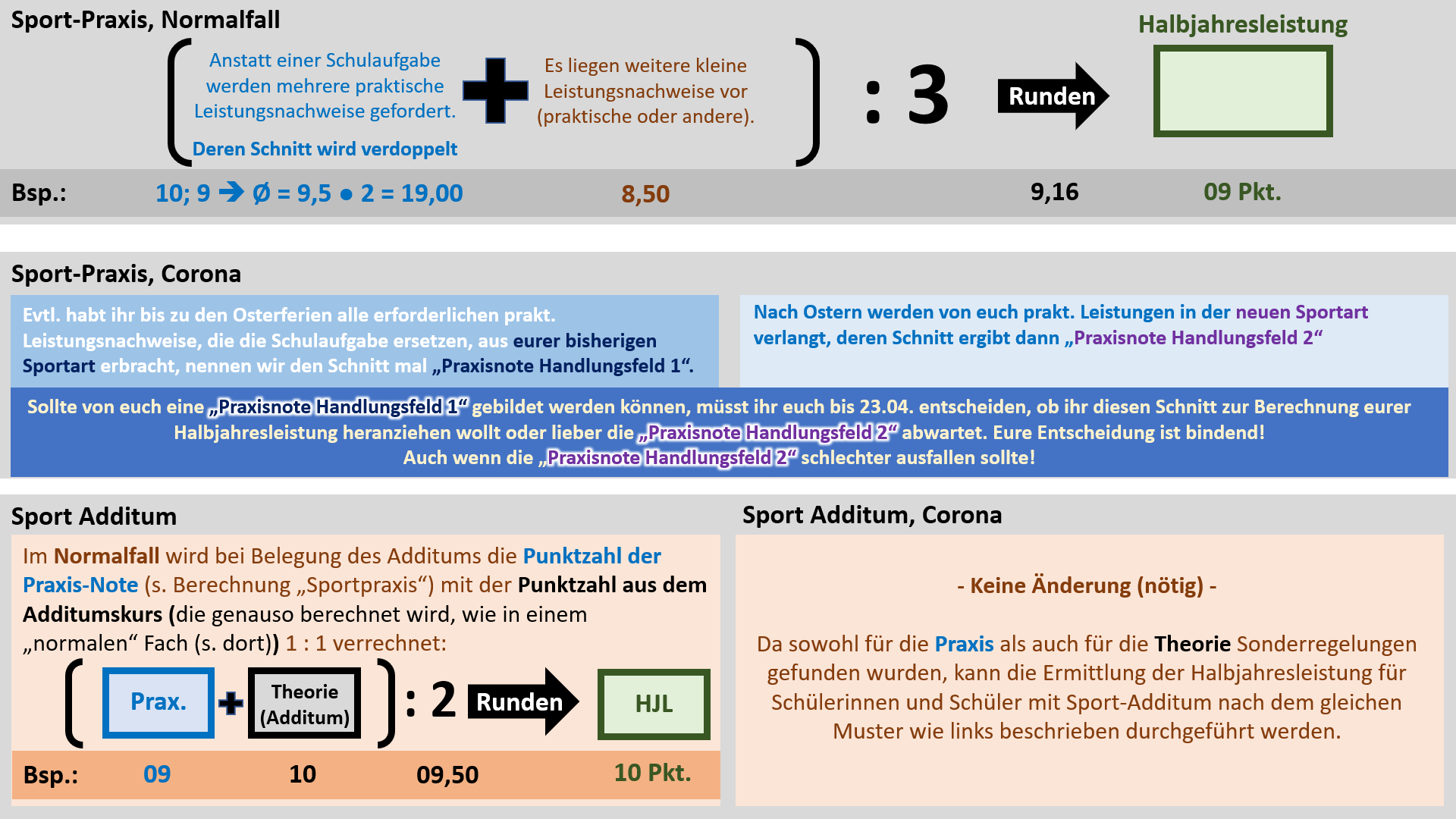
| | '''Regelungen für Sport''' |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_Neutralisation_AB_MLkomplett.jpg]] | | [[Datei:Cor_ab1503_Sport_V2.jpg]]<br> |
| |Lösung|Lösung ausblenden}}
| | '''Achtung, Termin geändert: Die Abgabe der Erklärung, welche großen praktischen Leistungsnachweise zählen sollen ist erst bis 18.05. erforderlich!''' |
| | <br> |
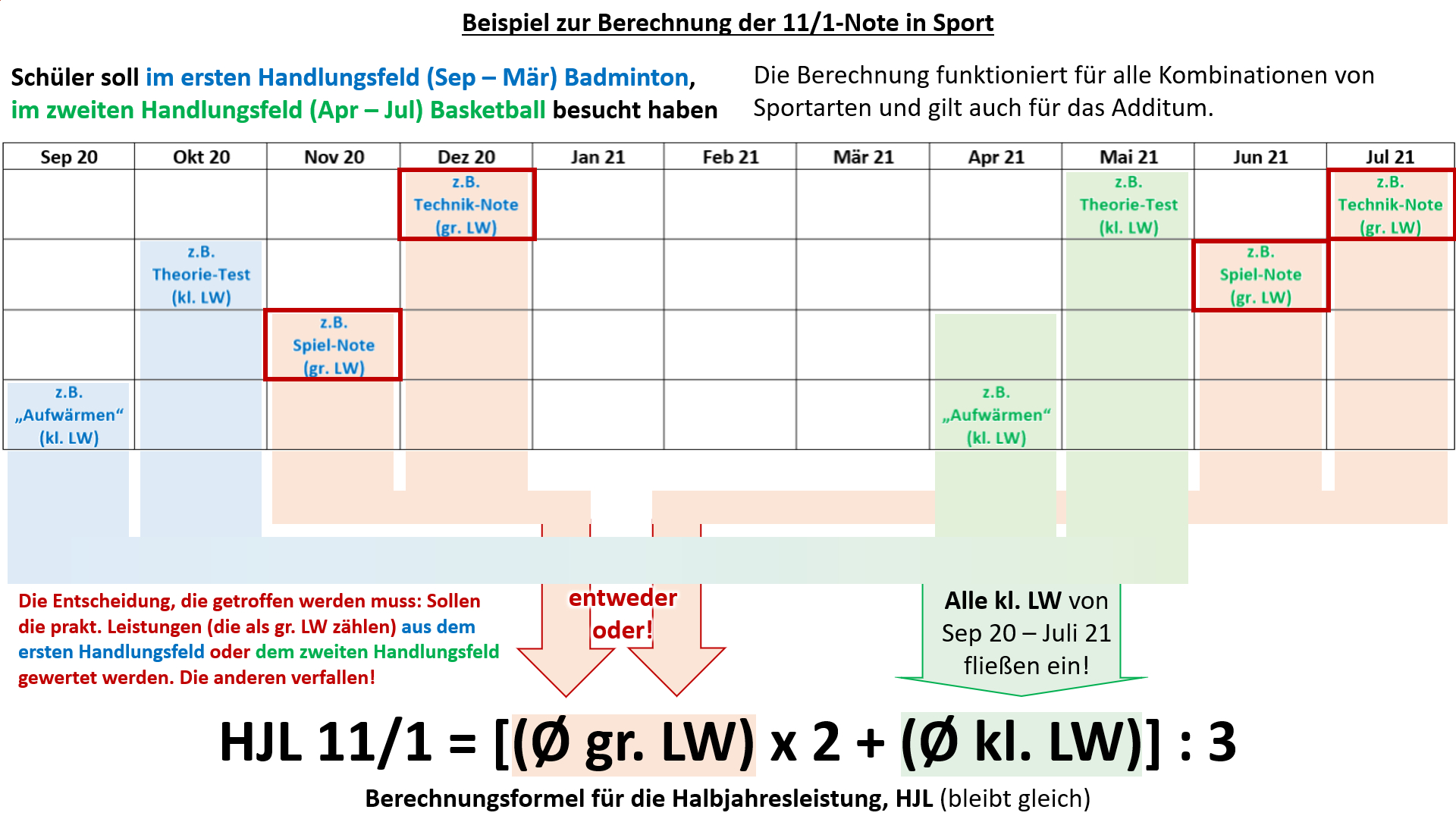
| | Hier noch einmal ein Beispiel, welches anhand der verschiedenen Leistungsnachweise im gesamten Schuljahr verdeutlichen soll, welche Wahl getroffen werden muss.<br> |
| | <br> |
| | [[Datei:Cor_ab1503_Sport_BspSJ.jpg]]<br> |
| | <br> |
| | Hinweis zur Logik, die hinter diesem Verfahren stecken soll: In allen anderen Fächern wird nur '''eine Schulaufgabe''' ('''großer Leistungsnachweis''') geschrieben. Entweder sie wurde bereits vor dem 15. März geschrieben oder sie wird erst noch geschrieben. In Sport liegt ein Sonderfall vor: Anstatt '''Schulaufgaben '''werden manche '''prakt. Leistungsnachweise''' als '''große Leistungsnachweise''' gewertet. Nachdem ab April die Sportart wechselt und dann auch wieder '''prakt. Leistungsnachweise''' absolviert werden, würden in Sport quasi '''"zwei Schulaufgaben"''' im ganzen Semester 11/1 vorliegen. Damit das nicht eintritt, muss entschieden werden, welche '''"Schulaufgabe"''', bzw. die '''prakt. Leistungsnachweise aus welchem Handlungsfeld''', gewertet werden sollen. Die kleinen Leistungsnachweise werden immer alle gewertet. Damit wird die Notensituation in Sport den anderen Fächern angeglichen.<br> |
| | Ergänzung zur Notenbildung in 11/2: Für die Halbjahresleistung in 11/2 werden die selben Noten herangezogen, aus denen auch schon die Halbjahresleistung für 11/1 errechnet wurde. Ein häufiges Missverständnis ist, dass manche Noten zu 11/1 und manche zu 11/2 zählen würden. Dem ist nicht so. Es gibt keine 11/2-Noten! Alle Leistungsnachweise zählen zu 11/1!<br> |
|
| |
|
| * Bedenkt, dass auch andere Lösungsvorschläge gut sein können. Vor allem bei Säuren, die mehr als ein Proton abgeben können.
| | |Anzeigen|Verbergen}} |
| |Farbe= #607 | |
| |Rahmen= 0 | |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Säure oder Base? Manchmal beides!'''</span>
| |
| |Inhalt=
| |
| * Das folgende Video enthält die Lösungen für die Aufgaben auf dem Arbeitsblatt vom 04.03. (falls ihr es nicht mehr habt, hier die [[Spezial:FilePath/C9NTG_PP24_koorSäBaPaare_Amphos_Corona.pdf|pdf-Datei]])
| |
| * Auch hier gilt: Bitte versucht, die Lösung zunächst selbst zu finden, bevor die Lösung anschaut!
| |
| | |
| {{#ev:youtube|A0Rck_l2fc8}}<br>
| |
| <br> | | <br> |
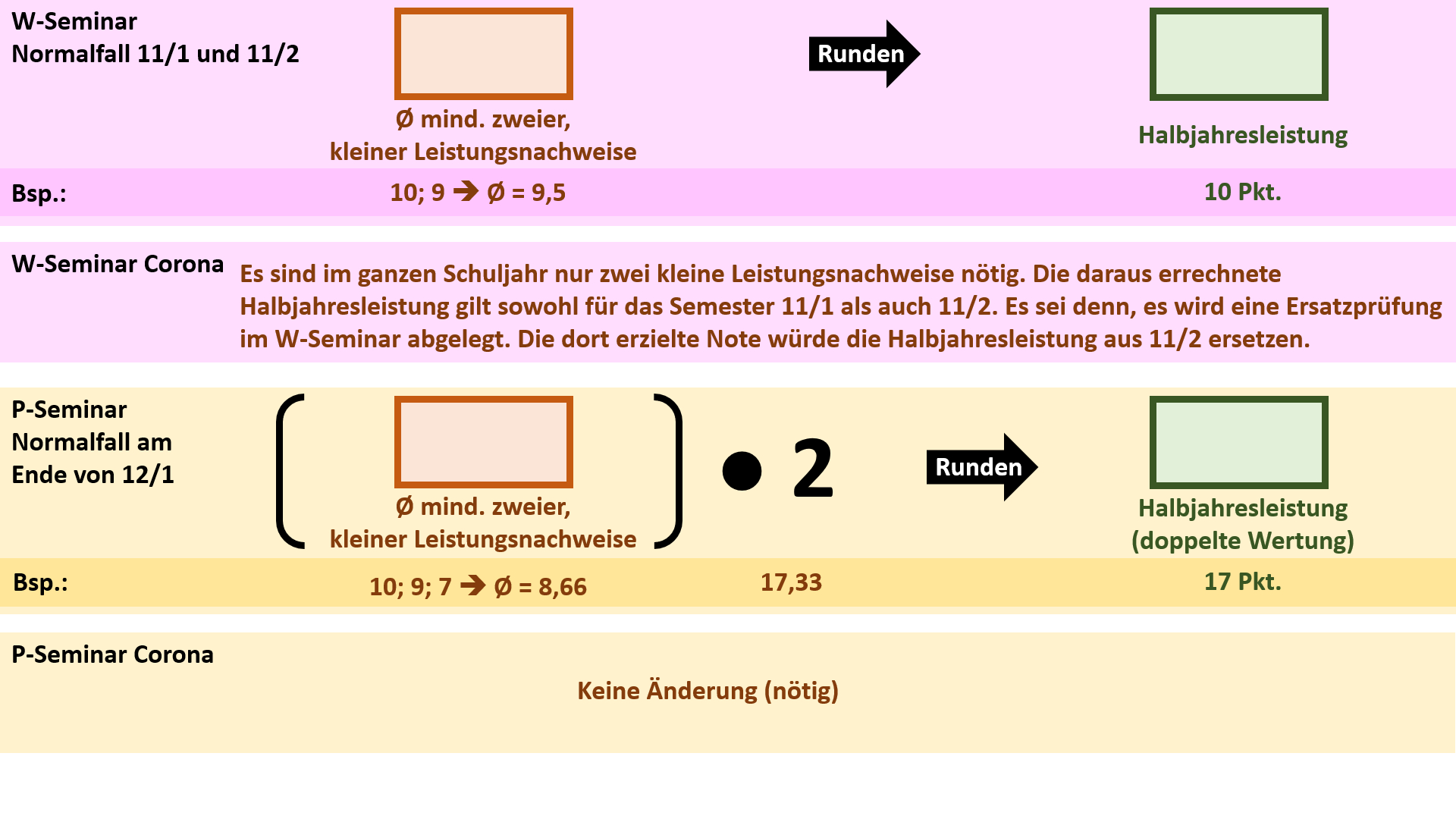
| |Farbe= #607 | | '''Regelungen für die Seminare''' |
| |Rahmen= 0
| | {{Lösung versteckt| |
| |Rahmenfarbe= #DCF | | [[Datei:Cor_ab1503_Seminare.jpg]] |
| |Hintergrund= #DCF | | |Anzeigen|Verbergen}} |
| }} | |
| Wir hören uns am Donnerstag in einer Video-Konferenz. Bis dann!
| |
| | |
| === Distanzunterricht Dienstag, 02.03. ===
| |
| * Das folgende Video dauert 33min.
| |
| * Nach 21:00min sollt ihr das Video anhalten, im Buch etwas lesen und danach eine Aufgabe lösen. Wenn ihr das erledigt habt, könnt ihr solange Pause machen, bis die 45 Minuten der ersten Chemie-Stunde um wären.
| |
| * Schaut dann den Rest des Videos. Zum Schluss werden weitere Aufgaben gestellt. Bitte bearbeitet diese Aufgaben und haltet sie für die nächste Videokonferenz am Mittwoch bereit!
| |
| * Auch wenn das Video lang ist, solltet ihr alle Aufgaben in den 90 Minuten, die uns im Unterricht zur Verfügung stehen würden, locker erledigen können.
| |
| * Es sollten dann immer noch ein paar Minuten Zeit sein, das Wetter zu genießen oder ein paar Dehn-Übungen o.ä. durchzuführen!
| |
| | |
| <br> | | <br> |
| {{Box-spezial
| | '''Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/2''' |
| |Titel=<span style="color:#607">'''Eine typische Reaktion von Aldehyden und Ketonen'''</span>
| | {{Lösung versteckt| |
| |Inhalt= | | [[Datei:Cor_ab1503_HJL112.jpg]] |
| Schaut zunächst das folgende Video, in dem die theoretischen Grundlagen erklärt werden, stoppt aber bei Zeitindex 21:02 und erledigt die beschriebene Aufgabe! <br>
| | |Anzeigen|Verbergen}} |
| {{#ev:youtube|qVly-pJCuLM}}<br>
| |
| <br> | | <br> |
| | '''Zeitplan''' |
| | {{Lösung versteckt| |
| | [[Datei:Cor_ab1503_Zeitplan_V2.jpg]]<br> |
| | '''Achtung, Termin geändert: Die Abgabe der Erklärung, welche großen praktischen Leistungsnachweise zählen sollen ist bis 18.05. erforderlich gewesen!''' |
| <br> | | <br> |
| Hier der entsprechende Hefteintrag (ausdrucken und einkleben oder abschreiben) und das Arbeitsblatt als [[Spezial:FilePath/24_Reak d AldKet_nuklAdd_AB_V2_Corona.pdf|pdf-Datei]]<br>
| | |Anzeigen|Verbergen}} |
| <br> | | <br> |
| Wir hören uns morgen (Mittwoch, 03.03. in einer Videokonferenz)
| | |Farbe= #507 |
| |Farbe= #607 | |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #EDE |
| |Hintergrund= #DCF | | |Hintergrund= #EDE |
| }} | | }} |
|
| |
|
| | | === Chemie: chemische Reaktionsgleichungen aufstellen === |
| == Distanzunterricht Montag, 01.03. Chemie == | |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Einüben der letzten Online-Einheiten'''</span> | | |Titel=<span style="color:#080">'''Nr. 1''': Ammoniak reagiert mit Sauerstoff zu Stickstoffmonooxid und Wasser.</span> |
| |Inhalt= | | |Inhalt= |
| Zur Wiederholung: Was solltet ihr im Moment wissen:
| | |
| * Säuren sind Stoffe, die im Wasser mind. ein Proton abgeben.
| | {{Lösung versteckt| |
| * Allgemein kann man daher für die Reaktion einer Säure mit Wasser formulieren: HX + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup> + X<sup>-</sup>
| | 4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O |
| ** Typische Beispielaufgabe: Formuliere die Reaktion von Hydrogenchlorid (einer Säure) mit Wasser!
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} |
| ** HCl + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup> + Cl<sup>-</sup>
| |
| * Durch das Einleiten einer Säure in Wasser entstehen also '''saure Lösungen'''. Diese enthalten immer''' H<sub>3</sub>O<sup>+</sup>-Ionen'''
| |
| <br> | | <br> |
| * Basen sind Stoffe, die mind. ein Proton aufnehmen können.
| | '''oder Schritt für Schritt:''' |
| * Allgemein kann man daher für die Reaktion einer Base mit Wasser formulieren Y + H<sub>2</sub>O --> OH<sup>-</sup> + Y<sup>+</sup>
| |
| * Ein konkretes Beispiel wäre das Einleiten von NH<sub>3</sub> (Ammoniak, eine Base) in Wasser: NH<sub>3</sub> + H<sub>2</sub>O --> OH<sup>-</sup> + NH<sub>4</sub><sup>+</sup>
| |
| * Durch das Einleiten einer Base in Wasser entstehen also '''basische Lösungen'''. Diese enthalten immer''' OH<sup>-</sup>-Ionen'''
| |
| * Achtung: Es gibt einen anderen Weg, wie basische Lösungen entstehen können, auch ohne, dass eine Base im Wasser den Wassermolekülen ein Proton entreißt: Es gibt einige Salze, die das OH<sup>-</sup>-Ion im Kristallgitter enthalten. Wenn man diese Salze in Wasser löst und die Ionen von Wassermolekülen umringt werden (aquatisiert werden), entstehen auch basische Lösungen mit den typischen OH<sup>-</sup>-Ionen
| |
| ** Typisch Beispielaufgabe: Formuliere die Reaktion von Natriumhydroxid mit Wasser!
| |
| ** NaOH --> Na<sup>+</sup>(aq.) + OH<sup>-</sup>(aq)
| |
| <br> | | <br> |
| * Schüttet man basische und saure Lösungen im genau richtigen Verhältnis zusammen in ein Gefäß, reagieren die OH<sup>-</sup>-Ionen der basischen Lösung mit den H<sub>3</sub>O<sup>+</sup>-Ionen der sauren Lösung zu Wasser. Die Lösungen neutralisieren sich gegenseitig
| |
| * Gleichung: OH<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> --> 2 H<sub>2</sub>O.
| |
| * Übrig bleiben die anderen Ionen (z.B. das positive Metallkation des Salzes und der negativ geladene Säurerest), die zusammen ein Salz ergeben. Dieses Salz kann man benennen.
| |
| ** Typische Beispielaufgabe: Formuliere in einer chemischen Gleichung die Neutralisation, von '''wässriger HCl-Lösung''' (heißt auch "'''Salzsäure'''") mit '''NaOH-Lösung''' (heißt auch '''Natronlauge''')!
| |
| ** H<sub>3</sub>O<sup>+</sup> + Cl<sup>-</sup> + Na<sup>+</sup> + OH<sup>-</sup> --> 2 H<sub>2</sub>O + Cl<sup>-</sup> + Na<sup>+</sup>
| |
| ** Man kann jederzeit auch "(aq.)" dazu schreiben (außer beim Wasser): H<sub>3</sub>O<sup>+</sup>(aq.) + Cl<sup>-</sup>(aq.) + Na<sup>+</sup>(aq.) + OH<sup>-</sup>(aq.) --> 2 H<sub>2</sub>O + Cl<sup>-</sup>(aq.) + Na<sup>+</sup>(aq.)
| |
| <br>
| |
| * Etwas schwieriger wird es, wenn die Säure eine andere Anzahl an Protonen abgibt, als die Base aufnimmt. Dann muss man mit entsprechenden Koeffizienten (das sind in einer chemischen Gleichung die Zahlen vor den chemischen Formeln) arbeiten:
| |
| ** Formuliere in einer chemischen Gleichung die Neutralisation, von wässriger H<sub>2</sub>SO<sub>4</sub>-Lösung mit '''NaOH-Lösung''' (heißt auch '''Natronlauge''')!
| |
| ** Nachdem die Schwefelsäure in Wasser 2 Protonen abgeben kann, braucht man doppelt so viele NaOH-Teilchen, um die Schwefelsäure zu neutralisieren. Denn aus einem NaOH-Teilchen entsteht im Wasser ja nur ein OH<sup>-</sup>-Teilchen, welches auch nur ein Proton aufnehmen kann.
| |
| ** 2 H<sub>3</sub>O<sup>+</sup> + SO<sub>4</sub><sup>2-</sup> + 2 Na<sup>+</sup> + 2 OH<sup>-</sup> --> 4 H<sub>2</sub>O + SO<sub>4</sub><sup>2-</sup> + 2 Na<sup>+</sup>
| |
| <br>
| |
| Mit diesen Hinweisen solltet ihr das folgende Arbeitsblatt komplett lösen können. Eine Lösung hier im WIKI gibt es erstmal nur für die erste Aufgabe. Solltet ihr nicht weiter wissen, dann müsst ihr selbständig die letzten Einheiten wiederholen. Ich erwarte, dass ihr am kommenden Donnerstag alle die Lösung habt!
| |
| <br>
| |
| <br>
| |
| Hier das Arbeitsblatt als [[Spezial:FilePath/C9NTG_PP23_NeutralisationAB_Corona.pdf|pdf-Datei]]
| |
|
| |
|
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_NeutrReak_AB_MLA1.jpg]]
| | Ammoniak + Sauerstoff --> Stickstoffmonooxid + Wasser |
| |Lösung für A1|Lösung ausblenden}}
| |
|
| |
|
| |Farbe= #607 | | {{Lösung versteckt| |
| |Rahmen= 0 | | * Ammoniak (Trivialname, muss man auswendig wissen): '''NH<sub>3</sub>''' |
| |Rahmenfarbe= #DCF | | * Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' |
| |Hintergrund= #DCF | | * Stickstoffmonooxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''NO''' |
| }} | | * Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' |
| <br>
| | * NH<sub>3</sub> + O<sub>2</sub> --> NO + H<sub>2</sub>O |
| | {{Lösung versteckt| |
| | '''4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O''' |
| | |Ausgleichen|Lösung ausblenden}} |
| | |Chemische Formeln aufstellen|Lösung ausblenden}} |
|
| |
|
| | |Edukte und Produkte festlegen|Lösung ausblenden}} |
|
| |
|
| === Distanzunterricht Donnerstag, 25.02. Bio===
| | Beschreibe den Aufbau des Stoffs '''Ammoniak''' unter Verwendung von Fachbegriffen so genau wie möglich! |
| | {{Lösung versteckt| |
| | Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Stickstoff- und drei Wasserstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. |
| | |Lösung|Lösung ausblenden}} |
|
| |
|
| * Ihr benötigt euer Schulbuch, Zettel und Stift
| |
| * Diesmal ist die Abgabe eurer Lösung als Antwort auf den Arbeitsauftrag im Schulmanager verlangt!
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#060">'''Die ökologische Nische'''</span>
| |
| |Inhalt=
| |
| * Lest zunächst die Seiten 88 - 89 im Buch!
| |
| * Bearbeitet dann die Aufgabe "Einnischung bei Löffel- und Reiherente" im Buch.
| |
| ** Die Aufgabe beginnt auf der S. 90 oben rechts bei dem orange umrandeten Kasten "Einnischung bei Löffel- und Reiherente".
| |
| ** Sie bezieht sich auf die beiden Bilder darunter
| |
| ** Die eigentlichen Fragestellungen folgen auf der S. 91 oben links: Aufgaben 5 und 6
| |
| * Bitte notiert eure Lösungsansätze sauber auf einem DIN-A4-Blatt und schickt eine Foto davon als Antwort auf den Arbeitsauftrag, den ihr heute Morgen (Do, 25.02., 07:50 Uhr erhalten habt)
| |
| * Ladet euch dann die Hefteinträge zum Thema Ökologie herunter, die ihr noch nicht habt:
| |
| <br>
| |
| <br>'''Skript "Ökologie"'''
| |
| * Teil 1: '''"Grundbegriffe"''' als [[Spezial:FilePath/Skript_Öko_001.pdf|pdf-Datei]], Buch S. 62/63
| |
| * Teil 2: '''"Einflussfaktoren auf Lebewesen"''' Buch, S. 64/65 +
| |
| * Teil 3: '''"Vitalitätskurven"''' als als [[Spezial:FilePath/Skript_Öko_002.pdf|pdf-Datei]], s. Buch, S. 70
| |
| * Teil 4: '''"Nischenbildung"''' als als [[Spezial:FilePath/Skript_Öko_03.pdf|pdf-Datei]], s. Buch, S. 88/89
| |
| |Farbe= #080 | | |Farbe= #080 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 176: |
Zeile 105: |
| }} | | }} |
| <br> | | <br> |
|
| |
| == Distanzunterricht Donnerstag, 25.02. Chemie ==
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Die Säure-Base-Reaktion'''</span> | | |Titel=<span style="color:#080">'''Nr. 2''': Benzol (C<sub>6</sub>H<sub>6</sub>) verbrennt (reagiert mit Sauerstoff) zu Kohlenstoffdioxid und Wasser</span> |
| |Inhalt= | | |Inhalt= |
| Ihr habt in den letzten beiden Einheiten '''Säuren''' und '''Basen '''kennengelernt. Hier noch einmal eine Kurz-Zusammenfassung über deren typische Eigenschaften auf molekularer Ebene:
| | |
| * Säuren können aus einer heterolytischen Bindung zwischen einem Wasserstoff-Atom und einem anderen Atom ein '''Proton abspalten''', z.B. HCl (Hydrogenchlorid):<br>
| |
| [[Datei:SäBa3_HCl_alleine.jpg|800px]]
| |
| * Basen können ein Proton über ein freies Elektronenpaar ein Proton binden, also aufnehmen, z.B. NH<sub>3</sub> (Ammoniak)
| |
| [[Datei:SäBa3_NH3_alleine.jpg|800px]]
| |
| <br>
| |
| Protonen können aber weder von Säuren einfach so "ins Freie" abgegeben werden, noch fliegen Protonen einfach so in der Gegend herum und können von Basen beliebig aufgenommen werden. Dazu ist immer ein Reaktionspartner nötig, der diese Protonen aufnimmt oder hergibt.<br>
| |
| Insofern sind '''Säuren und Basen''' hervorragende '''Reaktionspartner''' und reagieren in einer typischen '''"Säure-Base-Reaktion"''' miteinander:<br>
| |
| [[Datei:SäBa3_HCl_mit_NH3.jpg|800px]]<br>
| |
| <br>
| |
| Wie ihr sehen könnt, entsteht bei dieser Reaktion ein Salz. Also ein Stoff, der aus positiv geladenen Teilchen (hier NH<sub>4</sub><sup>+</sup>) und negativ geladenen Teilchen (hier: Cl<sup>-</sup>) aufgebaut ist. Salze entstehen auch bei der Reaktion von Metallen mit Nichtmetallen, z.B. von Natrium mit Chlor.
| |
| * Vergleicht diese beiden Reaktionstypen miteinander! "Vergleichen" heißt: Gemeinsamkeiten und Unterschiede herausstellen.
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| * Bei der Salzbildung aus '''Metall und Nichtmetall''' gibt das Metall '''Elektronen '''ab, das Nichtmetall nimmt Elektronen auf.
| | 2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O |
| * Bei der Salzbildung aus '''Säure und Base''' gibt die Säure ein '''Proton '''ab, die Base nimmt ein Proton auf.
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} |
| * Gemeinsamkeit: In beiden Fällen entstehen unterschiedlich geladene Ionen, die das Salz bilden.
| |
| |Lösung|Lösung ausblenden}} | |
| <br> | | <br> |
| Die direkte Reaktion einer Säure mit einer Base betrachtet man an dieser Stelle im Unterricht eher selten. Einfach deswegen, weil viele Säure-Base-Reaktionen im Wasser ablaufen. Und Wasser hat ein besondere Eigenschaft. <br>
| | '''oder Schritt für Schritt:''' |
| Betrachtet zunächst die hier stark vereinfacht dargestellte Reaktion, die beim Einleiten von HCl-Gas in Wasser abläuft und beschreibt sie mit Worten:<br>
| |
| [[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br>
| |
| {{Lösung versteckt|
| |
| Ein HCl-Molekül gibt ein Proton an ein Wassermolekül ab. Es entsteht ein Chlorid-Ion und ein Oxonium-Ion (den Namen wusstet ihr vielleicht noch nicht, auch "H<sub>3</sub>O<sup>+</sup>-Teilchen" wäre o.k. gewesen.
| |
| |Lösung|Lösung ausblenden}}
| |
| | |
| Betrachtet nun die stark vereinfacht dargestellte Reaktion, die beim Einleiten von NH<sub>3</sub>-Gas in Wasser abläuft und beschreibt sie mit Worten:<br>
| |
| [[Datei:SäBa3_NH3_und_H2O.jpg|800px]]<br>
| |
| | |
| {{Lösung versteckt|
| |
| Ein Ammoniak-Molekül entreißt einem Wasser-Molekül ein Proton. Es entsteht ein Ammonium-Ion (NH<sub>4</sub><sup>+</sup>-Teilchen) und ein Hydroxid-Ion (OH<sup>-</sup>-Teilchen)
| |
| |Lösung|Lösung ausblenden}}
| |
| <br> | | <br> |
|
| |
|
| Legt nun den Fokus eurer Betrachtung auf das Wassermolekül. Zunächst zur oberen Gleichung (HCl wird in Wasser eingeleitet): Was hat das Wassermolekül hier "gemacht"?
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Es hat ein Proton aufgenommen.
| | Benzol + Sauerstoff --> Kohlenstoffdioxid + Wasser |
| * Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind?
| |
| {{Lösung versteckt|
| |
| Basen.
| |
| |Lösung|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
|
| Jetzt zur unteren Gleichung (NH<sub>3</sub> wird in Wasser eingeleitet): Was hat das Wassermolekül hier "gemacht"?
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Es hat ein Proton abgegeben.
| | * Benzol (Trivialname, müsst ihr aktuell noch nocht wissen, daher ist chem. Formel angegeben): '''C<sub>6</sub>H<sub>6</sub>''' |
| * Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | | * Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' |
| | * Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' |
| | * Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' |
| | * C<sub>6</sub>H<sub>6</sub> + O<sub>2</sub> --> CO<sub>2</sub> + H<sub>2</sub>O |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Säuren.
| | '''2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O''' |
| |Lösung|Lösung ausblenden}} | | |Ausgleichen|Lösung ausblenden}} |
| |Lösung|Lösung ausblenden}} | | |Chemische Formeln aufstellen|Lösung ausblenden}} |
| | |
| Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''.
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
|
| |
|
| {{Box-spezial
| | |Edukte und Produkte festlegen|Lösung ausblenden}} |
| |Titel=<span style="color:#607">'''Der Einfluss des Wassers'''</span> | |
| |Inhalt=
| |
| Diese Eigenschaft von Wasser führt dazu, dass beim Zugeben von einer '''Säuren''' (egal welcher) zu Wasser '''saure Lösungen''' entstehen, die alle eine Gemeinsamkeit haben: Sie enthalten das Oxonium-Ion H<sub>3</sub>O<sup>+</sup>:<br>
| |
| [[Datei:SäBa3_divSä_undH2O.jpg|800px]]<br>
| |
| <br>
| |
| Ähnliches gilt für Basen. Egal welche '''Basen''' man in Wasser gibt, es entstehen immer '''basische Lösungen''', die das Hydroxid-Ion enthalten OH<sup>-</sup>:<br>
| |
| [[Datei:SäBa3_divBa_undH2O.jpg|800px]]<br>
| |
| <br>
| |
| Allerdings gibt es noch eine andere Stoffgruppe, die zu '''basischen Lösungen''' führt, in denen OH<sup>-</sup>-Ionen enthalten sind: Nämlich Hydroxid-Salze, wie z.B. NaOH oder KOH oder Ca(OH)<sub>2</sub>. All diese Salze lösen sich in Wasser und setzen dabei Hydroxid-Ionen frei, ohne dass eine chemische Reaktion mit Wasser stattfinden müsste. Das Ergebnis ist aber ein ähnliches wie mit NH<sub>3</sub>, es entsteht eine '''basische Lösung''', die Hydroxid-Ionen enthält:<br>
| |
| [[Datei:SäBa3_NaOH_und_H2O_V2.jpg|800px]]<br>
| |
| Das '''"(aq.)"''' bedeutet, diese Teilchen liegen frei beweglich im Wasser vor und sind '''von Wasserteilchen umringt''', kurz: Sie sind '''aquatisiert'''.
| |
| <br>
| |
| Schüttet man nun eine '''saure Lösung''' und eine '''basische Lösung''' zusammen, so reagieren eigentlich nicht die Säure und die Base direkt miteinander, sondern die bereits vorher durch den Kontakt mit Wasser gebildeten Oxonium-Ionen H<sub>3</sub>O<sup>+</sup> mit den Hydroxid-Ionen OH<sup>-</sup>:<br>
| |
| [[Datei:SäBa3_H3O_und_OH.jpg|800px]]<br>
| |
| <br>
| |
| Diese Reaktion führ zu einer Verringerung der Oxonium- bzw. Hydroxid-Ionen, die für den sauren bzw. basischen Charakter verantwortlich waren. Die entstehende Lösung ist also weder sauer noch basisch sondern neutral. '''Man kann also sagen, Säuren und Basen neutralisieren sich gegenseitig.'''
| |
| <br>
| |
| Schüler formulieren folgende Aufgabe oft "stark vereinfacht":
| |
| * Formuliere die Neutralisationsgleichung für die Reaktion von Natronlauge mit Salzsäure:
| |
| <br>
| |
| Lösung der Schüler: HCl + NaOH --> H<sub>2</sub>O + NaCl<br>
| |
| <br>
| |
| Was dabei übersehen wird: '''Salzsäure''' ist nicht das selbe wie '''HCl'''. '''HCl''' ist ein Gas. Wenn dieses in Wasser gelöst wird, entsteht erst die "Salzsäure". Formuliert die Gleichung für diese Reaktion!
| |
| {{Lösung versteckt|
| |
| HCl + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup>(aq.) + Cl<sup>-</sup>(aq.)<br>
| |
|
| |
|
| |Lösung|Lösung ausblenden}}
| | Beschreibe den Aufbau des Stoffs '''Kohlenstoffdioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! |
| <br>
| |
| Auch NaOH ist nicht das gleiche wie Natronlauge. Diese entsteht erst durch Lösen von NaOH in Wasser. Formuliert die Gleichung für diese Reaktion!
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| NaOH --> Na<sup>+</sup>(aq.) + OH<sup>-</sup>(aq.)
| | Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Kohlenstoff- und zwei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. |
| |Lösung|Lösung ausblenden}} | | |Lösung|Lösung ausblenden}} |
| Man sollte also besser formulieren: <br>
| |
| [[Datei:SäBa3_NaOH_und_HCl_mit_H2O.jpg]]<br>
| |
|
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#060">'''Hausaufgabe'''</span>
| |
| |Inhalt=
| |
| 1. Formuliert die Reaktion von folgenden Stoffen mit Wasser:
| |
| * Schwefelsäure
| |
| * Iodsäure (HIO<sub>3</sub>)
| |
| 2. Formuliert die Neutralisationsreaktion von Schwefelsäure H<sub>2</sub>SO<sub>4</sub> mit Calciumhydroxid Ca(OH)<sub>2</sub><br>
| |
| <br>
| |
| Die Lösung für diese Aufgaben braucht ihr nicht über den Schulmanager zu schicken. Wir verbessern sie gemeinsam in der nächsten Videokonferenz am Dienstag, 02.03.
| |
|
| |
|
| |Farbe= #080 | | |Farbe= #080 |
| Zeile 300: |
Zeile 143: |
| |Hintergrund= #DFB | | |Hintergrund= #DFB |
| }} | | }} |
|
| |
|
| |
| === Distanzunterricht Dienstag, 23.02. ===
| |
| * In der ersten Stunde sollt ihr einige Aufgaben zu Aldehyden und Ketonen lösen. Ladet dazu zunächst den Hefteintrag von letzter Stunde herunter, sofern ihr das noch nicht getan habt: [[Spezial:FilePath/21_Carbonyl_physik_HeftalsABML.pdf| pdf-Datei]]. Druckt ihn aus und klebt ihn ins Heft oder schreibt ihn ab.<br>
| |
| * Lest den Hefteintrag durch. Solltet ihr Verständnisschwierigkeiten haben, empfehle ich die S. 102 - 104 im Buch bevor ihr weiter macht!
| |
| * In der zweiten Stunde sollt ihr anhand eines Videos chemische Reaktionen kennenlernen, mit denen man Aldehyde und Keton voneinander auf Stoffebene unterscheiden kann!
| |
| * Zunächst aber die Aufgaben:
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Aufgaben zu Aldehyden und Ketonen'''</span> | | |Titel=<span style="color:#080">'''Nr. 3''': Phosphortribromid und Wasser reagieren zu Diphosphortrioxid und Wasserstoffbromid.</span> |
| |Inhalt= | | |Inhalt= |
| Aldehyde haben deswegen deutlich niedrigere Siedepunkte als vergleichbar schwere Alkohole, weil bei Aldehyden eine starke '''zwischenmolekulare Anziehungskraft''' fehlt. Welche?
| | |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Die '''Wasserstoffbrückenbindungen '''sind nur bei Alkoholen möglich.<br>
| | 2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr |
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} |
| <br> | | <br> |
| Begründe, warum das so ist!
| | '''oder Schritt für Schritt:''' |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_WarumAldehydeKeineHBBbilden.jpg]]
| |
| |Lösung 2|Lösung ausblenden}}
| |
| |Lösung 1|Lösung ausblenden}}<br>
| |
| <br> | | <br> |
| Recherchiert zunächst die Siedepunkte von den folgenden Stoffen:
| | |
| * Ethan, Ethanal und Ethanol
| |
| * Octan, Octanal und Octanol
| |
| * Am besten geht das, indem ihr diese Begriff bei [https://de.wikipedia.org/wiki/Wikipedia:Hauptseite Wikipedia] ins Suchfeld eingebt und dann in der rechten Tabelle schaut.
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| * Ethan -89°C, Ethanal + 20°C und Ethanol + 78°C
| | Phosphortribromid + Wasser --> Diphosphortrioxid + Wasserstoffbromid |
| * Octan +126°C, Octanal + 171°C und Octanol + 195°C
| | |
| Es geht jetzt um die '''Differenzen dieser Werte'''. Erläutere, warum die '''Differenzen '''zwischen den Werten der langkettigen Moleküle (Octan, Octanal, Octanol) geringer sind als die zwischen den kurzkettigen (Ethan, Ethanal, Ethnol)
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C10NTG_SdpDiffBeiGrMolekGeringer.jpg]]
| | * Phosphortribromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''PBr<sub>3</sub>''' |
| |Lösung |Lösung ausblenden}}
| | * Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' |
| |Lösung 1|Lösung ausblenden}}
| | * Diphosphortrioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''P<sub>2</sub>O<sub>3</sub>''' |
| <br> | | * Wasserstoffbromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''HBr''' |
| In eurem Buch ist die Hydratbildung bei Propanon beschrieben (S. 104 Randspalte). Überprüfe, ob es sich bei dieser Reaktion um einen Redoxprozess handelt!
| | * PBr<sub>3</sub> + H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + HBr |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C10NTG_HydratbildungKetonKeineRedox.jpg]]
| | '''2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr''' |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}} | | |Ausgleichen|Lösung ausblenden}} |
| <br><br>
| | |Chemische Formeln aufstellen|Lösung ausblenden}} |
| Bearbeitet auch die folgenden Aufgaben:<br>
| |
|
| |
|
| [[Datei:C10NTG_CarbonylAufgaben_1.jpg]]<br>
| | |Edukte und Produkte festlegen|Lösung ausblenden}} |
| <br>
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_1_ML.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| <br>
| |
| [[Datei:C10NTG_CarbonylAufgaben_2.jpg]]<br>
| |
| <br>
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_2_ML.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| [[Datei:C10NTG_CarbonylAufgaben_3.jpg]]<br>
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_3_ML.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| <br>
| |
| [[Datei:C10NTG_CarbonylAufgaben_4.jpg]]<br>
| |
| {{Lösung versteckt|
| |
| Das einfachste ist wohl eine lineare Kette von Kohlenstoffatomen ohne Verzweigungen. Das solltest Du auf jeden Fall haben!
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_4_MLT1.jpg]]<br>
| |
| Gut, dann folgen diejenigen Moleküle, bei denen die Hauptkette ein C-Atom kürzer ist, dafür aber eine Methyl-Seitenkette vorhanden ist. Davon gibt es mehrere!
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_4_MLT2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| Dann gibt es noch eine Variante mit einer Ethyl-Seitenkette
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_4_MLT3.jpg]]<br>
| |
| Warum kann diese Ethylgruppe nicht am Kohlenstoffatom C3 sitzen?
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_4_MLT4.jpg|800px]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| Und zum Schluss noch mehrere Varianten mit zwei Methylgruppen
| |
| {{Lösung versteckt|
| |
| [[Datei:C10NTG_CarbonylAufgaben_4_MLT5.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Hab ich!|Lösung ausblenden}}<br>
| |
| |Tipp 1|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Ende des ersten Teils'''
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Reaktion zum Unterscheiden von Aldehyden und Ketonen'''</span>
| |
| |Inhalt=
| |
| Schaut zunächst das folgende Video, in dem die theoretischen Grundlagen erklärt werden: <br>
| |
| {{#ev:youtube|VGZjDBEwQ2A}}<br>
| |
| <br>
| |
| <br>
| |
| Hier ein Video, in dem die Fehlingsche Probe als Versuch gezeigt wird (3:47min):
| |
| {{#ev:youtube|vRbJowQskIE}}<br>
| |
| <br>
| |
| Hier ein Video, in dem die Tollens-Probe als Versuch gezeigt wird (2:34min):
| |
| {{#ev:youtube|PcyllKiqGyE}}<br>
| |
| <br>
| |
| Das folgende Arbeitsblatt enthält bereits teilweise den Hefteintrag, allerdings fehlen noch die chemischen Redoxgleichungen für die Reaktion von Ethanal zur Propansäure einmal bei der Fehlingschen Probe und einmal bei der Tollens-Probe. Stellt diese chemischen Gleichungen auf! Hier gibt es das Arbeitsblatt: als [[Spezial:FilePath/23_AldeKeto_U_Fehl_Tollens_AA.pdf| pdf-Datei]] (es muss nicht ausgedruckt werden!). Tipps:
| |
| * Falls ihr die Valenzstrichformeln von Ethanal und/oder Ethansäure nicht kennt: Recherchiert auf Wikipedia!
| |
| * Die Reduktions-Teilgleichungen könnt ihr dem Text entnehmen!
| |
| * Um den Ladungsausgleich durchzuführen benötigt man H<sub>3</sub>O<sup>+</sup> oder OH<sup>-</sup>-Ionen. Welche verwendet werden dürfen, entscheidet das Millieu! Achtet auf die "Zutaten" bei der Fehlingschen bzw. Tollens-Probe!
| |
| * Die Lösung gibt es erst nächste Stunde!
| |
| <br><br>
| |
| Hausaufgabe (es sollte innerhalb der 90min. noch Zeit dafür sein): Buch S. 98-99 lesen. Falls noch Zeit übrig ist: A1-A3 auf diesen Seiten erledigen!
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| === Distanzunterricht Donnerstag, 18.02., 8. Std. ===
| |
|
| |
|
| {{Box-spezial
| | Beschreibe den Aufbau des Stoffs '''Disphosphortrioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! |
| |Titel=<span style="color:#080">Versuche mit Indikatoren</span>
| |
| |Inhalt=
| |
| ''Für diesen Versuch benötigt ihr:''
| |
| * Einen '''Indikator '''(z.B. Blaukrautsaft oder Hagebutten-Tee - ihr dürft natürlich auch beide ausprobieren)
| |
| ** Herstellung des Blaukraut-Indikators: (siehe auch Online-Einheit vor Weihnachten): Schneidet zwei bis drei Blätter eines frischen Rotkohls-Kopfes klein, übergießt die Stücke mit wenig Wasser uns lasst diesen Ansatz 10 Minuten stehen. Gelegentlich umrühren.
| |
| ** Herstellung des Hagebutten-Indikators: Einfach einen Hagebutten-Teebeutel mit heißem Wasser übergießen und 10min. warten.
| |
| * eine Säure, z.B. Zitronensaft oder Essig
| |
| * Waschpulver (nur eine Prise)
| |
| <br>
| |
| ''Theoretischer Hintergrund:''<br>
| |
| '''Säuren''' haben in der Chemie einen '''Gegenspieler'''. Das bedeutet, es gibt Substanzen, welche die Wirkung von Säuren aufheben können. Was dabei auf Teilchenebene passiert, betrachten wir nächste Woche. Heute sollt ihr dieses "Gegenspieler-Prinzip" in einem Versuch auf Stoffebene kennenlernen.<br>
| |
| <br>
| |
| ''Versuchsdurchführung mit '''Blaukrautsaft''' als Indikator'':<br>
| |
| * Gebt etwas von eurem Blaukrautsaft in ein durchsichtiges Gefäß.
| |
| * Je nachdem, wie intensiv gefärbt euer Saft ist, könnt ihr ihn auch etwas verdünnen. Durch ein mit dem Saft gefülltes, normales Wasserglas solltet ihr problemlos hindurchschauen können.
| |
| * Die Farbe dieses (verdünnten Blaukraut-Saftes) sollte zunächst violett sein.
| |
| * Tropft ganz wenig Zitronensaft oder Essig dazu.
| |
| * Ihr solltet einen deutlichen '''Farbumschlag '''nach rot erkennen.
| |
| * Bis hierhin nichts neues. Das habt ihr auch vor Weihnachten schon mal gemacht. Gebt die Hälfte dieses Zitronen/Essig-Blaukrautsaftes in ein zweites Glas und streut jetzt eine Prise Waschpulver dazu. Macht vom Ergebnis ein Foto (es sollten beide Gläser zu erkennen sein)
| |
| * Versucht nun mit Zitronensaft wieder die rote Farbe zu erzeugen und dann mit Waschpulver wieder rückgängig zu machen!
| |
| <br>
| |
| ''Versuchsdurchführung mit '''Hagebutten-Tee''' als Indikator'':<br>
| |
| * Gebt etwas von eurem Hagebutten-Tee in ein durchsichtiges Gefäß.
| |
| * Die Farbe dieses Hagebutten-Tees sollte zunächst rot sein.
| |
| * Streut jetzt eine Prise Waschpulver dazu
| |
| * Ihr solltet einen deutlichen '''Farbumschlag '''nach grün/braun erkennen.
| |
| * Versucht nun mit Zitronensaft wieder die rote Farbe zu erzeugen und dann mit Waschpulver wieder rückgängig zu machen!
| |
| <br>
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:SäBa_Ind_Hagebutte_ZitrWaschp.jpg]]
| | Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus zwei Phosphor- und drei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. |
| |Bei mir sieht das so aus|Lösung ausblenden}}<br> | | |Lösung|Lösung ausblenden}} |
|
| |
|
| ''Ergebnis'':<br>
| |
| Waschpulver enthält offensichtlich einen Stoff, der in der Lage ist, die von Säuren hervorgerufene Farbänderung wieder rückgängig zu machen. Solche Stoffe nennt man '''Basen'''.
| |
| <br><br>
| |
| ''Aufräumen'':<br>
| |
| Den Rest den Rotkohls legt ihr wieder dorthin, wo ihr ihn her habt. Zitronenreste in Müll. Essig zurück stellen. Inhalt der Gläser in Abguss, Gläser in Spülmaschine oder selbst spülen, abtrocken und zurück in den Schrank. Mit einem feuchten Tuch über die Arbeitsfläche wischen, trockenen. Fertig!
| |
| |Farbe= #080 | | |Farbe= #080 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 461: |
Zeile 181: |
| |Hintergrund= #DFB | | |Hintergrund= #DFB |
| }} | | }} |
| <br>
| | |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Verbesserung der Hausaufgabe'''</span> | | |Titel=<span style="color:#007">'''Nr. a)''' Aluminium und Chlor reagieren zu Aluminiumchlorid</span> |
| |Inhalt= | | |Inhalt= |
| Solltet ihr heute noch keine 90min. mit Chemie verbracht haben, verbessert bitte die Hausaufgabe (die beiden untersten Tabellen auf dem AB - falls ihr es nicht mehr habt: [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB.pdf| pdf-Datei]]). Notiert euch, welche Aufgaben ihr falsch hattet, dann können wir in der nächsten Videokonferenz am Montag schauen, wo die Probleme lagen.<br>
| | |
| <br>
| |
| '''Die ersten drei: Kaliumsulfat, Aluminiumphosphat, Natriumcarbonat''' - sind eigentlich einfach
| |
| {{Lösung versteckt|
| |
| Falls ihr die Lösung nicht sofort erkennt:
| |
| * Überlegt welche Ionen Kalium bildet (erkennt man anhand der Position im PSE)
| |
| * Der Begriff "...sulfat" ist eindeutig. Ähnlich wie eine Vokabel müsst die chemische Formel dafür auswendig kennen - oder nachschlagen.
| |
| {{Lösung versteckt|
| |
| * K bildet einfach positiv geladene Ionen: K<sup>+</sup>
| |
| * ...sulfat bedeutet SO<sub>4</sub><sup>2-</sup>
| |
| * Der letzte Schritt ist die Überlegung, in welchem Verhältnis diese beiden Ionen zusammengesetzt werden müssen, damit ein insgesamt "nicht geladenes", neutrales Salz entsteht: 2 K<sup>+</sup>-Teilchen und 1 SO<sub>4</sub><sup>2-</sup>-Teilchen. Damit lautet die Formel K<sub>2</sub>SO<sub>4</sub> (Die Ladungen werden in der chemischen Gleichung für ein Salz nicht mehr geschrieben).
| |
| <br>
| |
| Für die anderen beiden solltet ihr das jetzt alleine hinbekommen!
| |
| {{Lösung versteckt|
| |
| * Aluminiumphosphat:
| |
| ** Al bildet dreifach positiv geladene Ionen: Al<sup>3+</sup>
| |
| ** ...phosphat bedeutet PO<sub>4</sub><sup>3-</sup>
| |
| ** Die Formel muss also lauten AlPO<sub>4</sub>
| |
| * Natriumcarbonat:
| |
| ** Na bildet einfach positiv geladene Ionen: Na<sup>+</sup>
| |
| ** ...carbonat bedeutet CO<sub>3</sub><sup>2-</sup>
| |
| ** Die Formel muss also lauten Na<sub>2</sub>CO<sub>3</sub>
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 2|Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Die nächsten zwei: Magnesiumdihydrogenphosphat, Aluminiumsulfat'''
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| * geht im Prinzip geht genauso:
| | 2 Al + 3 Cl<sub>2</sub> --> 2 Al<sub>2</sub>O<sub>3</sub> |
| * Mg bildet zweifach positiv geladene Ionen: Mg<sup>2+</sup>
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} |
| * ...dihydrogenphosphat bedeutet H<sub>2</sub>PO<sub>4</sub><sup>-</sup>
| |
| * Jetzt taucht allerdings ein Problem auf: Ein neutrales Salz entsteht, wenn pro Mg<sup>2+</sup>-Teilchen '''zwei '''H<sub>2</sub>PO<sub>4</sub><sup>-</sup>-Teilchen vorliegen. Um das in einer chemischen Formel anzuzeigen, benutzt man Klammern:<br>
| |
| <br> | | <br> |
| Mg(H<sub>2</sub>PO<sub>4</sub>)<sub>2</sub><br>
| | '''oder Schritt für Schritt:''' |
| <br> | | <br> |
| O.k., jetzt ihr: Aluminiumsulfat!
| | |
| {{Lösung versteckt|
| |
| * Aluminiusulfat:
| |
| ** Al bildet dreifach positiv geladene Ionen: Al<sup>3+</sup>
| |
| ** ...sulfat bedeutet SO<sub>4</sub><sup>2-</sup>
| |
| ** Damit ein neutrales Salz entsteht braucht man 2 Al<sup>3+</sup> und 3 SO<sub>4</sub><sup>2-</sup>: Die Formel muss also lauten Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}
| |
| <br>
| |
| '''Die letzten zwei: Calciumnitrat, Ammoniumhydrogencarbonat'''
| |
| {{Lösung versteckt|
| |
| * Calciumnitrat:
| |
| ** Ca bildet zweifach positiv geladene Ionen: Ca<sup>2+</sup>
| |
| ** ...nitrat bedeutet NO<sub>3</sub><sup>-</sup>
| |
| ** Die Formel muss also lauten Ca(NO<sub>3</sub>)<sub>2</sub>
| |
| <br>
| |
| Vielleicht wisst ihr bei der letzten Aufgabe nicht, was Ammonium... bedeutet. Das ist die Bezeichnung für ein positiv geladenes Molekül: NH<sub>4</sub><sup>+</sup>. Der Rest funktioniert genauso.
| |
| {{Lösung versteckt|
| |
| * Ammoniumhydrogencarbonat:
| |
| ** Ammonium... bedeutet NH<sub>4</sub><sup>+</sup>
| |
| ** ...hydrogencarbonat bedeutet HCO<sub>3</sub><sup>-</sup>
| |
| ** Die Formel muss also lauten NH<sub>4</sub>HCO<sub>3</sub> oder NH<sub>4</sub>(HCO<sub>3</sub>)
| |
| |Lösung |Lösung ausblenden}}
| |
| |Lösung bzw. Hinweis 1|Lösung ausblenden}}
| |
| <br><br>
| |
| Die zweite Tabelle ist deutlich einfacher, weil man keine mathematischen Überlegungen anstellen muss!
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Hast Du alle Zellen ausgefüllt?
| | Aluminium + Chlor --> Aluminiumchlorid |
| {{Lösung versteckt|
| |
| Sicher?
| |
| {{Lösung versteckt|
| |
| [[Datei:SäBa_Salznamen_abgel_Säurerest.jpg]]
| |
| |Jaaa!!!|Lösung ausblenden}}<br>
| |
| |Ja!|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Mittwoch, 17.02.===
| |
| | |
| Heute mal eine etwas andere Aufgabe. Ihr habt in den letzten Unterrichtseinheiten die '''Carbonyl-Verbindungen''' kennengelernt, also organische Stoffe, die eine '''Doppelbindung zu einem Sauerstoff-Atom''' enthalten. Man unterscheidet '''Aldehyde''', bei denen diese Carbonyl-Gruppe am Ende einer Kohlenstoffkette hängt und '''Ketone''', bei denen die Carbonyl-Gruppe nicht am Ende einer Kohlenstoffkette hängt. Als Reinstoffe sind viele Aldehyde und Ketone reizend oder sogar sehr giftig, in kleinen Mengen kommen sie aber z.B. in Lebensmitteln vor und verleihen ihnen einen typischen Geschmack oder Geruch. <br>
| |
| <br>
| |
| '''Eure Aufgabe für heute: '''
| |
| * Sucht bei euch zu Hause Lebensmittel oder andere Stoffe, die Carbonylverbindungen enthalten.
| |
| * Stellt '''mindestens fünf''' schön nebeneinander auf den Tisch.
| |
| * Macht kleine Schildchen, auf denen der Name der Carbonylverbindung steht, die in dem Stoff enthalten ist.
| |
| * Fotografiert das! Schickt mir das Foto als Antwort auf den Arbeitsauftrag im Schulmanager (kommt am Anfang der Unterrichtsstunde).
| |
| * ''Hinweise:'' Bevor ihr das Foto macht, stellt an der Kamera die Qualität/Auflösung niedriger ein. Oft schickt ihr Fotos, deren Dateigröße gigantisch ist. In einer so hohen Auflösung wird das Bild aber nie gebraucht!
| |
| * ''Noch mehr Hinweise:'' Wenn ihr Lebensmittel anschneidet oder Verpackungen öffnet, stellt sicher, dass sie anschließend auch verzehrt werden!
| |
| <br>
| |
| Ein Beispiel, wie eine solche Kollage aussehen könnte, findet ihr im Arbeitsauftrag, der über den Schulmanager kommt<br>
| |
| <br>
| |
| Eine kleine Hilfestellung mit Beispielen von Carbonylverbindungen in Lebensmitteln. Ihr könnt auch auf der Zutaten- oder Inhaltsstoff-Liste von z.B. Lebensmitteln oder Kosmetikprodukten nach Carbonyl-Verbindungen suchen. Die Strukturformeln für die hier genannten Verbindungen findet ihr z.B. in eurem Buch auf S. 109 oder ihr klickt auf den Link, der zu einer Wikipedia-Seite führt (ihr braucht den ganzen Wikipedia-Artikel natürlich nicht zu lesen, aber der Abschnitt "Vorkommen" ist oft interessant):
| |
| * '''Vanillin''' (z.B. enthalten in: '''Vanille '''und damit natürlich in allen Produkten, die Vanille o. Vanillezucker enthalten), https://de.wikipedia.org/wiki/Vanillin Wikipedia-Link]
| |
| * '''Benzaldehyd''' (z.B. enthalten in: '''Bittermandelöl''' und damit natürlich in allen Produkten, die Bittermandelöl enthalten), [https://de.wikipedia.org/wiki/Benzaldehyd Wikipedia-Link]
| |
| * '''Zimtaldehyd''' (z.B. enthalten in: '''Zimtrinde''' und damit natürlich in allen Produkten, die Zimt enthalten), [https://de.wikipedia.org/wiki/Zimtaldehyd Wikipedia-Link]
| |
| * '''Himbeerketon''' (z.B. enthalten in: ''Ratet doch mal!'' - Richtig: In '''Himbeeren'''!), [https://de.wikipedia.org/wiki/Himbeerketon Wikipedia-Link]
| |
| * '''Muscon''' (z.B. enthalten in: '''Moschus''' - ein Sekret von Tieren, heutzutage aber eher künstlich hergestellt. Viele Kosmetikprodukte wie Seifen und Parfums enthalten Moschus), [https://de.wikipedia.org/wiki/Muscon Wikipedia-Link]
| |
| * '''Campher''' (wird aus einem Baum gewonnen und extrem vielseitig verwendet. Häufig ist es '''in Medizinprodukten gegen Erkältungsbeschwerden''' zu finden), [https://de.wikipedia.org/wiki/Campher Wikipedia-Link]
| |
| | |
| === Distanzunterricht Donnerstag, 18.02., 6. Std.===
| |
| | |
| Heute mal eine etwas andere Aufgabe. Ihr habt in den letzten Unterrichtseinheiten einige Dinge über '''Säuren '''gelernt. Hauptsächlich, dass sie auf Teilchen-Ebene in der Lage sind, '''ein Proton (oder mehrere) abzuspalten'''. Aber auch, dass sie in der Lage sind bestimmte '''Farbstoffe umzufärben'''. Die meisten Säuren, die man im Unterricht der 9. Jahrgangsstufe bespricht, sind relativ aggressiv und daher gefährlich, wie z.B.: Schwefelsäure, Salzsäure oder Salpetersäure. <br>
| |
| Es gibt aber eine ganze Reihe von Säuren, die in kleinen Mengen in Lebensmitteln vorkommen und (in der Regel) positive Auswirkungen auf den Geschmack haben. Wenn ihr schon einmal Kochsendungen gesehen habt, dann kennt ihr vielleicht solche Sätze wie <br>
| |
| * „Diese Barbecue-Sauce mit Rhabarber besticht durch ein feines Säurespiel“ oder
| |
| * „Ein leichtes Gericht mit schönem Säurespiel, das Gusto auf mehr macht…“ oder
| |
| * „…süß und von öliger Textur, fein und sehr edel mit elegantem Säurespiel und nachhaltigem Fruchtgeschmack.“
| |
| <br>
| |
| '''Eure Aufgabe für heute: '''
| |
| * Sucht bei euch zu Hause Lebensmittel, die Säuren enthalten.
| |
| * Stellt '''mindestens fünf''' schön nebeneinander auf den Tisch.
| |
| * Macht kleine Schildchen, auf denen der Name der Säure steht, die in dem Lebensmittel enthalten ist.
| |
| * Fotografiert das! Schickt mir das Foto als Antwort auf den Arbeitsauftrag im Schulmanager (kommt am Anfang der Unterrichtsstunde)
| |
| * ''Hinweise:'' Bevor ihr das Foto macht, stellt an der Kamera die Qualität/Auflösung niedriger ein. Oft schickt ihr Fotos, deren Dateigröße gigantisch ist. In einer so hohen Auflösung wird das Bild aber nie gebraucht!
| |
| * ''Noch mehr Hinweise:'' Wenn ihr Lebensmittel anschneidet oder Verpackungen öffnet, stellt sicher, dass sie anschließend auch verzehrt werden!
| |
| <br>
| |
| Ein Beispiel, wie eine solche Kollage aussehen könnte, findet ihr im Arbeitsauftrag, der über den Schulmanager kommt<br>
| |
| <br>
| |
| Eine kleine Hilfestellung mit Beispielen von Säuren in Lebensmitteln. Ihr könnt aber auch auf der Zutaten- oder Inhaltsstoff-Liste von Lebensmitteln nach Säuren suchen:
| |
| * '''Zitronensäure '''(enthalten in: Zitrusfrüchten)
| |
| * '''Milchsäure '''(enthalten in: Milch und Milchprodukten)
| |
| * '''Essigsäure '''(enthalten in: Essig oder Essig haltigen Produkten, z.B. Senf)
| |
| * '''Äpfelsäure '''(enthalten in: Äpfeln – aber eigentlich in allen Zellen fast jedes Lebewesens)
| |
| * '''Weinsäure '''(enthalten in: Wein – Achtung! Fragt erst bei euren Eltern nach, ob ihr Wein verwenden dürft)
| |
| * '''Phosphorsäure '''(enthalten in: Cola)
| |
| * '''Ameisensäure '''(enthalten in: Honig)
| |
| * '''Kohlensäure '''(enthalten in: Erfrischungsgetränken)
| |
| | |
| | |
| === Distanzunterricht Donnerstag, 11.02. (Chemie)===
| |
| Hallo 10e!<br>
| |
| <br>
| |
| Ihr solltet bereits folgendes Wissen: Säuren sind Stoffe, die Protonen abgeben können; Basen sind Stoffe, die Protonen aufnehmen können. In der letzten Stunde hatte ich das Gefühl, dass diese Inhalte noch nicht bei allen so ganz tief verwurzelt sind. Daher würde ich die Inhalte in dieser Einheit noch einmal etwas vertiefter wiederholen.<br>
| |
| Im folgenden Video ist von einem Arbeitsblatt die Rede: [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB.pdf| pdf-Datei]]. Ihr könnt es euch ausdrucken, um damit zu arbeiten, das ist aber nicht unbedingt nötig! Ihr könnt es auch nur in einem zweiten Fenster öffnen und die Lösungen für die Aufgaben auf ein Blatt schreiben. Morgen erhaltet ihr das komplett ausgefüllte Arbeitsblatt zum Herunterladen.<br>
| |
| Für diese Online-Einheit braucht ihr vorerst nur einen Zettel und einen Stift.
| |
| * Schaut zunächst das folgende Video.
| |
| * Vervollständigt dann die Tabellen, die im Video bereits angefangen wurden.
| |
| * Im Anschluss an die Einheit könnt ihr einen Hefteintrag herunterladen, den ihr bitte ins Heft abschreibt oder ausdruckt und einklebt.
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Säuren auf Stoff- und Teilchenebene'''</span>
| |
| |Inhalt=
| |
| {{#ev:youtube|W_z2iXy23ao}}<br>
| |
| <br>
| |
| Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgabe(n): <br>
| |
| * Ergänzt auf dem AB die im Video bereits begonnen Tabellen. Für die Namen der Säure-Reste könnt ihr im Internet recherchieren (was aber umständlich ist, weil die Informationen oft sehr fachwissenschaftlich ausgedrückt sind) oder ihr verwendet euer Buch auf der S. 101.
| |
|
| |
|
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_Säuren_Protolysegleichungen.jpg]]
| | * Aluminium (Element, nicht Bestandteil von HONClBrIF): '''Al''' |
| |Lösung für erste Tabelle|Lösung ausblenden}}<br>
| | * Chlor (Element, Bestandteil von HONClBrIF): '''Cl<sub>2</sub>''' |
| | * Aluminiumchlorid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): |
| | ** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> |
| | ** Chlor steht in der 7. Hauptgruppe --> bildet in Salzen immer 1fach negativ geladene Anionen: Cl<sup>-</sup> |
| | ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei Cl<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''AlCl<sub>3</sub>''' |
| | * Al + Cl<sub>2</sub> --> AlCl<sub>3</sub> |
|
| |
|
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_Säuren_Protolysegleichungen2.jpg]]
| | '''2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub>''' |
| |Lösung für zweite Tabelle|Lösung ausblenden}}<br>
| | |Ausgleichen|Lösung ausblenden}} |
| | | |Chemische Formeln aufstellen|Lösung ausblenden}} |
| Jetzt noch den Hefteintrag herunterladen:[[Spezial:FilePath/C9NTG_PP21_Säuren_Heft.pdf| pdf-Datei]] <br>
| |
| und bis morgen die Seiten 50-51 (Galvani Chemie S2) lesen!
| |
| | |
| |Farbe= #607 | |
| |Rahmen= 0 | |
| |Rahmenfarbe= #DCF | |
| |Hintergrund= #DCF | |
| }} | |
|
| |
|
| === Distanzunterricht Mittwoch, 10.02.===
| | |Edukte und Produkte festlegen|Lösung ausblenden}} |
| Für diese Einheit benötigt ihr euer Schulbuch, Stift und Zettel. Dauer: 30 - 45min.<br>
| |
| <br>
| |
| Heute sollt ihr eine '''neue Stoffklasse''' kennenlernen. So richtig "neu" ist sie nicht. Ihr habt den Namen der '''charakteristischen Molekülgruppe''' schon bei der Oxidation von Alkoholen kennengelernt: Sowohl bei der Oxidation von sekundären Alkoholen als auch bei der von primären Alkoholen entsteht im ersten Schritt ein Molekül, in dem eine '''Doppelbindung zwischen einem C- und einem O-Atom''' vorkommt. Diese Gruppe heißt '''"Carbonyl-Gruppe"'''.<br>
| |
| Wie ihr bei den Alkoholen gesehen habt, spielt der Ort im Molekül, an dem eine Hydroxy-Gruppe gebunden ist, teilweise eine Rolle für das Reaktionsverhalten (prim. und sek. Alkohole lassen sich oxidieren, tert. Alkohole nicht). Bei Molekülen mit einer Carbonylgruppe gibt es ebenfalls deutliche Unterschiede im Reaktionsverhalten, je nachdem, ob die Carbonylgruppe am Ende der C-Kette oder irgendwo in der Mitte sitzt. Daher unterscheidet man bei '''"Carbonyl-Verbindungen"''' die '''Aldehyde''' (Carbonylgruppe sitzt am Ende einer C-Kette) und die '''Ketone''' (Carbonylgruppe sitzt nicht am Ende einer C-Kette).
| |
|
| |
|
| {{Box-spezial
| | Beschreibe den Aufbau des Stoffs '''Aluminiumchlorid''' unter Verwendung von Fachbegriffen so genau wie möglich! |
| |Titel=<span style="color:#607">'''Wiederholung'''</span>
| |
| |Inhalt=
| |
| Legt zunächst eine Tabelle mit zwei Spalten und mindestens 5 Zeilen an: Füllt in jeder Zeile die linke Zelle mit dem Begriff einer euch bereits bekannt funktionellen Gruppe und zeichnet die einfachste organische Verbindung dazu. In die Zelle rechts kommt der Name der entsprechenden Gruppe. Je nachdem, was ihr als funktionelle Gruppe zählt, solltet ihr MINDESTENS fünf Stoffklassen finden!
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Ich hoffe, ihr habt verstanden, was gemeint ist, hier vielleicht mal ein Beispiel:<br>
| | Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 1fach negativ geladenen Chlorid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. |
| [[Datei:StoffklassenAlkan_Keton_AABsp.jpg]]<br>
| | |Lösung|Lösung ausblenden}} |
| <br>
| |
| Jetzt aber: Noch mindestens 4 weitere Zeilen!
| |
| {{Lösung versteckt|
| |
| [[Datei:StoffklassenAlkan_Keton_Teil1.jpg]]<br>
| |
| [[Datei:StoffklassenAlkan_Keton_Teil2.jpg]]
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br> | |
|
| |
|
| |Farbe= #607 | | |Farbe= #007 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Physikalische Eigenschaften'''</span> | | |Titel=<span style="color:#007">'''Nr. d)''' Zink(II)-oxid reagiert mit Kohlenstoff zu Zink und Kohlenstoffdioxid</span> |
| |Inhalt= | | |Inhalt= |
| Wie immer zu Beginn einer neuen Stoffklasse sollen die physikalischen Eigenschaften stehen: Siedepunkte und Löslichkeit: <br>
| | |
| * Schlagt euer Buch auf der S. 102 - 103 auf. Lest aber noch nicht den Text!
| |
| * Analysiert die Tabelle auf S. 102 unten: Notiert euch stichpunktartig eine Begründung für die letzten beiden Spalten, in der die Löslichkeit verschiedener Aldehyde in Wasser und Benzin angegeben werden. Die Begründung ist die gleiche wie sie bereits bei der homologen Reihe der Alkohole zum Tragen kam. Ihr solltet das also können. Nur wenn ihr nicht weiter wisst, lest den Abschnitt, der über der Tabelle beginnt: "Löslichkeit der Alkanale" (Aldehyde).
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Tipp: Simila similibus solvunter (Ähnliches löst sich in Ähnlichem!
| | 2 ZnO + C --> 2 Zn + CO<sub>2</sub> |
| {{Lösung versteckt|
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} |
| Wasser ist polar, Benzin unpolar. Aldehyde enthalten sowohl unpolare Anteile als auch polare, nämlich die Carbonylgruppe. Bei kleinen Aldeyhden nimmt die Carbonylgruppe einen großen Teil des Moleküls ein und es kann insgesamt als "eher polar" bezeichnet werden. Kleine Aldehyde besitzen daher eine gewisse Löslichkeit in Wasser.<br>
| | <br> |
| Mit zunehmender Größe spielen die polaren Molekülteile jedoch eine immer geringere Rolle, daher nimmt die Löslichkeit mit steigender Größe ab.
| | '''oder Schritt für Schritt:''' |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| * Analysiert dann die Abb. 2 auf der S. 103 (das ist die linke Grafik) auf S. 103 oben: Notiert euch stichpunktartig eine Begründung für den Verlauf der Siedepunkte der Aldehyde, vor allem im Vergleich zu ähnlich schweren Alkoholen bzw. Alkanen. Auch hier hatten wir bei den Alkoholen schon eine Begründung, die bei den Aldehyden ebenfalls angewendet werden kann. Ihr solltet das also können. Nur wenn ihr nicht weiter wisst, lest den Abschnitt "Siedetemperaturen der Alkanale" (Aldehyde).
| |
| {{Lösung versteckt|
| |
| Tipp: Zwischenmolekulare Kräfte!
| |
| {{Lösung versteckt|
| |
| * Um Stoffe zum '''Sieden''' (in den gasförmigen Zustand) zu überführen, müssen die '''Moleküle voneinander getrennt''' werden (1 BE). (Achtung, beliebter Schüler-Fehler: Es müssen die Molekül-Teilchen voneinander getrennt werden, nicht die Atome eines Moleküls - das wäre ein Bindungsbruch). Dazu müssen die '''Zwischenmolekularen Kräfte''' (1 BE) überwunden werden.
| |
| * Bei Alkanen existieren nur schwache van-der-Waals-Kräfte (1 BE), diese nehmen mit der Größe des Moleküls zu (1 BE)
| |
| * Bei Alkoholen existieren zusätzlich noch '''starke Anziehungskräfte''' aufgrund der '''Dipoleigenschaften '''(1 BE) des Alkoholmoleküls an der Hydroxygruppe (1 BE)
| |
| * Bei Alkoholen besteht zudem noch die Möglichkeit der Ausbildung '''sehr starker Wasserstoffbrückenbindungen''' (1 BE), zwischen dem über eine stark polare Atombindung gebundenen H-Atom (1 BE) der Hydroxyruppe und dem freien Elektronenpaar des O-Atoms
| |
| * Bei Aldehyden können keine Wasserstoffbrückenbindungen (1 BE) gebildet werden, weil kein H-Atom existiert, das über eine stark polare Atombindung gebunden ist. Dipoleigenschaften haben Aldehyd-Moleküle allerdings auch. Daher liegen die Siedepunkte von Aldehyden höher (1 BE) als die vergleichbar großer/schwerer Alkane aber niedriger (1 BE) als vergleichbar großer/schwerer Alkohole.
| |
| <br><br>
| |
| Zähle, wie viele BE (in Klammern angegeben) du erreicht hättest! >85% entspricht der Note 1, <20% entspricht der Note 6 (das würde in der Oberstufe so gelten).
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Lösung|Lösung ausblenden}}<br> | |
| | |
| * Lest nun die restlichen Abschnitte auf den S. 102 - 104 (auch die Randspalten!)
| |
| * Einen Hefteintrag wird es nächste Stunde (Dienstag, 16.02. Videokonferenz) geben, wenn wir die Benennung von Aldehyden und Ketonen etwas genauer betrachtet haben.<br>
| |
| * Als Hausaufgabe (oder jetzt, wenn die 45min noch nicht aufgebraucht sind) bearbeitet ihr die Aufgabe 3 auf der S. 104. Ein Foto eurer Lösung schickt ihr mir als Antwort auf den Arbeitsauftrag, den ihr um 09:00 Uhr über den Schulmanager erhalten haben solltet!
| |
| | |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| | |
| === Distanzunterricht Dienstag, 09.02.===
| |
| In dieser Einheit ist von einem Arbeitsblatt die Rede: [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB.pdf| pdf-Datei]]. Ihr könnt es euch ausdrucken, um damit zu arbeiten, das ist aber nicht unbedingt nötig! Ihr könnt es auch nur in einem zweiten Fenster öffnen und die Lösungen für die Aufgaben auf ein Blatt schreiben. Am Ende der Lerneinheit (vermutlich Do, 11.02.) erhaltet ihr das komplett ausgefüllte Arbeitsblatt zum Herunterladen.<br>
| |
| Für diese Online-Einheit braucht ihr vorerst nur einen Zettel und einen Stift.
| |
| * Schaut zunächst das folgende Video.
| |
| * Vervollständigt dann die Tabellen, die im Video bereits angefangen wurden.
| |
| * Löst die weiteren Aufgaben hier im WIKI
| |
| * Im Anschluss an die Einheit könnt ihr einen Hefteintrag herunterladen, den ihr bitte ins Heft abschreibt oder ausdruckt und einklebt.
| |
| | |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Säuren auf Stoff- und Teilchenebene'''</span>
| |
| |Inhalt=
| |
| {{#ev:youtube|W_z2iXy23ao}}<br>
| |
| <br> | | <br> |
| Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgabe(n): <br>
| |
| * Ergänzt auf dem AB die im Video bereits begonnen Tabellen. Für die Namen der Säure-Reste könnt ihr im Internet recherchieren (was aber umständlich ist, weil die Informationen oft sehr fachwissenschaftlich ausgedrückt sind) oder ihr verwendet euer Buch auf der S. 101.
| |
|
| |
|
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_Säuren_Protolysegleichungen.jpg]]
| | Zink(II)-oxid + Kohlenstoff --> Zink + Kohlenstoffdioxid |
| |Lösung für erste Tabelle|Lösung ausblenden}}<br>
| |
|
| |
|
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9NTG_Säuren_Protolysegleichungen2.jpg]]
| | * Zink(II)-oxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): |
| |Lösung für zweite Tabelle|Lösung ausblenden}}<br>
| | ** Zink steht in einer Nebengruppe. Welche Ionen Zink bildet ist daher nicht ganz klar. Die römische Zahl in der runden Klammer gibt aber die Ladung des Zink-Kations im Salz an: 2fach positiv --> Zn<sup>2+</sup> |
| | ** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup> |
| | ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, muss pro Zn<sup>2+</sup>-Ion ein O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''ZnO''' |
| | * Kohlenstoff (Element, kein Bestandteil von HONClBrIF): '''C''' |
| | * Zink (Element, kein Bestandteil von HONClBrIF): '''Zn''' |
| | * Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' |
| | * ZnO + C --> Zn + CO<sub>2</sub> |
|
| |
|
| Jetzt noch den Hefteintrag herunterladen:[[Spezial:FilePath/C9NTG_PP21_Säuren_Heft.pdf| pdf-Datei]] <br>
| | {{Lösung versteckt| |
| und bis zum nächsten Mal die Seiten 100 - 101 lesen!
| | '''2 ZnO + C --> 2 Zn + CO<sub>2</sub>''' |
| | | |Ausgleichen|Lösung ausblenden}} |
| |Farbe= #607 | | |Chemische Formeln aufstellen|Lösung ausblenden}} |
| |Rahmen= 0 | |
| |Rahmenfarbe= #DCF | |
| |Hintergrund= #DCF | |
| }} | |
|
| |
|
| === Distanzunterricht Montag, 08.02. ===
| | |Edukte und Produkte festlegen|Lösung ausblenden}} |
| Für diese Online-Einheit benötigt ihr ca. 30min. Solltet ihr tatsächlich 15min. oder mehr übrig haben, empfehle ich die Teilnahme am Rhythmus-Projekt der Sportfachschaft (s. Startseite des WIKIs: oben rechts.)<br>
| |
| <br>
| |
| Ihr benötigt für diese Einheit evtl. das Schulbuch, einen Zettel und Stift. Langfristig wollen wir auf das Thema "Säuren" zu steuern. Heute allerdings zunächst eine "Überleitungs-Stunde", in der einige bereits bekannte Sachen aufgearbeitet werden. Am Ende der Einheit könnt ihr einen Hefteintrag herunterladen, den ihr entweder in euer Heft abschreibt oder ausdruckt und einklebt.
| |
|
| |
|
| {{Box-spezial
| | Beschreibe den Aufbau des Stoffs '''Zinkoxid''' unter Verwendung von Fachbegriffen so genau wie möglich! |
| |Titel=<span style="color:#607">'''Einstieg/Wiederholung'''</span>
| |
| |Inhalt=
| |
| Versucht im folgenden Bild '''möglichst genau''' zu beschreiben, was die eingekringelten Symbole bedeuten sollen. (In beiden Fällen wird das gleiche symbolisiert, es sind nur unterschiedliche Varianten.) In eurer Beschreibung sollte der Begriff "Elektronegativität (EN)" vorkommen. <br>
| |
| [[Datei:SäBa1_polAtombdg_Darstellung.jpg|400px]]<br>
| |
| Am besten macht ihr das wirklich schriftlich, damit ihr eure Lösung mit der hier angegebenen nachträglich gut überprüfen könnt!<br>
| |
| <br>
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Die eingekreisten Symbole stehen für eine "polare Atombindung".<br>
| | Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 2fach positiv geladenen Zink-Kationen und 2fach negativ geladenen Oxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. |
| Beide Begriffe, '''polar '''und '''Atombindung''', sollte man nun erklären. <br>
| |
| Eine '''Atombindung '''entsteht, wenn zwei Atome jeweils ein Elektron zur Verfügung stellen und dieses Elektronenpaar sich zwischen den beiden Atomkernen aufhalten kann und dadurch zu einer Anziehung der beiden Partner führt. <br>
| |
| '''Polar '''sind Atombindungen dann, wenn einer der beiden Bindungspartner in der Lage ist, das bindende Elektronenpaar stärker zu sich zu ziehen. Die beiden Elektronen haben dann eine hohe Aufenthaltswahrscheinlichkeit nicht genau in der Mitte zwischen den Atomkernen sondern bei dem Bindungspartner, der die höhere Elektronegativität (EN) hat. Der Keil, bzw. der Pfeil zeigen diese Verschiebung des Elektronenpaars hin zum elektronegativeren Partner an.
| |
| <br>
| |
| <br>
| |
| Wenn euch diese Begriffe nichts mehr sagen, dann lest jetzt sofort im Buch die Seiten 63 - 64 Mitte!
| |
| |Lösung|Lösung ausblenden}} | | |Lösung|Lösung ausblenden}} |
| <br>
| | |
| |Farbe= #607 | | |Farbe= #007 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
| <br>
| | |
| <br>
| |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Trennung von Atombindungen'''</span> | | |Titel=<span style="color:#007">'''Nr. f)''' Aluminiumhydroxid reagiert zu Aluminiumoxid und Wasser</span> |
| |Inhalt= | | |Inhalt= |
| Schaut nun das folgende Video (ca. 15min.). Nach dem Video solltet ihr in der Lage sein, die Aufgaben darunter zu lösen!<br>
| | |
| {{#ev:youtube|mNEBKOf8T44}}<br>
| | {{Lösung versteckt| |
| | 2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O |
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} |
| <br> | | <br> |
| '''Aufgaben:'''<br> | | '''oder Schritt für Schritt:''' |
| * Formuliere eine chemische Gleichung für den Lösungsvorgang von Aluminiumchlorid
| |
| {{Lösung versteckt|
| |
| Ich hoffe, Du hast die richtige chemische Formel für Aluminiumchlorid?
| |
| {{Lösung versteckt|
| |
| * Nur so als Tipp: Aluminium steht in der 3. Hauptgruppe. Welche Ionen bildet es also?
| |
| * Chlor steht in der 7. Hauptgruppe. Bildet also welche Ionen?
| |
| * Was für eine Zusammensetzung muss ein Salz haben, das aus diesen Ionen aufgebaut ist und insgesamt neutral (also nicht geladen) sein soll?
| |
| {{Lösung versteckt|
| |
| Die chemische Formel für Aluminiumchlorid lautet AlCl<sub>3</sub>. Jetzt also bitte die Gleichung für den Lösungsvorgang!
| |
| {{Lösung versteckt|
| |
| [[Datei:AlCl3_gelöst_inWasser.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
| |Hab ich!|Lösung ausblenden}}
| |
| |Sicher!|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| <br> | | <br> |
| Ihr habt im Film die "Heterolytische Bindungstrennung" kennengelernt. Erkläre, was dieser Begriff bedeutet. Schriftlich! Mit dem Stift auf ein Blatt, bitte!
| | |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Liegt in einem Molekül eine polare Atombindung zwischen zwei verschiedenen Atomen vor, dann kann diese Bindung getrennt werden, indem ein Partner beide Bindungselektronen bekommt, der andere gar keins.
| | Aluminiumhydroxid --> Aluminiumoxid + Wasser |
| |Lösung|Lösung ausblenden}}
| |
|
| |
|
| Hier noch einmal die heterolytische Bindungstrennung in Form verschiedener chemischer Gleichungen: <br>
| |
| [[Datei:SäBa1_heterolytBdgTrennung_Gleichung.jpg|600px]]<br>
| |
| <br> Dieser "Spezialfall" einer heterolytischen Bindungstrennung, bei der ein H<sup>+</sup>-Teilchen abgespalten wird, hat einen eigenen Namen. Nenne den Namen und erkläre seine Herkunft!
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Protolyse: '''Lyse''' bedeutet hier Abspaltung. '''"Proto"''' kommt hier von Proton: Ein Wasserstoffatom besteht nur aus einem Proton im Kern und einem Elektron in der Hülle. Wird das Elektron abgegeben, bleibt nur das positiv geladene Proton zurück. Daher Protolyse: Abspaltung eines Protons
| | * Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): |
| |Lösung|Lösung ausblenden}}
| | ** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> |
| | ** "Hydroxid" ist ein feststehender Begriff für das Molekül-Ion OH<sup>-</sup>. |
| | ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei OH<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al(OH)<sub>3</sub>''' |
| | * Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): |
| | ** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> |
| | ** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup>. |
| | ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro zwei Al<sup>3+</sup>-Ionen drei O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al<sub>2</sub>O<sub>3</sub>''' |
| | * Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' |
| | * Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + H<sub>2</sub>O |
|
| |
|
| Stelle nach dem gleichen Muster die chemischen Gleichungen (beide Varianten: mit und ohne Valenzstrichformel) für die heterolytische Bindungstrennung für folgende Säure-Moleküle auf:<br>
| |
| * Hydrogenfluorid (HF)
| |
| * Iodsäure (HIO<sub>3</sub>)
| |
| * Schwefelsäure (H<sub>2<sub>SO</sub>4</sub>)
| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse.jpg|600px]]<br>
| |
|
| |
|
| | {{Lösung versteckt| |
| | '''2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O''' |
| | |Ausgleichen|Lösung ausblenden}} |
| | |Chemische Formeln aufstellen|Lösung ausblenden}} |
|
| |
|
| {{Lösung versteckt|
| | |Edukte und Produkte festlegen|Lösung ausblenden}} |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse_ML1.jpg|600px]]<br>
| |
| Vielleicht habt ihr bei der Schwefelsäure das andere Proton abgespalten. Das funktioniert. Es können sogar beide Wasserstoff-Teilchen gleichzeitig abgespalten werden. Stellt dafür (sofern ihr es noch nicht getan habt) die Gleichungen (mit und ohne Valenzstrichformeln) auf!
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
|
| |
|
| | Beschreibe den Aufbau des Stoffs '''Aluminiumhydroxid''' unter Verwendung von Fachbegriffen so genau wie möglich! |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse_ML2.jpg|600px]]<br>
| | Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 2fach negativ geladenen Hydroxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. |
| |Lösung|Lösung ausblenden}} | | |Lösung|Lösung ausblenden}} |
| <br>
| |
|
| |
|
| Ladet jetzt noch den Hefteintrag herunter, dann seid ihr für heute mit Chemie fertig! Hefteintrag als [[Spezial:FilePath/C9NTG_Heterolyse_Heft.pdf| pdf-Datei]].
| | |Farbe= #007 |
| |Farbe= #607 | |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
| | |
| | === Distanzunterricht Di, 11.05.=== |
| | Da ich heute (Di, 11.05.) und morgen (Mi, 12.05.) aufgrund des Abiturs stark in organisatorische Aufgaben an der Schule eingebunden bin, müsst ihr an diesen beiden Tagen leider alleine klar kommen. Vergesst aber auf keinen Fall am Dienstag bis spätestens 08:15 Uhr eure Rückmeldung auf den "Start-in-den-Tag"-Auftrag im Schulmanager!<br> |
| <br> | | <br> |
| === Distanzunterricht Montag, 08.02.===
| | Ihr erhaltet hier '''drei Arbeitsaufträge''' für die '''drei Chemie-Unterrichtsstunden'''. Ich empfehle euch, jeden Arbeitsauftrag in der Zeit zu erledigen, die angegeben ist. Wenn ihr unbedingt eine andere Reihenfolge wählen wollt: Von mir aus. Für zwei Arbeitsaufträge erhaltet ihr auch im Schulmanager einen Auftrag, auf den ihr bitte eure entsprechend passende Lösung hochladet: |
| Diese Unterrichtsstunde findet im Austausch zur Chemie-Stunde vom kommenden Freitag, 12.02. statt. Es ist die letzte Einheit mit neuen Inhalten. Morgen (Dienstag, 09.02.) findet nur noch eine Abschlussüberprüfung statt, ob ihr die Elektronenbesetzung bei Atomen verstanden habt. <br>
| | * Dienstag, 1. Std. (08:00 - 08:45 Uhr): Knobelaufgaben auf S. 132 lösen - '''Abgabe eines Lösungsvorschlags im Schulmanager erforderlich'''! |
| * Im "normalen" Unterricht würde ich ein Arbeitsblatt austeilen, welches ihr bearbeiten müsst. In dieser Online-Version ist das nicht nötig, es wird ausgefüllt im Hefteintrag zum Herunterladen enthalten sein.<br> | | * Dienstag, 2. Std. (08:45 - 09:30 Uhr): Abschließende Rätsel zum gesamten bislang behandelten Stoff in org. Chemie |
| * Ihr benötigt euer Schulbuch, ein PSE, Stift, Zettel und eine einigermaßen stabile Internetverbindung | | * Mittwoch, 2. Std. (09:45 - 10:30 Uhr): Versuch "CO<sub>2</sub>-Löscher" durchführen und Aufgaben dazu bearbeiten - '''Abgabe eines Lösungsvorschlags im Schulmanager erforderlich'''! Achtung: Die Aufgaben lassen sich auch lösen, wenn man den Versuch nicht durchgeführt hat (z.B. weil ihr kein Backpulver, keinen Essig oder kein Teelicht zu Hause hattet)! |
| * Der passende Hefteintrag kann nach der Einheit hier heruntergeladen werden: [[Spezial:FilePath/C9SG_015_eBau_PSE_Heft.pdf| pdf-Datei]]<br>
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Hausaufgabe'''</span> | | |Titel=<span style="color:#007">Versuch: '''Knobelaufgaben (Säuren und Ester)'''</span> |
| |Inhalt= | | |Inhalt= |
| Je nachdem wie schnell ihr die letzte Online-Einheit erledigt habt, seid ihr evtl. mit der Aufgabe 1 im Buch, S. 70 schon fertig geworden. Falls nicht, bearbeitet diese Aufgabe jetzt und vergleicht dann mit der Lösung. Falls ihr diese Aufgabe schon einmal gelöst habt, dann frischt euer Wissen nur noch einmal kurz wieder auf: Entscheidet euch für eines der vier Atome und bestimmt nur für dieses Atom die Elektronenkonfiguration! <br>
| | Löst in eurem Buch auf der Seite 132 die folgenden Aufgaben: |
| {{Lösung versteckt|
| | * Nr. 1 |
| [[Datei:C9SG_eKonfig_C.jpg]]<br>
| | * Nr. 2 |
| |Lösung C|Lösung ausblenden}}<br>
| | * Nr. 3: Der Begriff "Disproportionierung" ist z.B. hier erklärt: [https://de.wikipedia.org/wiki/Disproportionierung Wikipedia] |
| <br>
| | * Nr. 4 |
| {{Lösung versteckt|
| | * Nr. 7: Evtl. hilft hier der folgende verlinkte Abschnitt: [https://de.wikipedia.org/wiki/Schweiß#Zusammensetzung_und_Eigenschaften_des_menschlichen_Schweißes Wikipedia]. Nur den verlinkten Abschnitt, nicht die ganze Seite lesen (also natürlich dürft ihr das, aber ihr müsst es nicht) |
| [[Datei:C9SG_eKonfig_Ca.jpg]]<br>
| | * Nr. 8: '''Eisessig''' ist eine weitere Bezeichnung für '''reine Essigsäure'''. Diese hat einen Schmelzpunkt von 17°C. Bewahrt man Eisessig daher im Kühlschrank auf, liegt ein (kalter) Feststoff vor. |
| |Lösung Ca|Lösung ausblenden}}<br>
| |
| <br>
| |
| {{Lösung versteckt|
| |
| [[Datei:C9SG_eKonfig_Br.jpg]]<br>
| |
| |Lösung Br|Lösung ausblenden}}<br>
| |
| <br> | | <br> |
| {{Lösung versteckt|
| | Versucht alle Lösungen auf ein Blatt zu bekommen --> Foto davon machen --> auf entsprechenden Arbeitsauftrag im Schulmanager hochladen! |
| [[Datei:C9SG_eKonfig_Pb.jpg]]<br>
| |
| |Lösung Pb|Lösung ausblenden}}<br>
| |
|
| |
|
| |Farbe= #607 | | |Farbe= #007 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
|
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Valenzelektronen'''</span> | | |Titel=<span style="color:#007">'''Rätsel zum bisher behandelten Stoff'''</span> |
| |Inhalt= | | |Inhalt= |
| In der letzten Einheit wurde schon angesprochen, dass '''die Elektronen, die auf der äußersten Schale eines Atoms sitzen''', großen Einfluss auf das Reaktionsverhalten des Stoffes haben. Ein Beispiel: Die Stoffe Lithium, Natrium und Kalium besitzen alle '''ein einzelnes Elektron''' auf der äußersten Schale. Diese '''Gemeinsamkeit '''auf '''Teilchen-Ebene''' (das heißt, man schaut sich in diesem Fall die "Teilchen", also die Atome an) führt zu '''Gemeinsamkeiten '''auf der '''Stoff-Ebene''' (das heißt, man schaut sich an, wie die Stoffe reagieren): Alle drei Stoffe (Li, Na, K) reagieren heftig mit Wasser. Wirft man ein Stücken Li, Na oder K in ein Gefäß mit Wasser, entsteht immer das Gas Wasserstoff und das Wasser fühlt sich danach "seifig" an. Das ist auf die Bildung von "Hydroxid-Ionen" zurückzuführen. Im folgenden Film (1,5min) wurde in das Wasser zusätzlich ein Stoff gegeben, der sich rosa färbt, wenn "Hydroxid-Ionen" entstehen.<br>
| |
| * Schaut den Film
| |
| * Neben den genannten Stoffen Li, Na und K werden noch zwei weitere Stoffe mit Wasser in Kontakt gebracht. Welche?
| |
| * Sucht die fünf im Film verwendeten Stoffe im PSE. Wo stehen sie?
| |
| * Wie schon gesagt, ist die chemische Reaktion in allen Fällen ähnlich. Was ist der Unterschied?
| |
| <br>
| |
| {{#ev:youtube|0coFb_1UzS0}}<br>
| |
| <br>
| |
| {{Lösung versteckt|
| |
| * Es werden auch noch die Stoffe Rubidium und Cäsium verwendet
| |
| * Alle Stoffe stehen im PSE untereinander in der ersten Spalte
| |
| * Die Reaktion wird immer heftiger, je weiter unten im PSE der Stoff steht.
| |
| |Lösung|Lösung ausblenden}}<br>
| |
|
| |
|
| Im Prinzip ist das schon das wichtigste "Geheimnis" der Anordnung der Elemente im PSE: Die Elemente werden so sortiert, dass diejenigen '''untereinander '''stehen, die die gleiche Anzahl an '''Elektronen auf der äußersten Schale''' haben. Diese Elektronen heißen '''Valenzelektronen '''und bestimmen das chemische Reaktionsverhalten.<br>
| | Der folgende Link leitet euch auf eine Seite unseres "alten RMG-Wikis". Dort habe ich vor Jahren eine "Grundwissens-Seite" angelegt. Ich bin noch nicht dazu gekommen, sie ins neue Wiki umzuziehen. |
| Im PSE enthält also eine Spalte (das was von oben nach unten geht) Elemente mit der gleichen Anzahl an Valenzelektronen. Man nennt eine Spalte daher auch "Gruppe" und manche Gruppen haben Namen, die ihr vielleicht schon einmal gehört habt:<br>
| | * Zum einen zeigt euch die Seite kompakt, was ihr in diesem Schuljahr alles schon gelernt habt (bzw. haben solltet) ;) |
| [[Datei:PSE_Bau_u_Ordnung.jpg]]<br>
| | * Darüber hinaus sind einige einfachen Rätsel enthalten. Natürlich könnt ihr euch in einigen Fällen auch nur schnell die Lösung anzeigen lassen und danach sagen "Klar, hätte ich gewusst." Ich empfehle euch aber, euren Lösungsvorschlag zunächst wirklich aufzuschreiben und dann auf den Lösungsbutton zu klicken (sofern einer vorhanden ist). Erst dann könnt ihr euch wirklich sicher sein, dass ihr die korrekte Lösung gewusst hättet. |
| <br>
| | * Hier geht´s zur Grundwissens-Seite: [http://rmg.zum.de/wiki/Grundwissen_Chemie:_10._Klasse_NTG Hier klicken] |
| ''Nur zur Ergänzung: Die Zeilen (das was von links nach rechts geht) heißen Perioden. Weil sich die Eigenschaften der Stoffe von links nach rechts immer wieder (periodisch) wiederholen: Erst kommt ein Alkalimetall, dann ein Erdalkalimetall usw...''<br>
| | |
| Das klappbare PSE, welches die meisten von euch benutzen ist vor allem auch deswegen so schön, weil im zusammengeklappten Zustand ganz oben die alten "Gruppennummern" stehen. (Ich hoffe, das ist bei euch noch so). Im zusammengeklappten Zustand seht ihr nämlich nur die früher als "Hauptgruppen" bezeichneten Gruppen und deren Nummer entspricht genau der Anzahl der Valenzelektronen, die die Elemente in dieser Gruppe haben:<br>
| | |Farbe= #007 |
| [[Datei:PSE_alteBez_HauptuNebengr.jpg]]<br>
| |
| <br>
| |
| Wenn ihr euer PSE aufklappt, dann kommen zunächst die früher als "Nebengruppen" bezeichneten Element zum Vorschein. Diese Unterscheidung macht man heute nicht mehr. Man hat die Haupt- und Nebengruppen neu von links nach rechts durchgehend durchnummeriert. Leider geht dadurch der schöne Zusammenhang mit den Valenzelektronen etwas verloren: Bei den jetzt gültigen Gruppennummern muss man nun immer auf die letzte Ziffer schauen, um zu sehen, wie viele Valenzelektronen die Elemente dieser Gruppe enthalten:
| |
| [[Datei:PSE_neuBez_Gruppen.jpg]]<br>
| |
| <br>
| |
| Überprüft stichpunktartig, ob das alles tatsächlich stimmt:
| |
| * Wählt drei beliebige Element aus (macht es euch nicht unnötig schwer und wählt nur Elemente des komplett eingeklappten PSEs, also nur aus den Hauptgruppen. Und wählt kein Element das in der 5. Periode oder höher steht.).
| |
| * Bestimmt von euren drei gewählten Elementen die Edelgaskonfiguration und überprüft, ob die Anzahl der Valenzelektronen tatsächlich mit der letzten Ziffer der Gruppennummer übereinstimmt!
| |
| * Es gibt eine einzige Ausnahme - vielleicht findet ihr sie ja zufällig... | |
| {{Lösung versteckt|
| |
| [[Datei:PSE_eKonfigHG_bisP4.jpg]]<br> | |
| <br>
| |
| TATSÄCHLICH, es stimmt! :)<br>
| |
| <br>
| |
| Die '''Ausnahme '''ist '''Helium (He)'''. Es steht in der 8. Hauptgruppe (besser: der 18.Gruppe), hat aber nur 2 Valenzelektronen.
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| |Farbe= #607 | |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
| <br>
| | |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Aufgaben'''</span> | | |Titel=<span style="color:#007">Versuch: '''CO<sub>2</sub>-Löscher'''</span> |
| |Inhalt= | | |Inhalt= |
| In Zukunft werdet ihr in der Chemie viele Aufgaben bearbeiten, bei denen man wissen muss, wie viele '''Valenzelektronen '''ein Element hat. Ihr müsst nun nicht mehr umständlich die gesamte Elektronenkonfiguration ableiten, es genügt ein Blick ins PSE: Die Gruppennummer gibt Auskunft!<br>
| | '''Ihr benötigt:''' |
| | * ein schmales Glas, in das gerade so ein Teelicht passt |
| | * ein Teelicht |
| | * ein größeres Gefäß, z.B. Messbecher |
| | * ein Geschirrtuch (o.ä.) |
| | * ein Päckchen Backpulver |
| | * Essig oder besser: Essigessenz |
| <br> | | <br> |
| '''Ein paar Aufgaben zum Überprüfen!''' Ihr solltet für alle nachfolgenden Aufgaben nur wenige Sekunden brauchen. Die einzige Schwierigkeit wird sein, das entsprechende Element im PSE zu finden. Alle Fragen beziehen sich auf Elemente der Hauptgruppen (also des zusammengeklappten PSEs). Sobald ihr das Element gefunden habt, habt ihr automatisch auch die Lösung! <br> | | |
| | '''Durchführung''':<br> |
| | [[Datei:CO2Schütten_V.jpg|800px]]<br> |
| | * Entzündet das Teelicht im schmalen Glas |
| | * Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit |
| | * Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden. |
| | * Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann). |
| | * Zieht nun '''vorsichtig '''das Geschirrtuch ab. Gießt nun das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen! |
| <br> | | <br> |
| Wie viele Valenzelektronen hat Brom (Br)?
| | '''Beobachtung/Erklärung''':<br> |
| | Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie das Ergebnis aussehen könnte. |
| | |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| Brom steht in der '''7. Hauptgruppe''' (besser: '''17. Gruppe''') also muss es '''7 Valenzelektronen''' besitzen.
| | [[Datei:CO2Schütten_V1.gif]] |
| |Lösung|Lösung ausblenden}}<br> | | |Video|Lösung ausblenden}} |
| <br> | | <br> |
| Wie viele Valenzelektronen hat Magnesium (Mg)?
| | Einen Teilprozess bei der Reaktion von Zitronensäure mit dem Hauptbestandteil des Backpulvers, Natriumhydrogencarbonat, kann man vereinfacht so formulieren: <br> |
| {{Lösung versteckt|
| |
| Magnesium steht in der '''2. Hauptgruppe''' (besser: '''2. Gruppe''') also muss es '''2 Valenzelektronen''' besitzen.
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br> | | <br> |
| Wie viele Valenzelektronen hat Aluminium (Al)?
| | NaHCO<sub>3</sub> + H<sub>3</sub>O<sup>+</sup> --> CO<sub>2</sub> + 2 H<sub>2</sub>O + Na<sup>+</sup><br> |
| {{Lösung versteckt|
| |
| Aluminium steht in der '''3. Hauptgruppe''' (besser: '''13. Gruppe''') also muss es '''3 Valenzelektronen''' besitzen.
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br> | | <br> |
| Wie viele Elemente der Hauptgruppen haben genau 1 Valenzelektron?
| | '''Aufgaben''' |
| {{Lösung versteckt|
| | * Begründe unter Angabe von Oxidationszahlen, ob es sich bei diesem Vorgang um eine Redoxreaktion handelt! |
| '''Sieben''': Wasserstoff, Lithium, Natrium, Kalium, Rubidium, Cäsium, Francium | | * Um die Oxidationszahlen in diesen Fällen zu bestimmen ist es zwar nicht nötig, die Valenzstrichformeln dieser Stoffe zu betrachten, trotzdem: Zeichne die Valenzstrichformel von NaHCO<sub>3</sub>, H<sub>3</sub>O<sup>+</sup>, CO<sub>2</sub> und 2 H<sub>2</sub>O |
| |Lösung|Lösung ausblenden}}<br>
| | * Falls es sich Deiner Meinung nach nicht um einen Redoxprozess handeln sollte, gib an, welcher Gruppe von chemischen Reaktionen man diesen Vorgang dann zuordnen könnte |
| | * Nimm zu dem folgenden Satz begründet Stellung: "In diesem Versuch tauchen C-Atome auf, also handelt es sich um organische Chemie" |
| <br> | | <br> |
| Welches Hauptgruppenelement aus der 4. Periode hat fünf Valenzelektronen?
| | Die vier Antworten passen locker auf ein Blatt --> Foto davon machen --> auf entsprechenden Arbeitsauftrag im Schulmanager hochladen! |
| {{Lösung versteckt|
| | |Farbe= #007 |
| '''Arsen'''
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| Welches Hauptgruppenelement aus der 5. Periode hat acht Valenzelektronen?
| |
| {{Lösung versteckt|
| |
| '''Xenon'''
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| |Farbe= #607 | |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
|
| |
|
| {{Box-spezial
| | === Distanzunterricht Di, 11.05. === |
| |Titel=<span style="color:#607">'''Schreibweise'''</span>
| | Ihr dürft heute zwischen zwei Versuchen wählen, die ihr durchführen sollt. Selbstverständlich dürft ihr auch beide machen, aber verpflichtend ist nur einer: |
| |Inhalt=
| |
| Nachdem die Valenzelektronen so eine große Bedeutung für das Reaktionsverhalten eines Stoffes haben, wurde eine Schreibweise entwickelt, mit der man die Zahl der Valenzelektronen einfach darstellen kann: Das Elementsymbol soll stellvertretend für den Atomkern und die inneren Elektronen stehen und für jeden Valenzelektron macht man einen Punkt um das Elementsymbol. In bestimmten Fällen verbindet man zwei Punkte zu einem Strich, so dass dieser Strich also zwei Valenzelektronen symbolisiert. Diese Darstellungsform nennt man '''Valenzstrichschreibweise''': <br>
| |
| [[Datei:PSE_Valenzstrichschreibweise_4Bsp.jpg]]<br>
| |
| <br>
| |
| Aufgabe: Skizziere von den folgenden Elementen jeweils ein Atom in Valenzstrichschreibweise: Magnesium, Aluminium und Stickstoff
| |
| {{Lösung versteckt|
| |
| [[Datei:PSE_Valenzstrichschreib_3BspML.jpg]]<br>
| |
| Wann man Striche und wann Punkte macht, ist auch in eurem Buch an dieser Stelle noch nicht geklärt. Erst später wird das eine Rolle spielen. Im Moment ist nur wichtig, dass ihr die richtige Anzahl an Valenzelektronen findet.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
|
| |Farbe= #607
| | * Den Versuch '''CO<sub>2</sub>-Löscher''' hattet ihr schon vor Weihnachten mal auf, damals aber freiwillig. Wenn ihr ihn damals nicht gemacht habt: Auf geht´s :). <br> Am Ende des Versuchs ist eine Aufgabe gestellt, die ihr bitte bearbeitet und als Antwort auf den Arbeitsauftrag im Schulmanager schickt. |
| |Rahmen= 0
| | * Der Versuch '''Apfel oxidieren''' ist neu. Hier sollt ihr am Ende keine Aufgabe bearbeiten, sondern es geht darum, den Versuch in Form eines "wissenschaftlichen Versuchsprotokolls" möglichst sachlich zu dokumentieren. Denkt immer daran: Ein Versuchsprotokoll besteht aus den Teilen '''"Versuchsaufbau/Durchführung"''' (hier wird beschrieben, was man getan hat), '''"Ergebnisse"''' (hier dokumentiert man in Wort und Bild die Ergebnisse des Versuchs - ohne dafür schon eine "Erklärung" zu geben) und '''"Erklärung/Diskussion"''' (hier versucht man unter anderem, die Ergebnisse zu erklären). |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Hausaufgabe'''</span> | | |Titel=<span style="color:#007">'''CO<sub>2</sub>-Löscher'''</span> |
| |Inhalt= | | |Inhalt= |
| * Lest als Hausaufgabe im Buch, S. 71 und 84 - 85. Es sollte noch genügend Zeit übrig sein, um das innerhalb der laufenden Unterrichtsstunde zu erledigen. | | '''Ihr benötigt:''' |
| * Ladet euch den Hefteintrag inkl. Arbeitsblatt herunter | | * ein schmales Glas, in das gerade so ein Teelicht passt |
| * Wir hören uns morgen zum letzten Mal in einer Videokonferenz um 14:45 Uhr über MS-Teams | | * ein Teelicht |
| * Bis morgen!
| | * ein größeres Gefäß, z.B. Messbecher |
| |Farbe= #607
| | * ein Geschirrtuch (o.ä.) |
| |Rahmen= 0
| | * ein Päckchen Backpulver |
| |Rahmenfarbe= #DCF
| | * Essig oder besser: Essigessenz |
| |Hintergrund= #DCF
| | <br> |
| }}
| |
| | |
| === Distanzunterricht Freitag, 05.02.===
| |
| Für diese Einheit benötigt ihr das folgende Arbeitsblatt (ausgedruckt oder geöffnet in einem anderen Fenster): [[Spezial:FilePath/C9SG_014_Bau_eHülle_Orb_AB.pdf| pdf-Datei]], einen Stift und eine einigermaßen stabile Internetverbindung.<br>
| |
| * Schaut zunächst das folgende Video. | |
| * Am Anfang wird die Hausaufgabe vom letzten Mal verbessert (S. 67 A2 und A3), haltet diese bereit!
| |
| * Das Video ist mit fast 30min. relativ lang geworden, enthält aber viele Aspekte, die ihr schon aus der Physik oder Natur und Technik kennen solltet und dient somit nur der Auffrischung eurer Kenntnisse. | |
| * Für den Chemie-Unterricht sollt ihr im Wesentlichen nur folgende neue Erkenntnis mitnehmen: '''Wo genau halten sich die Elektronen in der Hülle eines Atoms auf?'''
| |
|
| |
|
| {{Box-spezial
| | '''Durchführung''':<br> |
| |Titel=<span style="color:#607">'''Der Bau der Elektronenhülle'''</span>
| | [[Datei:CO2Schütten_V.jpg|800px]]<br> |
| |Inhalt=
| | * Entzündet das Teelicht im schmalen Glas |
| {{#ev:youtube|RowNJYw7lKU}}<br>
| | * Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit |
| | * Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden. |
| | * Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann). |
| | * Zieht nun '''vorsichtig '''das Geschirrtuch ab. Gießt nun das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen! |
| <br> | | <br> |
| Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgabe(n): <br>
| | '''Beobachtung/Erklärung''':<br> |
| * Ergänzt die untere Tabelle auf dem AB
| | Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie das Ergebnis aussehen könnte. |
|
| |
|
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C9SG_014_Bau_eHülle_eKonfig_höher_ML.jpg]] | | [[Datei:CO2Schütten_V1.gif]] |
| |Lösung|Lösung ausblenden}}<br> | | |Video|Lösung ausblenden}} |
| Wenn die 45min. der Unterrichtsstunde schon um sind, dann ladet euch jetzt noch den Hefteintrag herunter: [[Spezial:FilePath/C9SG_014_Bau_eHülle_Orb_Heft.pdf| pdf-Datei]]. Ihr könnt ihn z.B. in euer Heft abschreiben oder ausdrucken und einkleben. Dann seid ihr mit dieser Einheit fertig. Am Dienstag gibt es weitere Aufgaben zu diesem Thema, die ihr alleine bearbeiten und verbessern könnt (keine Videokonferenz).<br>
| | <br> |
| Falls noch Zeit übrig ist, bearbeitet die im Video genannte Aufgabe 1 auf S. 70 in eurem Buch! - Ihr dürft diese Aufgaben aber tatsächlich überspringen, wenn ihr schon seit 45 Minuten arbeitet. Sie werden in der nächsten Einheit ganz am Anfang (teilweise) noch einmal gestellt!
| | Einen Teilprozess bei der Reaktion von Zitronensäure mit dem Hauptbestandteil des Backpulvers, Natriumhydrogencarbonat, kann man vereinfacht so formulieren: <br> |
| {{Lösung versteckt|
| |
| [[Datei:C9SG_eKonfig_C.jpg]]<br>
| |
| <br> | | <br> |
| [[Datei:C9SG_eKonfig_Ca.jpg]]<br>
| | NaHCO<sub>3</sub> + H<sub>3</sub>O<sup>+</sup> --> CO<sub>2</sub> + 2 H<sub>2</sub>O + Na<sup>+</sup><br> |
| <br> | | <br> |
| [[Datei:C9SG_eKonfig_Br.jpg]]<br>
| |
| <br> | | <br> |
| [[Datei:C9SG_eKonfig_Pb.jpg]]<br>
| | '''Aufgabe:'''<br> |
| |Lösung|Lösung ausblenden}}<br>
| | Begründet unter Angabe von Oxidationszahlen, ob es sich bei diesem Vorgang um eine Redoxreaktion handelt! <br> |
|
| |
|
| | Lösungsvorschlag auf Blatt --> Foto machen --> Als Antwort auf Arbeitsauftrag im SM hochladen! |
|
| |
|
| |Farbe= #607 | | |Farbe= #007 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF'''Fett''' | | |Rahmenfarbe= #DFF |
| |Hintergrund= #DCF | | |Hintergrund= #DFF |
| }} | | }} |
|
| |
|
| |
| === Distanzunterricht Dienstag, 02.02.===
| |
| Verbessert gegenseitig eure Hausaufgabe (Buch, S. 42 - Aufgabe 6):
| |
| * Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
| |
| * Besorgt euch einen Rotstift.
| |
| * Macht ein Foto von eurer Hausaufgabe und schickt sie an eure Korrekturpartnerin bzw. euren Korrekturpartner.
| |
| * Druckt dann diese Lösungen, die ihr jetzt erhalten habt, aus. (Wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
| |
| * Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint/Paint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
| |
| * Beachtet dann die unten stehende Musterlösung und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler.
| |
| * Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon).
| |
| * Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
| |
| * Ihr erhaltet ca. um 13:30 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück.
| |
| <br> | | <br> |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Lösungsvorschlag für die Hausaufgabe'''</span> | | |Titel=<span style="color:#607">'''Apfel oxidieren'''</span> |
| |Inhalt= | | |Inhalt= |
| '''S. 42 Aufgabe 6:''' | | '''Material:'''<br> |
| {{Lösung versteckt|
| | Ihr benötigt: |
| [[Datei:C9NTG_chemR_A426_ML_V3.jpg]] | | * Einen Apfel |
| |Lösung|Lösung ausblenden}}<br>
| | * Zitronensaft (frisch oder auch nicht) |
| | * Eine Reibe oder ein Messer |
| | * etwas Geduld... |
| | <br> |
| | '''Durchführung:''' |
| | * Stellt Zitronensaft bereit (evtl. Zitrone auspressen). |
| | * Raspelt auf einer Reibe einen Apfel in kleine Stücke. Solltet ihr keine Raspel haben, dann schneidet den Apfel anders in so kleine Stücke wie möglich. |
| | * Verteilt die Apfelstücke auf zwei Untertassen. Das sind die beiden Ansätze, die ihr später miteinander vergleichen sollt. |
| | * Tropft auf den einen Ansatz Zitronensaft (nicht alles, ihr benötigt später den Saft noch einmal). |
| | * Stellt beide Ansätze für einige Minuten (20-30min) beiseite und vergleicht die Ansätze dann. |
| | <br> |
| | '''Dokumentation:''' |
| | Ich nehme an, ihr wisst was passiert: Die Apfelmasse wird braun. Dokumentiert euer Ergebnis, so gut ihr könnt! Achtet auf die Kriterien, die wir bereits besprochen haben: |
| | * Bei Fotos sollten keine Gegenstände des Hintergrundes zu sehen sein! |
| | * Wenn ihr keine Kamera habt, die für Nahaufnahmen geeignet ist, versucht es doch mit einer Skizze (tatsächlich mit Stift und Blatt oder auch am PC)! |
| | * Bilder brauchen dringend eine aussagekräftige Abbildungsbeschriftung! |
| | <br> |
| | '''Erklärung:''' |
| | * Recherchiert, woher die Braunfärbung kommt. Eine Seite im Internet, die relativ kurz und dabei verständlich ist, gibt es z.B. hier: [https://www.wochenblatt.com/natur-warum-wird-der-apfel-braun-12475358.html#:~:text=Zu%20viel%20frische%20Luft&text=Sauerstoff%20aus%20der%20Luft%20gelangt,Apfels%20bewirkt%20sie%20eine%20Braunfärbung. Zur Homepage] - Wenn sich die Seite öffnet, erscheint in der Regel zunächst ein Fenster, in dem "Privatsphäre-Informationen" angezeigt werden. Klickt auf "Einstellungen verwalten" unten links. Deaktiviert alle grünen Haken die bei "Legitimes Interesse" stehen (sollten 9 Stück sein). Ich bin mir ziemlich sicher: '''NIEMAND''' hat ein '''legitimes Interesse''' daran, eure Aktionen im Internet zu verfolgen! |
| | * Versucht die auf der Seite beschriebenen Zusammenhänge '''zeichnerisch''' darzustellen! - Im Text ist zum Beispiel von Chinonen die Rede. Deren chemische Formel wisst ihr zwar nicht, aber ihr könnt ja ein Symbol verwenden, z.B. eine geometrische Figur wie ein Sechseck. Vielleicht schafft ihr es auf diese Weise sogar so etwas ähnliches wie eine Redoxgleichung darzustellen (natürlich ohne Koeffizienten oder Indizes). |
| | * Auf der Seite steht, dass man die Braunfärbung von Äpfeln auch nachträglich mit Zitronensaft wieder aufheben kann. Probiert das! |
| | <br><br> |
| | Fertigt nun ein richtiges Versuchsprotokoll mit den einleitend beschriebenen Teilen (Durchführung, Ergebnisse, Erklärung) an. Es sollte alles auf eine Seite passen! --> Foto machen --> Als Antwort auf Arbeitsauftrag im Schulmanager hochladen |
|
| |
|
| |Farbe= #607 | | |Farbe= #607 |
| Zeile 1.031: |
Zeile 482: |
| }} | | }} |
|
| |
|
| === Distanzunterricht Mittwoch, 03.02.=== | | === Distanzunterricht Donnerstag, 20.05., 8.Std.=== |
| In der folgenden Einheit geht es um die Frage, ob man generell alle Alkohole oxidieren kann. Schaut zunächst das Video (ca. 19min.) und bearbeitet dann die folgenden Aufgaben!
| |
| | |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Oxidation verschiedener Alkoholtypen'''</span> | | |Titel=<span style="color:#607">'''Oberflächenspannung des Wassers'''</span> |
| |Inhalt= | | |Inhalt= |
| {{#ev:youtube|8nYsGQgmK3Q}}<br>
| | Zum Abschluss vor den Ferien ein Versuch zum Thema Wasser, den ihr sicher schon mal selbst ausprobiert habt: Lasst eine Büroklammer auf dem Wasser schwimmen!<br> |
| <br> | | <br> |
| Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgaben: <br>
| | '''benötigtes Material'''<br> |
| * Buch, S. 87 Aufgabe 2: Es sind die Alkohole '''Ethandiol''' und '''Propan-1,2-diol''' gegeben. Beide sollen getrennt voneinander mit saurer Permanganatlösung oxidiert werden. Gesucht sind die Strukturformelen der entstehenden Produkte! (Nicht mehr! - Keine Gleichungen o.ä.) | | * kleines Glas |
| {{Lösung versteckt|
| | * Büroklammern |
| [[Datei:C10NTG_S87A2_ML.jpg]]
| | * Wasser |
| Die verwendeten Valenzstrichformeln stammen teilweise von Wikipedia. Sie sind gemeinfrei. Trotzdem kann man den Urheber nennen:<br> | | * Spülmittel |
| *Von NEUROtiker - Eigenes Werk, Gemeinfrei, [https://commons.wikimedia.org/w/index.php?curid=3223135 Link zur Brenztraubensäure] | | '''Durchführung'''<br> |
| *Von NEUROtiker - Eigenes Werk, Gemeinfrei, [https://commons.wikimedia.org/w/index.php?curid=3223135 Link zur 2-Oxo-Propansäure] | | * Verwendet ein kleines Glas, das ihr randvoll mit Wasser macht. |
| | * Legt eine Büroklammer auf den Glasrand und schiebt sie vorsichtig auf die Wasseroberfläche. |
| | * Die Büroklammer muss absolut trocken und fettfrei sein. |
| | * Mache ein Foto, bei dem mindestens drei Büroklammern auf der Wasseroberfläche schwimmen! |
| | * Gebt auf euren Finger einen Tropfen Spülmittel |
| | * Bringt den Tropfen auf die Wasseroberfläche mit der Büroklammern. Nicht direkt auf eine Büroklammer, sondern nur in die Nähe. |
|
| |
|
| |Lösung|Lösung ausblenden}}<br>
| |
| * Formuliert sowohl die Teilgleichungen als auch die Gesamtgleichung für die Redoxreaktion von Butan-1-ol zu Butanal mit saurer Permanganatlösung. (Aufgabe steht auch unter dem Hefteintrag)
| |
| {{Lösung versteckt| | | {{Lösung versteckt| |
| [[Datei:C10NTG_Redox_Butanol_al_MnO4_sauer.jpg]] | | [[Datei:C9NTG_Wasser_Oberflächenspannung.jpg]]<br> |
| |Lösung|Lösung ausblenden}}<br> | | Diese Foto wäre nicht gültig, weil eine von den drei Büroklammern bereits untergegangen ist... |
| * Ladet euch jetzt den Hefteintrag herunter : [[Spezial:FilePath/C10NTG_Redox_Alk_Typen.pdf| pdf-Datei]]<br>
| | |Beispiel|Lösung ausblenden}} |
| | |
|
| |
|
| | '''Theorie'''<br> |
| | * Warum die Büroklammer schwimmt, wenn man sie vorsichtig auf die Wasseroberfläche legt ist in eurem Buch auf der S. 87, 2. Absatz in Verbindung mit der Abb. 6 erklärt! |
| | * Versucht andere kleine Gegenstände, die normalerweise untergehen, auf der Wasseroberfläche schwimmen zu lassen! |
| | * Warum hat es keinen Sinn diesen Versuch mit Öl anstatt mit Wasser durchzuführen? |
| | <br><br> |
| | '''Schöne Ferien euch allen!''' |
| | <br> |
| |Farbe= #607 | | |Farbe= #607 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF'''Fett''' | | |Rahmenfarbe= #DCF |
| |Hintergrund= #DCF | | |Hintergrund= #DCF |
| }} | | }} |
|
| |
|
| == Arbeitsauftrag 27.04. == | | === Distanzunterricht Dienstag, 18.05.=== |
| Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.<br>
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Säure-Base-Reaktionen'''</span> | | |Titel=<span style="color:#080">'''Fotosynthese'''</span> |
| |Inhalt= | | |Inhalt= |
| Das nächste Kapitel beschäftigt sich den Stoffgruppen der "Säuren" und deren Gegenspielern, den "Basen".<br>
| | In der letzten Biologie-Einheit ging es um den Umweltfaktor '''Temperatur'''. Ihr habt "Tiergeographische Regeln" kennengelernt, die einen Zusammenhang zwischen der Temperatur im Lebensraum und Körpermerkmalen bei Tieren herstellt. Bitte ladet euch den entsprechenden Hefteintrag dazu herunter, speichert ihn oder druckt ihn aus und klebt ihn ins Heft oder schreibt ihn einfach ab.<br> |
| |Farbe= #607 | | Heute soll es um einen anderen Umweltfaktor gehen: '''Licht'''. Auch Tiere werden teilweise sehr stark vom Licht beeinflusst, bevor wir dazu kommen, betrachten wir aber Pflanzen. Für sie ist die regelmäßige Versorgung mit Licht überlebensnotwendig.<br> |
| | Ihr habt sicherlich in eurer Schullaufbahn schon einmal die '''Fotosynthese''' besprochen, also den Prozess, bei dem Pflanzen mit Hilfe von Sonnenlicht die Stoffe Kohlenstoffdioxid und Wasser in Traubenzucker und Sauerstoff umwandeln. <br> |
| | Das folgende Video ist ziemlich alt. Die darin enthaltenen Versuche jedoch unschlagbar gut in Szene gesetzt. Schüler eines W-Seminars wollten mit mir diese Versuche schon einmal nachmachen und filmen, aber wir sind schlimm gescheitert. Umso größer ist die Anerkennung für die "Macher" des Videos.<br> |
| | Das Video zeigt nacheinander vier Versuche und dauert insgesamt ca. 18 Minuten. Stoppt das Video nach jeder Versuchseinheit und notiert euch: |
| | * Wie könnte eine "Überschrift" für den Versuch heißen? |
| | * Stellt den '''Versuchsaufbau''' grafisch dar (keinen Text, sondern nur einfache Skizzen). |
| | * Notiert in einem Satz das Ergebnis des Versuchs. |
| | * ''Zeitbedarf:'' Pro Versuch solltet ihr ca. 5 Minuten für die Bearbeitung der Aufgaben brauchen, im "schlimmsten" Fall also 20 Minuten. Mit Anschauen insgesamt 38 Minuten - müsste zu schaffen sein! :)<br> |
| | <br> |
| | |
| | {{#ev:youtube|J9KwbIdNXo0}} |
| | |
| | |Farbe= #080 |
| |Rahmen= 0 | | |Rahmen= 0 |
| |Rahmenfarbe= #DCF | | |Rahmenfarbe= #DFB |
| |Hintergrund= #DCF | | |Hintergrund= #DFB |
| }} | | }} |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Einstieg/Wiederholung'''</span>
| |
| |Inhalt=
| |
| Versucht im folgenden Bild '''möglichst genau''' zu beschreiben, was die eingekringelten Symbole bedeuten sollen. (In beiden Fällen wird das gleiche symbolisiert, es sind nur unterschiedliche Varianten.) In eurer Beschreibung sollte der Begriff "Elektronegativität (EN)" vorkommen. <br>
| |
| [[Datei:SäBa1_polAtombdg_Darstellung.jpg|400px]]<br>
| |
| Am besten macht ihr das wirklich schriftlich, damit ihr eure Lösung mit der hier angegebenen nachträglich gut überprüfen könnt!<br>
| |
| <br> | | <br> |
| {{Lösung versteckt|
| | |
| Die eingekreisten Symbole stehen für eine "polare Atombindung".<br>
| | === Distanzunterricht Dienstag, 18.05. === |
| Beide Begriffe, '''polar '''und '''Atombindung''', sollte man nun erklären. <br>
| | Heute mal was kreatives! Aber schon auch eine fachliche Vorbereitung auf das letzte Kapitel in diesem Schuljahr: '''Biomoleküle'''.<br> |
| Eine '''Atombindung '''entsteht, wenn zwei Atome jeweils ein Elektron zur Verfügung stellen und dieses Elektronenpaar sich zwischen den beiden Atomkernen aufhalten kann und dadurch zu einer Anziehung der beiden Partner führt. <br>
| | In diesem letzten Kapitel sollt ihr vieles, was ihr über '''organische Verbindungen''' bisher gelernt habt auf Moleküle übertragen, die für Lebewesen eine wichtige Rolle spielen. Tatsächlich solltet ihr in '''Biologie '''über diese Moleküle bereits gesprochen haben. Und genau aus diesem Grund bekommt ihr jetzt auch diese Aufgabe gestellt: Verarbeitet euer bereits vorhandenes Wissen über die '''Kohlenhydrate''', '''Fette '''und '''Eiweiße '''zu einem ästhetisch anspruchsvollen, '''wissenschaftlichen Poster'''!<br> |
| '''Polar '''sind Atombindungen dann, wenn einer der beiden Bindungspartner in der Lage ist, das bindende Elektronenpaar stärker zu sich zu ziehen. Die beiden Elektronen haben dann eine hohe Aufenthaltswahrscheinlichkeit nicht genau in der Mitte zwischen den Atomkernen sondern bei dem Bindungspartner, der die höhere Elektronegativität (EN) hat. Der Keil, bzw. der Pfeil zeigen diese Verschiebung des Elektronenpaars hin zum elektronegativeren Partner an. | | Wissenschaftliche Poster sind zu einem beliebten Mittel geworden, um kleinere (aber auch größere) Forschungsarbeiten übersichtlich und anschaulich zu präsentieren. Wenn ihr euch genauer über "wissenschaftliche Poster" informieren wollt, dann könnt ihr z.B. folgenden Links folgen: |
| |Lösung|Lösung ausblenden}}
| | * Die Studienwerkstatt der Uni-Bremen hat ein pdf-Dokument mit etlichen Tipps zusammengestellt: [https://www.uni-bremen.de/fileadmin/user_upload/sites/studierwerkstatt/Leitfaden_wissenschaftliche_Poster_erstellen.pdf Hier klicken] |
| | * In dem pdf-Dokument sind auch zwei Seiten verlinkt, auf denen man bereits fertige wissenschaftliche Plakate anschauen kann: [https://www.geo.uni-halle.de/geooekologie/pr/poster/ Zum Beispiel hier] oder [https://projects.ncsu.edu/project/posters/ExamplePosters.html hier] |
| | * So ein richtig wahnsinnig schönes yt-Video habe ich auf die Schnelle leider nicht gefunden. Ihr könnt natürlich "wissenschaftliches Poster" bei Google oder Youtube eingeben und ihr werdet tausende von Treffern erhalten, aber die ersten fünf, die ich mir angeschaut habe, hatten alle irgendwelche Haken. |
| | <br> |
| | <br> |
| | '''Ein paar einfache Tipps''': |
| | * Verwendet ein '''Präsentationsprogramm''', um ein Poster zu erstellen. Hier lassen sich Texte, Bilder, Grafiken etc. am einfachsten anordnen und formatieren. |
| | * '''Hochformat '''ist günstiger (Entwurf --> Foliengröße --> Benutzerdefinierte Foliengröße --> "4:3" und "Hochformat" auswählen) |
| | * Geht sparsam mit grellen '''Farben''' und/oder Kontrasten um. Bleibt am besten in einer "Farbfamilie". |
| | * Poster werden in der Regel relativ groß ausgedruckt (DIN A2, A1 oder sogar A0), daher könnt ihr auch sehr kleine '''Schriftgröße''' (10pt) verwenden. Diese sind immer noch gut lesbar. '''ABER ACHTUNG:''' |
| | * '''Niemand '''will ein Poster lesen, das Gigatonnen an '''Text''' enthält! Versucht eure fachlichen Inhalte gut zu '''veranschaulichen'''. |
| | <br> |
| | <br> |
| | '''Inhalt''': |
| | * Als Ausgangspunkt könnt ihr eure '''Biologie-Schulbuch''' verwenden (S. 18, 19) |
| | * Ihr könnt natürlich auch im Internet recherchieren. |
| | * Bleibt inhaltlich aber bei dem, was ihr schon gelernt (inzwischen aber vielleicht wieder vergessen) habt. |
| | * Zum Veranschaulichen eurer Inhalte könnt ihr selbst Fotos machen (z.B. von Nahrungsmitteln), selbst Symbole erstellen (ähnlich wie die Abbildungen auf S. 18 im Bio-Schulbuch) oder auch Grafiken aus dem Netz verwenden (z.B. Gehalt von ungesättigten Fettsäuren in verschiedenen Ölsorten) |
| | <br> |
| | Das folgende Plakat wurde mit PowerPoint erstellt und enthält keinerlei sinnvollen Inhalt. Es geht lediglich darum, zu zeigen, wie eine grundsätzliche Aufteilung aussehen könnte:<br> |
| <br> | | <br> |
| |Farbe= #607 | | [[Datei:C10NTG_PosterVorschlag.jpg|800px]]<br> |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br> | | <br> |
| | Verwendet nicht mehr als 90min. für diesen Arbeitsauftrag! Man kann sicher deutlich mehr Zeit investieren, um immer mehr Details zu erzeugen, aber ihr sollt auch lernen, mit der Ressource Zeit effektiv umzugehen. Ich empfehle daher zunächst das Plakat in Grundzügen zu entwerfen und je nach zur Verfügung stehender Zeit nach und nach Aspekte zu vertiefen, zu verfeinern oder optisch aufzuhübschen. Beim "linearen Arbeiten" (das heißt: Ich fange oben auf dem Plakat an und mache alles sofort super genau und super schön) kann es leicht passieren, dass die zur Verfügung stehende Zeit aufgebraucht ist und das Plakat aber noch lange nicht fertig wird. Das sollte nicht bessern.<br> |
| | Speichert die Präsentation als pdf-Datei ab und schickt sie mir als Antwort auf den Arbeitsauftrag im Schulmanager. Wir hören uns morgen (Mittwoch, 19.05.) in einer Videokonferenz. |
| | |
| | === Distanzunterricht Montag, 17.05. === |
| | Heute ein paar anspruchsvollere Aufgaben zum Thema Redoxgleichungen. Notiert eure Lösungen bitte auf einem Blockblatt, wir besprechen alles am Donnerstag in der 6. Std.<br> |
| | '''Achtung:''' Bei sämtlichen hier besprochen Prozessen werden immer nur Teile der chemischen Gesamtgleichung betrachtet. Das vollständige Aufstellen einer Redoxgleichung, so dass auf beiden Seiten des Reaktionspfeils tatsächlich die gleiche Anzahl von Teilchen steht, erfordert etwas Geschick und wird erst nach den Pfingstferien besprochen! |
|
| |
|
| | <br> |
| {{Box-spezial | | {{Box-spezial |
| |Titel= | | |Titel=<span style="color:#607">'''Redoxgleichungen'''</span> |
| |Inhalt= | | |Inhalt= |
| Betrachten wir zum Vergleich ein Wasserstoff-Molekül, also zwei Wasserstoffatome, die über ein bindendes Elektronenpaar miteinander verbunden sind. Diese Bindung ist '''nicht polar''', weil beide H-Atome "gleich stark am bindenden Elektronenpaar ziehen". Zwei solche Wasserstoff-Atome würden sich bei Raumtemperatur nicht spontan voneinander trennen. Die Atombindung ist zu stark. Bei '''polaren Atombindungen''' gibt es jedoch Situationen, in denen das anders aussieht. Vor allem, wenn der eine Bindungspartner Wasserstoff ist. Bleiben wir bei dem am Anfang dargestellten Molekül "Hydrogenchlorid" (HCl). Hier lassen sich die beiden Partner sehr leicht voneinander trennen. Warum? <br>
| | '''Beispiel'''<br> |
| Bevor diese Frage beantwortet wird, vorher wieder etwas zum Auffrischen:
| | Bei der Herstellung von reinem Eisen (Fe) strömt das Gas Kohlenstoffmonoxid (CO) durch heißes Eisenerz, welches hauptsächlich Eisenoxid (Fe<sub>2</sub>O<sub>3</sub>) enthält. Neben dem gewünschten Eisen entsteht auch Kohlenstoffdioxid (CO<sub>2</sub>)<br> |
| * Wie viele Elektronen besitzt ein einzelnes Chlor-Atom insgesamt?
| | Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! |
| * Wie viele davon sind Valenzelektronen?
| | {{Lösung versteckt| |
| * Was muss passieren, damit dieses Chlor-Atom Edelgaskonfiguration erreicht?
| | [[Datei:C9NTG_Redox_Bsp_Hochofen.jpg]]<br> |
| * Wie viele Elektronen besitzt ein einzelnes Wasserstoff-Atom insgesamt?
| | |Lösung|Lösung ausblenden}}<br> |
| * Wie viele davon sind Valenzelektronen?
| | <br> |
| * Was muss passieren, damit Wasserstoff-Atom Edelgaskonfiguration erreicht?
| | '''Aufgabe 1'''<br> |
| * Wirklich? Keine zweite Möglichkeit?
| | Mangan (Mn) ist ein Element, welches gerne als "Chamäleon" bezeichnet wird. Das liegt daran, dass Manganverbindungen je nach Oxidationszahl des Mangans unterschiedliche gefärbt sind. Man kann also anhand der Farbe schon erkennen, welche OZ vorliegt. Schüttet man eine violette Lösung, die Permangant-Ionen enthält (MnO<sub>4</sub><sup>-</sup>) in eine saure Sulfit-Lösung (SO<sub>3</sub><sup>2-</sup>), so "verschwindet" die violette Farbe. Tatsächlich sind jedoch farblose Mn<sup>2+</sup>-Ionen entstand und gleichzeitig fand eine Umwandlung von Sulfit in Sulfat statt (SO<sub>3</sub><sup>2-</sup>).<br> |
| | Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! |
| | <br><br> |
| | '''Aufgabe 2''' (Bild: Abb. 1 auf S. 138 im Buch)<br> |
| | Wirft man ein Stück Kupfer (Cu) in Salpetersäure (HNO<sub>3</sub>), so löst es sich unter Entwicklung eines sehr giftigen, braunen Gases auf. Bei dem Gas handelt es sich um Stickstoffdioxid (NO<sub>2</sub>), das Kupfer selbst regiert zu Cu<sup>2+</sup>-Ionen.<br> |
| | Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! |
| | <br><br> |
| | '''Aufgabe 3''' (Bild: Abb. 1 auf S. 146 im Buch) <br> |
| | Im Labor kann man ein kleine Portion Kupfer(II)-oxid (CuO) in ein Glasrohr legen, durch das Wasserstoffgas (H<sub>2</sub>) strömt. Erhitzt man von außen das Kupfer(II)-oxid, so regiert es nach einiger Zeit mit dem vorbei strömenden Wasserstoff zu elementarem Kupfer (Cu). Gleichzeit entsteht bei dieser Reaktion Wasser (H<sub>2</sub>O).<br> |
| | Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! |
| <br><br> | | <br><br> |
| {{Lösung versteckt|
| | '''Aufgabe 4''' (schwer, also wirklich: sehr schwer!)<br> |
| * Ein Chlor-Atom besitzt insgesamt 17 Elektronen
| | Wenn die Verkehrspolizei heute überprüfen möchte, ob eine Autofahrerin bzw. ein Autofahrer Alkohol getrunken hat, dann muss die entsprechende Person in ein elektronisches Messgerät pusten. Das Gerät zeigt dann direkt einen Atemalkohol-Gehalt in Promille an. Früher gab es diese Technik noch nicht. Zwar musste man auch pusten, aber durch ein Röhrchen hindurch in einen Beutel, ähnlich wie ein Luftballon. In dem Röhrchen befand sich gelbes Kaliumdichromat (K<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub>). Wenn die autofahrende Person Alkohol in der Ausatemluft hatte, dann entstanden grüne Chrom(III)-Ionen (Cr<sup>3+</sup>). Der Alkohol reagierte dabei zur Essigsäure. Die folgende Abbildung zeigt die Valenzstrichformeln der beiden Verbindungen. Hier müsst ihr die Oxidationszahlen so bestimmen, wie ihr es ganz am Anfang gelernt habt: Durch Aufteilen der bindenden Elektronenpaare!<br> |
| * Sieben davon sitzen auf der äußersten Schale, sind also Valenzelektronen
| | [[Datei:C9NTG_EthanolEssigsäure_Valenzstrich.jpg]]<br> |
| * Chlor muss ein Elektron aufnehmen
| |
| * Ein Wasserstoff-Atom besitzt ein Elektron
| |
| * ...''sehr witzig''...
| |
| * Es muss eins aufnehmen, um die Edelgas-Konfiguration von Helium zu erreichen (Zwei Elektronen auf der innersten Schale, die damit voll besetzt ist und einen sehr energiearmen Zustand darstellt)
| |
| * ''Das haben wir noch nicht besprochen'': Wasserstoff könnte das eine Elektron auch abgeben. Dann hat es überhaupt keins mehr. Vom Wasserstoffatom bliebe dann nur das eine Proton im Kern übrig. Das ist zwar keine klassische Edelgaskonfiguration, aber dennoch auch ein sehr energiearmer Zustand.
| |
| |Lösung|Lösung ausblenden}}
| |
| <br> | | <br> |
| | Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat! |
| | Haltet eure Lösungen am Donnerstag in der Videokonferenz bereit! |
| |Farbe= #607 | | |Farbe= #607 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 1.122: |
Zeile 612: |
| |Hintergrund= #DCF | | |Hintergrund= #DCF |
| }} | | }} |
| <br>
| | |
| | === Präsentationstechnik === |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel= | | |Titel=<span style="color:#607">'''Ein guter Vortrag mit einem Präsentationsprogramm'''</span> |
| |Inhalt= | | |Inhalt= |
| Die folgende Aussage ist "anthropomorph". Das bedeutet, man tut so, als wären die betrachteten Teilchen Lebewesen/Menschen mit Gefühlen und Bedürfnissen. Das ist natürlich nicht so! Solche Aussagen sind aber oft sehr leicht verständlich für Schülerinnen und Schüler. Ich werde die Aussage erst später ''fachwissenschaftlich'' umformulieren. <br>
| | '''Informationsquellen''' |
| O.k., schauen wir uns die Situation mal an: Wir haben zwei Atome, ein Wasserstoff-Atom und ein Chlor-Atom. Beide teilen sich ein Elektronenpaar und bilden daher ein Molekül. Das Chlor-Atom ist ''unglaublich scharf'' auf das Elektronenpaar. Wenn es beide Elektronen komplett haben könnte, hätte es Edelgaskonfiguration. Das Wasserstoff-Atom könnte mit beiden Elektronen zwar auch etwas anfangen, ''ist aber auch glücklich'', wenn es überhaupt kein Elektron mehr hat.<br>
| | * Zunächst die im Unterricht besprochenen Bewertungskriterien: [[Spezial:FilePath/2018_Bewkrit_Ref.pdf|pdf-Datei]]<br> |
| WAS WIRD WOHL PASSIEREN? <br>
| | * Hier eine Internetseite, die ein einfach verständliches, klares Video enthält, in dem auf grundsätzlichen Anforderungen an ein Referat eingegangen wird. Im Video wird mehrfach erwähnt, dass man sich gut überlegen sollte, ob man wirklich ein Präsentationsprogramm verwendet. Diese Option habt ihr nicht. Es geht bei dieser Referats-Runde ja genau darum, gute Präsentationen '''mit einem Präsentationsprogramm''' zu gestalten. Trotzdem kann das Video sehr hilfreich sein: [https://herr-kalt.de/arbeitsmethoden/tipps-gute-vortraege Hier klicken] |
| Wer keine Ahnung hat, was das soll, vielleicht noch ein anderes Beispiel: Ihr habt ein kleines Geschwister. Das hat zum Geburtstag ein Playmobil-Pferd geschenkt bekommen. Ihr habt den passenden Playmobil-Cowboy dazu, den ihr irgendwie ganz witzig findet, aber mal ehrlich... ihr seid quasi erwachsen, was wollt ihr mit einem Plastik-Cowboy. Euer kleines Geschwister kommt permanent zu euch ins Zimmer, hängt bei euch rum und will mit euch und eurem Playmobil-Cowboy spielen. Eine Zeit lang macht euch das auch Spaß und ihr seid dabei. Aber plötzlich klingelt euer Handy und euer... bester Freund/beste Freundin ist dran. WAS MACHT IHR WOHL? - Vermutlich: Ihr schenkt euren Playmobil-Cowboy eurem Geschwister und schickt ihn aus dem Zimmer. Übertragt das jetzt auf die Atome!
| | * Mit dem folgenden Link gelangt ihr zu einer Internetseite, auf der ihr euch durch eine (zugegeben sehr lange) Präsentation von Alexei Kapterev (ein prof. Redner-Coach) klicken könnt. Die Präsentation ist in englischer Sprache und plakativ, aber ich persönlich finde sie lustig: [https://www.slideshare.net/thecroaker/death-by-powerpoint/28-45_minutes_1_argument_2_argument_3_argument_Memorable_opening Hier klicken] |
| <br>
| |
| | |
| {{Lösung versteckt|
| |
| Das bindende Elektronenpaar (Playmobil-Pferd + Playmobil-Cowboy) wird komplett auf das Chlor-Atom (euer Geschwister) übertragen. Es entsteht ein '''positiv geladenes Wasserstoff-Teilchen''' (vorher: ein positiv geladenes Proton im Kern, ein negatives Elektron in der Hülle; jetzt; nur noch ein Proton) und ein '''negativ geladenes Chlor-Teilchen''' (vorher: 17 Protonen im Kern, 17 Elektronen in der Hülle; jetzt: 17 Protonen im Kern, 18 Elektronen in der Hülle.<br>
| |
| [[Datei:SäBa1_heterolytBdgTrennung.jpg|400px]]<br>
| |
| |Lösung|Lösung ausblenden}}
| |
| <br> | | <br> |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br> | | <br> |
| {{Box-spezial
| | '''Organisatorisches''' |
| |Titel=
| | * Die Referate sollen '''10 Minuten''' dauern. Abweichungen von 2min. mehr oder weniger führen i.d.R. zu Punktabzug. |
| |Inhalt=
| | * Das Referat entspricht einem '''angekündigten Leistungsnachweis''', daher: Wer anwesend ist, muss es halten! Wer fehlt, muss die üblichen Bestimmungen einhalten (Entschuldigung über den Schulmanager spätestens am zweiten Schultag nach Krankheitsbeginn). Im Krankheitsfall wird ein '''Ersatztermin''' festgelegt; das kann auch ein '''Freitagnachmittag''' sein, an dem das Referat nachgeholt werden muss. |
| Man spricht in so einem Fall von einer '''heterolytischen Bindungstrennung'''. "Bindungstrennung" bedeutet, dass eine Bindung getrennt wird (ziemlich logisch...) und "hetero"(lytisch) bedeutet, dass die Bindung (bzw. besser: das bindende Elektronenpaar) "ungleichmäßig" aufgeteilt wird. Es gibt auch die "homolytische Bindungstrennung", bei der wird die Bindung so aufgeteilt, dass jeder Partner ein Elektron des bindenden Paares bekommt. Das ist hier aber nicht so: Das Wasserstoff-Atom bekommt gar kein, das Chlor-Atom beide. Deswegen: '''heterolytische '''Bindungstrennung.<br>
| | * Technik: Wenn ihr das Referat an der Schule haltet, solltet ihr eure Präsentation min. einen Tag vorher einmal an einem Rechner in der Schule '''ausprobieren'''. Wer die Präsentation am Tag des Referats nicht zum Laufen bekommt, muss eben auf die Visualisierung verzichten (= 0 Pkt. in diesem Bewertungs-Bereich). |
| Die Abspaltung eines Wasserstoffteilchens nach diesem Muster ist etwas, was viele Moleküle können (wenn ein passender Reaktionspartner zur Verfügung steht). Man zählt solche Moleküle zur Gruppe der '''"Säuren"'''. Wenn z.B. etwas '''"sauer"''' schmeckt, dann sicher deswegen, weil eine '''Säure '''enthalten ist, also ein Molekül, das durch heterolytische Bindungstrennung ein Proton (das was vom Wasserstoffteilchen nach der Abspaltung übrig bleibt) abgespalten hat.<br>
| | * Technik: Solltet ihr euch am Tag des Referats im Distanzunterricht befinden, haltet ihr das Referat von zu Hause aus. Dazu ist es erforderlich, dass ihr die Kamera aktiviert. Eine Bewertung ohne euch sehen zu können, ist nicht möglich. |
| Man kann diese Abspaltung als chemische Gleichung formulieren: <br>
| | * Falls jemand sein Referat verschieben möchte: Rechtzeitig mit mir absprechen! - Was immer funktioniert: Wenn ihr einen '''Tauschpartner''' habt! |
| [[Datei:SäBa1_heterolytBdgTrennung_Gleichung.jpg]]<br>
| |
| Stellt nach dem gleichen Muster die chemischen Gleichungen (beide Varianten: mit und ohne Valenzstrichformel) für die heterolytische Bindungstrennung für folgende Säure-Moleküle auf:<br>
| |
| * Hydrogenfluorid (HF)
| |
| * Iodsäure (HIO<sub>3</sub>)
| |
| * Schwefelsäure (H<sub>2<sub>SO</sub>4</sub>) | |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse.jpg]]<br>
| |
| | |
| | |
| {{Lösung versteckt|
| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse_ML1.jpg]]<br>
| |
| Vielleicht habt ihr bei der Schwefelsäure das andere Proton abgespalten. Das funktioniert. Es können sogar beide Wasserstoff-Teilchen gleichzeitig abgespalten werden. Stellt dafür (sofern ihr es noch nicht getan habt) die Gleichungen (mit und ohne Valenzstrichformeln) auf!
| |
| |Lösung|Lösung ausblenden}}
| |
| <br> | | <br> |
|
| |
| {{Lösung versteckt|
| |
| [[Datei:SäBa1_Aufgabe1_chemGl_Heterolyse_ML2.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}
| |
| <br> | | <br> |
| | '''Themenübersicht''' |
| | * Di 08.06., 1. Std.: KB - Thema: ???, OB - Thema: ???, LiB - Thema: ??? |
| | * Di 08.06., 2. Std.: LeB - Thema: ???, FB - Thema: ???, VD - Thema: ??? |
| | * Mi 09.06., 2. Std.: PD - Thema: ???, ME - Thema: ???, MG - Thema: ??? |
| | * Di 15.06., 1. Std.: CH- Thema: ???, EH - Thema: ???, BH - Thema: ??? |
| | * Di 15.06., 2. Std.: JaK - Thema: ???, JoK- Thema: ???, FL - Thema: ??? |
| | * Mi 16.06., 2. Std.: PM - Thema: ???, EN- Thema: ???, LP- Thema: ??? |
| | * Di 22.06., 1. Std.: AR - Thema: ???, LS - Thema: ???, EmS - Thema: ??? |
| | * Di 22.06., 2. Std.: ElS- Thema: ???, AT- Thema: ???, AW- Thema: ??? |
| | * Mi 23.06., 2. Std.: EW - Thema: ???, LW - Thema: ??? |
| |Farbe= #607 | | |Farbe= #607 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 1.173: |
Zeile 647: |
| |Hintergrund= #DCF | | |Hintergrund= #DCF |
| }} | | }} |
| <br>
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">Hausaufgabe</span>
| |
| |Inhalt=
| |
| Das Buch geht hier anders vor, deswegen keine Seiten im Buch lesen. Eher etwas praktisches als "Hausaufgabe": <br>
| |
| '''Pflicht''': Sucht bei euch zu Hause drei völlig verschiedene '''Lebensmittel''', die '''sauer '''sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen"). <br>
| |
| '''Freiwillig:''' Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist!
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
| <br>
| |