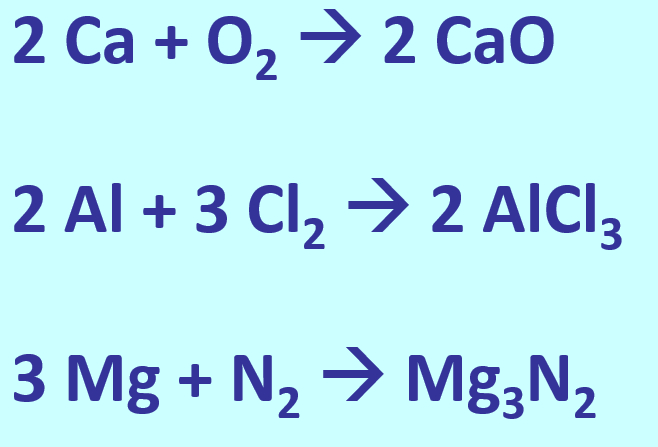Corona-Arbeitsaufträge (Chemie) LUX: Unterschied zwischen den Versionen
Aus RMG-Wiki
(AA C5 hierhin verschoben) Markierung: 2017-Quelltext-Bearbeitung |
(Bild-Links einfgefügt) Markierung: 2017-Quelltext-Bearbeitung |
||
| (21 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
== Arbeitsauftrag | {{Box-spezial | ||
|Titel=<span style="color:#900">'''geänderte Reihenfolge'''</span> | |||
|Inhalt= | |||
Die Reihenfolge der Arbeitsaufträge auf dieser Seite wurde geändert. Die neuesten Arbeitsaufträge sind jetzt immer oben. | |||
|Farbe= #900 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #FCA | |||
|Hintergrund= #FCA | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie14 (hoffentlich letzter) == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung: Salze und Moleküle'''</span> | |||
|Inhalt= | |||
Ich hoffe, dass wir uns nach den Pfingstferien endlich wieder im Klassenzimmer sehen können. Ich gehe daher davon aus, dass dies die letzte Online-Einheit sein wird. In der vorangegangenen wurden noch einem Metalle wiederholt, heute sind Abschlussaufgaben zum Thema Salze und Moleküle dran. Ihr braucht zur Bearbeitung der Aufgaben euer Buch, um die Aufgaben zu lesen. Bei zwei Aufgaben müsst ihr auch noch eine weitere Textpassage lesen.<br> | |||
Teilt euch die Aufgaben auf! Empfehlung: Heute drei Aufgaben zum Bereich Salze und vier zum Bereich Moleküle, am Mittwoch die restlichen.<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Aufgaben zum Thema Salze'''</span> | |||
|Inhalt= | |||
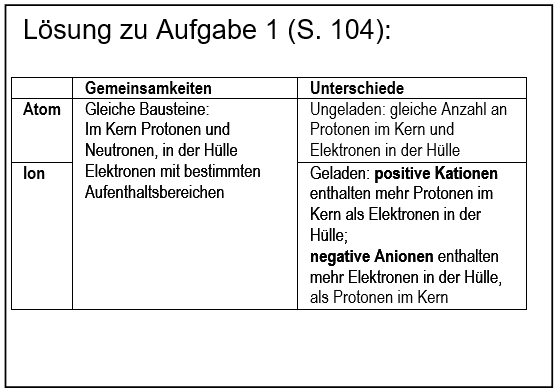
* Salze: S. 104, Aufgabe 1 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A1.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
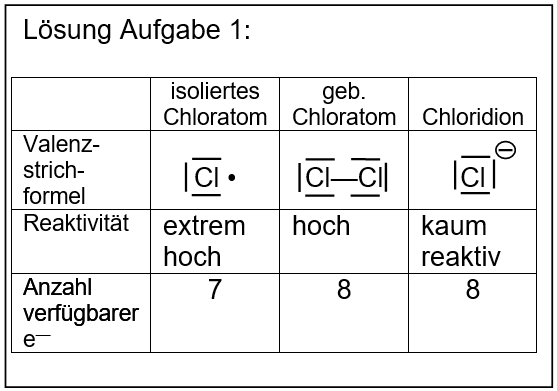
* Salze: S. 104, Aufgabe 4 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A4.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 104, Aufgabe 6 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A6.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
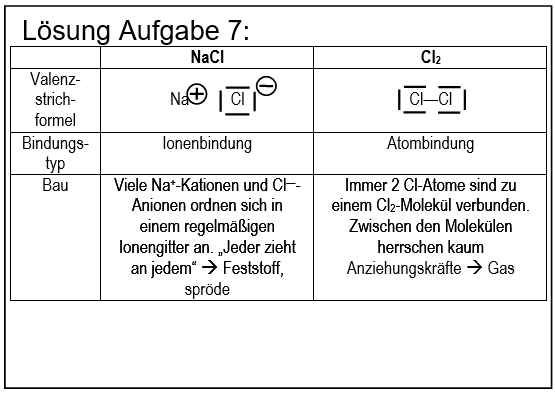
* Salze: S. 104, Aufgabe 7 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A7.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
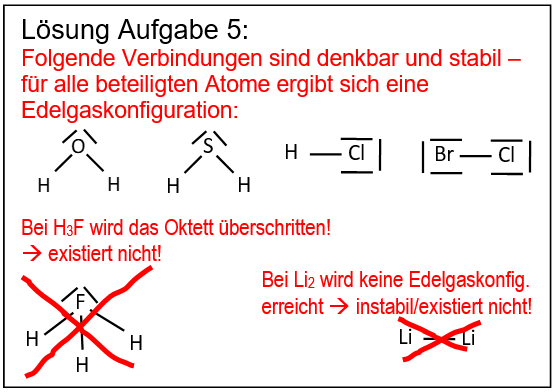
* Salze: S. 104, Aufgabe 10 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A10.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 104, Aufgabe 11 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A11.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 104, Aufgabe 15 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A15.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Aufgaben zum Thema Moleküle'''</span> | ||
|Inhalt= | |Inhalt= | ||
* Salze: S. 122, Aufgabe 1 | |||
* | <br> | ||
* | {{Lösung versteckt| | ||
* | [[Datei:ZF_Lsg_122_A1.jpg|600px]] | ||
* | |Lösung|Lösung ausblenden}} | ||
<br> | |||
* | * Salze: S. 122, Aufgabe 3 | ||
* | <br> | ||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A3.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 5 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A5.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 6 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A6.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 7 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A7.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 8 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A8.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 19 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A19.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 19: | Zeile 127: | ||
}} | }} | ||
== Arbeitsauftrag Chemie13 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Nochmals Metalle'''</span> | |||
|Inhalt= | |||
Die wichtigsten Punkte, die ihr für die nächste Jahrgangsstufe in Chemie braucht, haben wir bereits angesprochen. Ein großes Kapitel fehlt zwar noch, aber das besprechen wird nach den Pfingstferien. Bis dahin werden wir die bisher behandelten Inhalte noch etwas wiederholen bzw. vertiefen.<br> | |||
Das folgenden Videos beschäftigt sich noch einmal mit Metallen. Es ist weniger theoretisch, sondern enthält ein paar schöne Versuche, die ich teilweise auch im Unterricht durchgeführt hätte. Ihr bekommt diese Woche keinen weiteren Arbeitsauftrag mehr. Am besten, ihr teilt euch das Material selbständig auf. Ich empfehle folgendes Vorgehen:<br> | |||
<br> | |||
'''Heute, Montag 18.05.''' (Bearbeitungszeit: ca. 25min.)<br> | |||
Schaut zunächst in der Mediathek des Bayerischen Rundfunks den 15 min. Film über die Eigenschaften von Metallen:[https://www.br.de/mediathek/video/chemie-metalle-werkstoffe-aus-boden-und-weltall-av:5e6be9a81c429f0013448556 zur Mediathek]<br> | |||
<br> | |||
Beantwortet im Anschluss folgende Fragen (am besten wirklich schriftlich in Stichpunkten): | |||
* Metalle kann man in der Natur oder im Alltag in elementarer Form finden oder in Form von Ionen gebunden in Mineralien. Nenne drei verschiedene Alltags-Gegenstände, die aus elementarem Metall bestehen. | |||
* Wiederhole die vier wichtigsten Eigenschaften von Metallen und zeige jeweils eine Anwendungsmöglichkeit von Metallen auf, bei der diese Eigenschaft ausgenutzt wird! | |||
* Beschreibe, was eine Legierung ist und nenne drei Beispiele! | |||
<br> | |||
{{Lösung versteckt| | |||
Hast Du wirklich eine Lösung für die drei Aufgaben schriftlich, stichpunktartig auf einem Blatt Papier stehen? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
* z.B. Schmuckstücke aus Gold, Fahrradrahmen aus Aluminium/Stahl/Titan, Stromkabel aus Kupfer | |||
* '''Metallischer Glanz''': Schmuckstücke, '''gute Verformbarkeit''': Herstellen kompliziert geformter Bauteile (z.B. Fahrradrahmen, Auto-Karosserieteile) , '''gute elektrische Leitfähigkeit''': Verwendung als "Stromkabel", '''gute Wärmeleitfähigkeit''': im Film kam hier keine Anwendungsmöglichkeit gezeigt, aber z.B. ist in jedem Computer ein speziell geformtes metallisches Bauteil vorhanden, dass die enorme Hitze vom Prozessor wegleitet. Man spricht von "Kühlrippen". Googelt diesen Begriff! | |||
* Bei einer Legierung handelt es sich um eine "Mischung" von Metallen. Die Eigenschaften der Legierung unterscheiden sich von den Eigenschaften der Ausgangs-Metalle. Bsp.: Stahl (Eisen und Vandium und andere), Bronze (Kupfer und Zinn), Messing (Kupfer und Zink) | |||
|selbstverständlich|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Übermorgen, Mittwoch 20.05.''' (Bearbeitungszeit: ca. 25min.)<br> | |||
| | Schaut zunächst in der Mediathek des Bayerischen Rundfunks den 15 min. Film über den atomaren Bau von Metallen: | ||
[https://www.br.de/mediathek/video/chemie-metalle-metalle-das-geheimnis-ihres-atomaren-aufbaus-av:5e6fa570899b870013e1f566 zur Mediathek] | |||
<br> | |||
Beantwortet im Anschluss folgende Fragen (am besten wirklich schriftlich in Stichpunkten): | |||
* Was passiert auf Teilchenebene, wenn ein Metallstück auf einer Seite erhitzt wird? | |||
* Was passiert auf Teilchenebene, wenn ein Metallstück verformt wird? | |||
* Was ist der Unterschied zwischen einem Edelmetall und einem unedlen Metall? Nenne jeweils zwei Beispiele! | |||
<br> | |||
{{Lösung versteckt| | |||
Hast Du wirklich eine Lösung für die drei Aufgaben schriftlich, stichpunktartig auf einem Blatt Papier stehen? | |||
{{Lösung versteckt| | |||
* Die Atomrümpfe und das Elektronengas beginnen an der erhitzten Stelle stärker zu schwingen. Diese Schwingungen können leicht an benachbarte Teilchen weitergegeben werden, weil kein Teilchen starr an einen bestimmten Platz gebunden ist. Daher leiten Metalle die Wärme sehr gut. | |||
* Die Atomrümpfe, die normalerweise in einer dichtesten Kugelpackung angeordnet sind, können durch das Einwirken einer Kraft verschoben werden und eine neue Position einnehmen, ohne dass das Metallstück dabei zerbricht. Das negativ geladene Elektronengas hält die positiven Atomrümpfe permanent zusammen. | |||
* Im Film wurde das nicht ganz so deutlich: Die Einteilung ist tatsächlich vom Reaktionsverhalten abhängig: Unedle Metalle reagieren mit Säuren, Edelmetalle nicht. Nicht immer lösen sich in unedle Metalle aber in Säuren auf, so wie es im Film am Beispiel von Magnesium gezeigt wurde. Typische Edelmetalle: Gold, Silber, Platin. Typische unedle Metalle: Magnesium, Aluminium. | |||
|selbstverständlich|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Arbeitsauftrag Chemie12 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Verbesserung der Hausaufgabe'''</span> | ||
|Inhalt= | |Inhalt= | ||
Hier eine mögliche Lösung zur Aufgabe vom letzten Mal:<br> | |||
<br> | |||
Zeichnet stark vergrößerte, schematische Ausschnitte von den folgenden Stoffen, die erkennen lassen, wie die beteiligten Teilchen zusammenhängen. Alle drei Zeichnungen sollten zusammen auf ein DIN-A4-Blatt passen. Jede Zeichnung müsste also ca. 9cm hoch und ca. 20cm breit sein: | |||
* | * '''Kaliumbromid '''(KBr) | ||
* | * '''Ammoniak '''(NH<sub>3</sub>) | ||
* | * '''Magnesium '''(Mg) | ||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZZ_Übersicht_Bindungsarten.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 43: | Zeile 198: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Neu'''</span> | |||
|Inhalt= | |||
Das nächste Kapitel lässt sich nur schwer per "Home-Schooling" unterrichten. Wir haben aber auch schon viel geschafft. Daher werden wir bis zu den Pfingstferien die bereits gelernten Inhalte einüben. Heute zunächst ein Video zum PSE: Im Video werden sehr schnell alle Elemente des PSE aufgezählt und ein typisches Bild dazu gezeigt. | |||
* Lasst es zunächst einfach auf euch wirken! | |||
== Arbeitsauftrag | {{#ev:youtube|rz4Dd1I_fX0}} | ||
<br> | |||
'''Hausaufgabe:''' | |||
* Überlegt nach dem Video, ob ihr an einer Stelle gerne mehr zum dargestellten Element gewusst hättet. | |||
* Stellt euch vor, über dieses Element, das euch interessiert, soll ein Film gedreht werden. Entwerft ein Film-Plakat dazu! | |||
* Falls ihr nicht wisst, wie ein typisches Filmplakat ausschaut, geht an einem Kino vorbei oder besucht die entsprechende Seite im Netz | |||
* Schickt mir das Plakat am besten als pdf-Datei, im Notfall auch als Foto. Entweder über den Schulmanager oder falls die Datei zu groß ist an die bekannte E-Mail-Adresse. Bitte unbedingt beim Betreff angeben: 9a Chemie Filmplakat. | |||
* Ihr habt dafür heute und am Mittwoch Zeit. Es wird diese Woche keinen zweiten Arbeitsauftrag geben! | |||
* Am Mittwoch erhaltet ihr über den Schulmanager den Arbeitsauftrag erneut. Dann könnt ihr auf diesen Arbeitsauftrag direkt im Schulmanager antworten und euer Plakat hochladen. | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie11 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Wiederholung'''</span> | ||
|Inhalt= | |Inhalt= | ||
Ihr habt im vergangenen Schuljahr drei wichtige '''Bindungstypen''' kennengelernt, die dafür verantwortlich sind, dass bestimmte Teilchen zusammenhalten: | |||
* '''Ionenbindung''' bei Salzen | |||
* '''Atombindung '''bei Molekülen | |||
* '''Metallbindung''' bei Metallen | |||
Es gäbe noch einen vierten Bindungstyp, den ich persönlich früher ganz gerne unterrichtet habe: Die '''Komplexbindung'''. Sie spielt z.B. beim grünen Blattfarbstoff Chlorophyll oder beim roten Blutfarbstoff Hämoglobin eine Rolle. Die Komplexbindung ist aber kein Bestandteil des Lehrplans mehr.<br> | |||
Bleiben wir daher bei den bekannten drei Gruppen. Heute nur eine kleine Aufgabe: | |||
<br> | <br> | ||
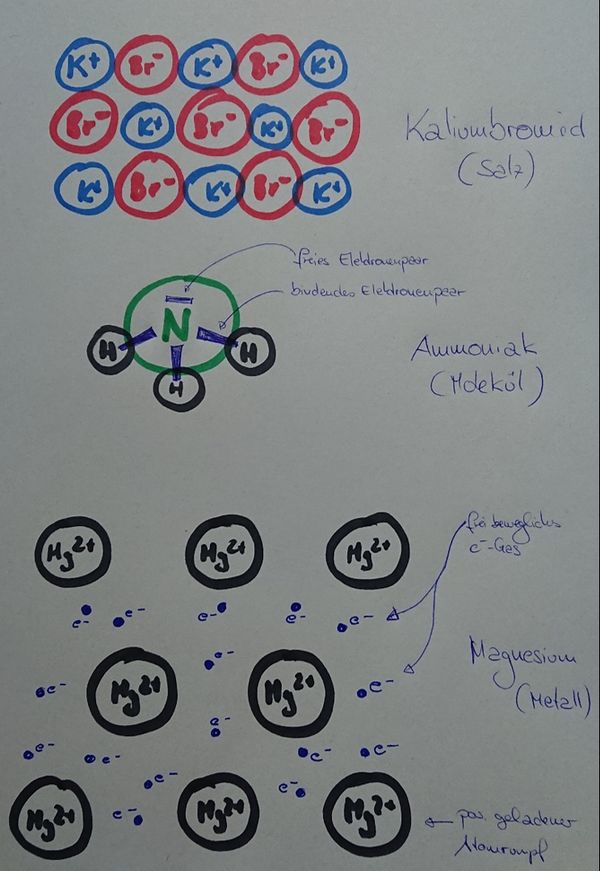
Zeichnet stark vergrößerte, schematische Ausschnitte von den folgenden Stoffen, die erkennen lassen, wie die beteiligten Teilchen zusammenhängen. Alle drei Zeichnungen sollten zusammen auf ein DIN-A4-Blatt passen. Jede Zeichnung müsste also ca. 9cm hoch und ca. 20cm breit sein: | |||
* '''Kaliumbromid '''(KBr) | |||
* '''Ammoniak '''(NH<sub>3</sub>) | |||
* '''Magnesium '''(Mg) | |||
<br> | |||
Eine Lösung für diese Aufgabe gibt es nächsten Montag! Hebt eure Zeichnungen auf jeden Fall so lange auf! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:ZZ_Übersicht_Bindungsarten.jpg|600px]] | |||
|Lösung | |Lösung|Lösung ausblenden}} | ||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie10 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
In der letzten Einheit habt ihr die '''Metallbindung '''kennengelernt und ein Video geschaut. Zunächst zur Wiederholung: Beschreibt mit Worten, warum ein Metall bei Raumtemperatur in der Regel ein Feststoff ist, was die Metall-Atome also zusammenhält! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
In eurer Beschreibung sollten folgenden Fachbegriffe auftauchen: | |||
|Lösung | * dichteste Kugelpackung | ||
* positiv geladene Atomrümpfe | |||
* negativ geladenes Elektronengas | |||
Die Begriffe sollten in "schöne", zusammenhängende Sätze eingebettet sein. Vor allem sollte klar werden, dass die Anziehungskräfte der am aufbau beteiligten Teilchen durch die unterschiedlichen Ladungen zustande kommen. Und, dass diese starken Anziehungskräfte für den Aggregatszustand (fest) verantwortlich sind<br> | |||
Eine Möglichkeit, zu testen, ob eure Antwort gut war: Lest Sie z. B. euren Eltern vor. Wenn Sie euch sagen, dass es gut war, dann entweder weil es wirklich gut war, oder weil sie euch einfach lieb haben oder beides. (Ich gehe davon aus, dass euch eure Eltern immer lieb haben, aber das sollte nicht der Grund dafür sein, zu sagen, eure Antwort auf die Frage war gut.) Wenn ihr euch nicht sicher seid, schickt mir eure Lösung über den Schulmanager. Von mir bekommt ihr ein rein fachliches Feedback. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Zusammenhang zwischen Aufbau und Eigenschaften bei Metallen'''</span> | |||
|Inhalt= | |||
Im Video wurde bereits gezeigt, dass viele typischen Eigenschaften von Metallen (elektrische Leitfähigkeit, Wärmeleitfähigkeit, Verformbarkeit) mit dem Aufbau zusammenhängen. In eurem Buch sind diese Zusammenhänge etwas ausführlicher und relativ gut erklärt. Ihr habt zwei Möglichkeiten: | |||
* Lest im Buch S. 128 - 129 (Abs. 1, 2 u. 3) | |||
* Schaut noch einmal das Video (ich empfehle aber das Buch - im Video kommt dieser Aspekt etwas kurz) | |||
<br> | |||
Schließt jetzt das Buch und legt es weg! - Zeichnet dann aussagekräftige Skizzen, welche die folgenden Eigenschaften von Metallen gut verdeutlichen (möglichst kein Text, höchstens Beschriftungen)! | |||
* elektrische Leitfähigkeit | |||
* Wärmeleitfähigkeit | |||
* Verformbarkeit | |||
<br> | |||
Klickt bitte wirklich erst auf "Lösung" wenn ihr für jede Eigenschaft mindestens eine schöne Skizze habt! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Hast Du wirklich mind. 3 Skizzen vor Dir liegen??? | |||
|Lösung | {{Lösung versteckt| | ||
[[Datei:Met2_ZH_BauEigenschaft_MLSkizzen.jpg|600px]]<br> | |||
Deine Skizzen sollten auf keinen Fall "schlechter" sein, als die hier! Das ist die niedrigste Qualität, die ich erlaube :)<br> | |||
|Ja!|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Versuch'''</span> | |||
|Inhalt= | |||
Ein freiwilliger Versuch. '''Ihr benötigt dazu:''' | |||
* heißes Wasser | |||
* einen Metall-Löffel | |||
* einen Holz- oder Plastiklöffel (es muss kein Löffel sein, irgendein länglicher Gegenstand ist o.k. er sollte nur ungefähr genauso groß wie der Metall-Löffel sein) | |||
<br> | |||
'''Durchführung''': | |||
* Bringt in einem kleinen Topf Wasser zum Kochen (solltet ihr das noch nie gemacht haben, fragt einen Erwachsenen, er euch hilft) | |||
* Wenn das Wasser kocht, reduziert die Hitze des Herdes stark. Das Wasser soll nicht stark sprudeln sondern nur leicht vor sich hin köcheln. | |||
* Nehmt den Metall-Löffel mit der rechte und den Plastik-/Holzlöffel mit der linken Hand gleichzeitig zwischen Daumen und Zeigefinger. | |||
* Taucht beide Löffel gleichzeitig in das heiße Wasser. Sobald ein Löffel zu heiß wird, lasst los! | |||
<br> | |||
Beschreibt das '''Ergebnis''' und liefert eine '''Erklärung'''. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Wenn ihr nicht zu den Menschen gehört, bei denen das Schmerz-Empfinden gestört ist, dann solltet ihr den Metall-Löffel deutlich früher losgelassen haben.<br> | |||
| | Begründung: Metalle sind sehr gute Wärmeleiter. Ein heißer Gegenstand auf Teilchen-Ebene betrachtet bedeutet nichts anderes als schnell hin und her schwingende Teilchen. Im Metall sind frei bewegliche Elektronen vorhanden, die sehr leicht Schwingnen aufnehmen und weitergeben können. Auch die positiv geladenen Atomrümpfe sind nicht sehr starr an ihren Platz gebunden und können gut schwingen.<br> | ||
Entlang des Metall-Löffels breitet sich die Hitze des kochenden Wassers also viel schneller aus, als im Holz oder Plastik. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Das war es für heute</span> | |||
|Inhalt= | |||
Am Mittwoch gibt es eine Zusammenfassung von allem, was wir in diesem Schuljahr gemacht haben. | |||
<br> | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
==Arbeitsauftrag Chemie9== | |||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
* Das einzige bei Raumtemperatur flüssige Metall ist Quecksilber (kann man aus dem PSE ablesen, wenn man die Schmelzpukte auf der Rückseite anschaut: -39°C) | |||
* Ein Metall, das in der Hand schmilzt: Gallium (Smp.: 30°C). Wer möchte, kann das folgende Video schauen, in dem ein Mann mit Gallium herumspielt (Achtung: Gallium ist giftig uns sollte nicht angefasst werden. Ich schätze aber, das man in Deutschland sowieso nicht so einfach an reines Gallium kommt) | |||
{{#ev:youtube|4u6A40QTWVI}} | |||
* Eine Legierung ist eine stabile "Mischung" verschiedener Metalle. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
Mir ist aufgefallen, dass der letzte Arbeitsauftrag tatsächlich etwas anspruchsvoll war! - Deswegen heute nur ein kurzes Video von Mai. Die macht das super :) <br> | |||
* Einfach anschauen! | |||
* Wer beim letzten Arbeitsauftrag Schwierigkeiten hatte, nach dem Video einfach noch mal probieren! | |||
{{#ev:youtube|0bvldHVL_TU}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''Das war es schon für heute'''</span> | |||
|Inhalt= | |||
Schönen 1. Mai! - Bis nächste Woche :) | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie8 == | |||
''' | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Ergebnisse der Hausaufgabe'''</span> | |||
|Inhalt= | |||
[[Datei:Met1_Kollage_MetalleImHaushalt.jpg]] | |||
Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner. <br> | |||
Ihr solltet euch zusätzlich zu den Bildern auch Gedanken dazu machen, warum manche Gegenstände aus Metall sind und kein anderes Material zur Herstellung verwendet wurde. Eine Eigenschaft wurde sehr häufig hervorgehoben, auch wenn ihr es teilweise unterschiedlich ausgedrückt habt: Die '''"Stabilität"''' von Metallen. In dieser und der nächsten Einheit, möchte ich mit euch versuchen zu klären, woher diese "Stabilität" kommt.<br> | |||
<span style="color:#60F">Achtung: "Stabilität" steht im Moment noch in Anführungszeichen, weil dieser Begriff eigentlich ziemlich ungenau ist: Wenn ihr einen Eisennagel und ein Stück Plastik im Garten vergrabt, werdet ihr nach einem Jahr den Nagel ziemlich verrostet wiederfinden, während das Stück Plastik sich kaum verändert hat. '''Chemisch''' betrachtet sind viele Metalle nämlich überhaupt nicht "stabil".</span> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
Das, was wir gerade besprechen, ist übrigens ein Haupt-Anliegen der Wissenschaft "Chemie": Sie versucht Zusammenhänge herzustellen zwischen dem '''Aufbau von Stoffen''' und den '''Eigenschaften''', die diese Stoffe haben.<br> | |||
Einen solchen wichtigen Zusammenhang habt ihr nun schon oft gehört und in der letzten Einheit vor den Osterferien noch einmal intensiv besprochen: Es gibt einen Zusammenhang zwischen dem Aggregatszustand eines Stoffes (bei Raumtemperatur) und den Anziehungskräften der im Stoff enthaltenen Teilchen. Die Anziehungskräfte wiederum hängen eng mit dem Aufbau der Teilchen zusammen.<br> | |||
Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest die kleinen, wie z.B. O<sub>2</sub>, gasförmig) | |||
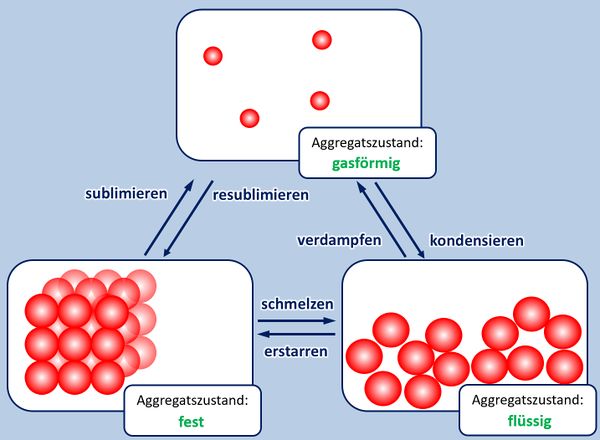
* Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A5_Aggregatszustände_ML.jpg|600px]] | ||
|Lösung|Lösung ausblenden}} | |||
|Lösung | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
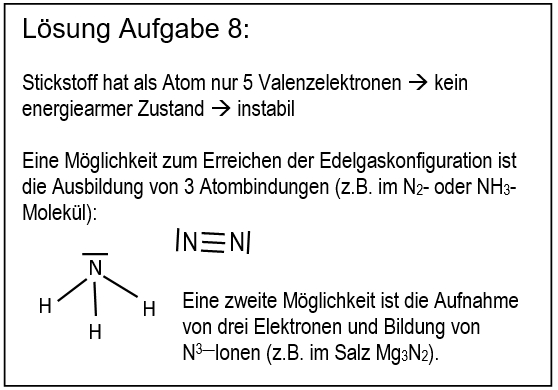
* Erkläre, warum Salze so hohe Schmelz- und Siedetemperaturen besitzen! Gehe bei Deiner Erklärung auch darauf ein, wie sich Salze aus den Elementen bilden. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Met1_IonenbildungBeiSalzen.jpg]] | ||
|Lösung | Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | ||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Nachdem die meisten Metalle bei Raumtemperatur ebenfalls fest sind, könnte man zunächst ja vermuten, dass ein ähnlicher Grund wie bei den Salzen zur starken Anziehung der Metallteilchen untereinander führt.<br> | |||
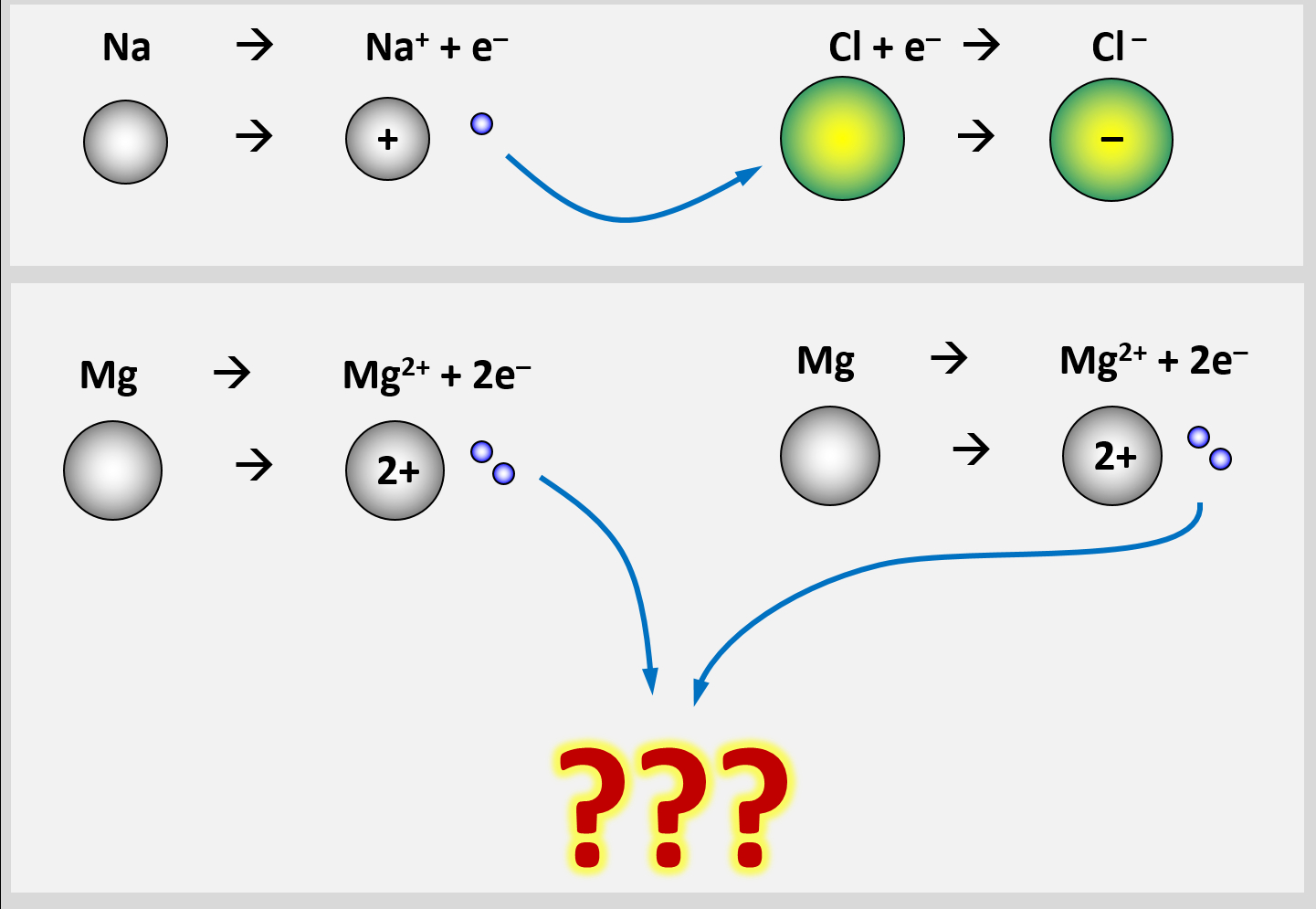
Man stößt allerdings sehr schnell auf Probleme, wenn man versucht das Bindungs-Prinzip von Salzen auf ein Stück Metall zu übertragen. Versucht zu begründen, warum in einem Stück Magnesium-Metall die Bindung der Mg-Atome aneinander keinesfalls auf den gleichen Gründen beruhen kann, wie bei einem Salzkristall. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Met1_IonenbildungUnmöglich.jpg]] | |||
|Lösung | In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, '''Elektronen abzugeben''', um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese '''Elektronen aufnehmen''' können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.<br> | ||
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Gut. Beziehungsweise: schlecht. Schauen wir noch einmal kurz auf die andere Art der Bindung, die wir bereits kennengelernt haben: Die Atombindung. Auch die funktioniert hier nicht. | |||
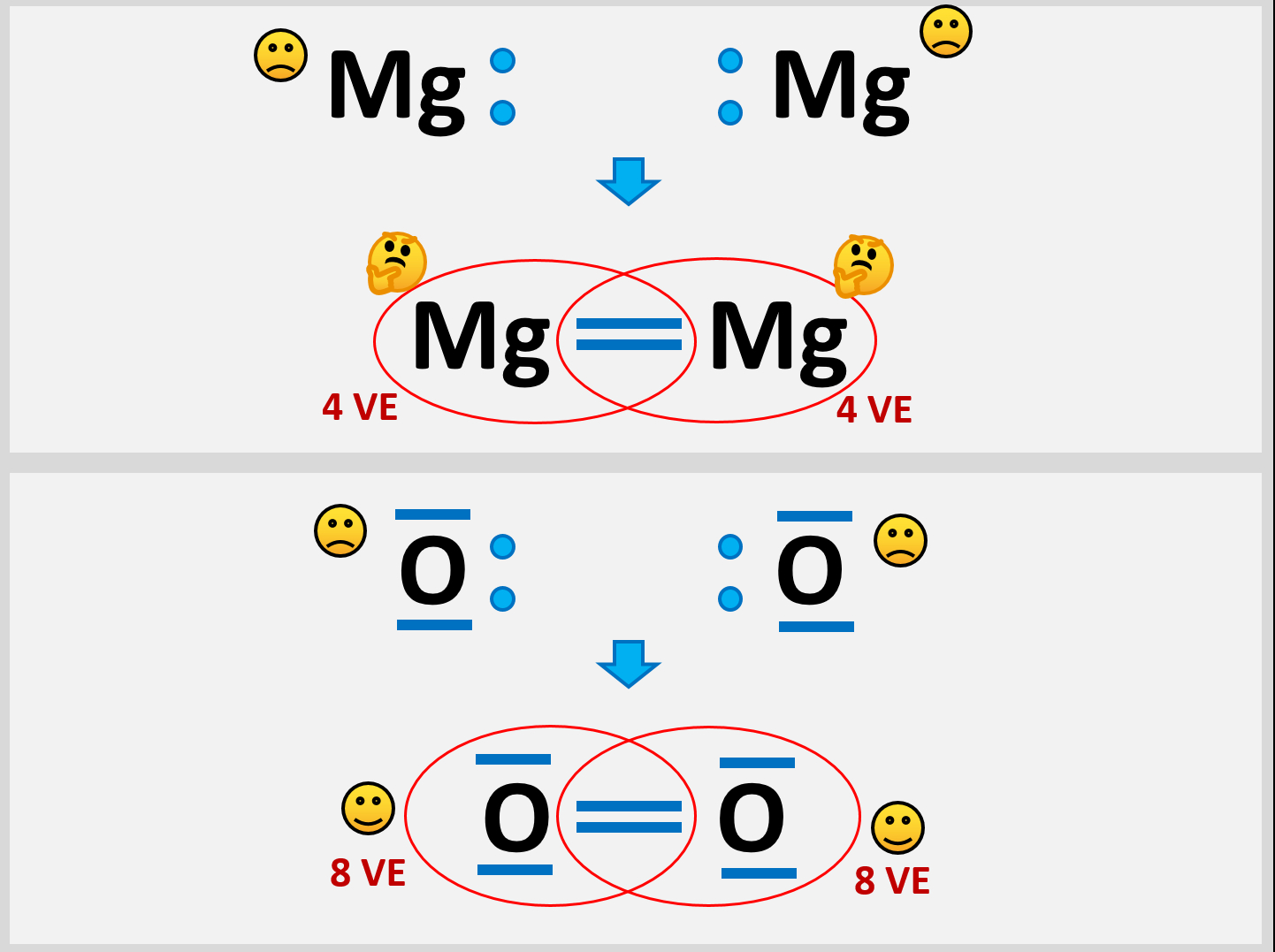
* Versuche aus zwei Mg-Atomen ein Molekül zu bilden und beschreibe genau, die Probleme, die dabei auftauchen! | |||
* Vergleicht die Situation mit einem Sauerstoff-Molekül | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Met1_AtombdgUnmöglich.jpg]] | ||
|Lösung | Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.<br> | ||
Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Die Lösung ist eigentlich simpel. Wenn man sie kennt. Von alleine darauf zu kommen ist schwierig (glaube ich). Trotzdem zeige ich euch mal ein Szenario aus der "Lebenswelt" auf und ihr versucht das auf Metall-Atome zu übertragen: Stellt euch vor, ihr wollt alle mit einem Ball spielen. Aber nicht jeder von euch hat einen. Sagen wir mal, nur jeder zweite. Was kann man tun, damit alle "zufrieden" sind? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Jeder sucht sich einen Partner, es bilden sich also Pärchen. Alle können so mit den zur Verfügung stehenden Bällen spielen. | |||
|Lösung | |Lösung|Lösung ausblenden}} | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Die oben genannte Situation könnte man mit der Situation bei Molekülen vergleichen, die ja aus Nichtmetallen aufgebaut sind: Bei Nichtmetall-Atomen sind viele Elektronen verfügbar (jedes Atom hat 6 VE). Die Elektronen entsprechen den Bällen. Wenn sich jedes Atom ein Elektron (auch zwei oder drei) Elektronen mit einem anderen Partner teilt, sind alle "zufrieden" (fachwissenschaftlich: Es entsteht ein energetisch günstiger Zustand). | |||
Bei Metallen funktioniert das nicht. Es sind einfach zu wenig Elektronen verfügbar. Wieder zurück zum Beispiel mit den Bällen: Alle (sagen wir z.B. mal 22 Schülerinnen und Schüler) wollen Ball spielen, aber es ist nur ein Ball da. Was kann man tun? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Man spielt Fußball! - Was hat das jetzt mit der Metall-Bindung zu tun? Ich gebe zu, das Beispiel ist jetzt nicht der Wahnsinn, aber soooo schlecht ist es auch nicht: Beim Fußball-Spielen teilen sich viele Menschen einen Ball. Weil alle spielen wollen, sorgt der Ball dafür, dass alle auf dem Spielfeld bleiben.<br> | |||
|Lösung|Lösung ausblenden}} | |||
| | <br> | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
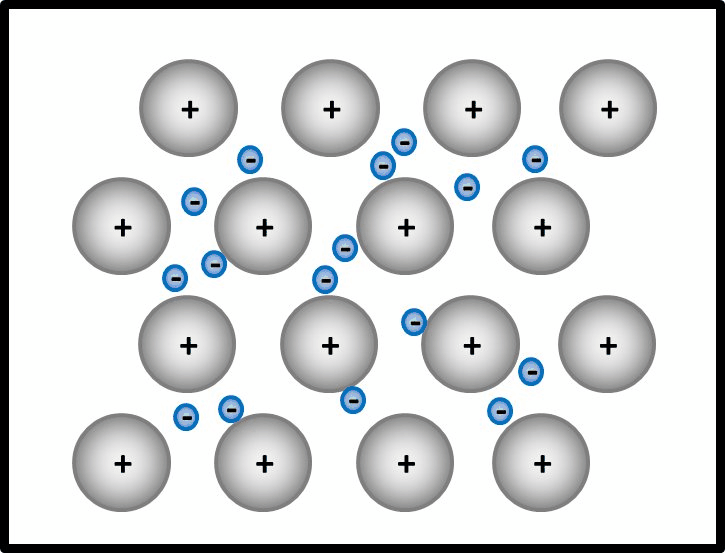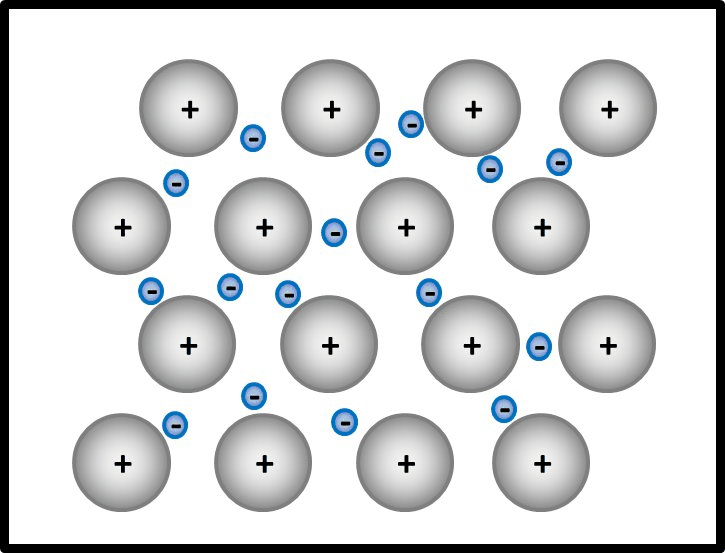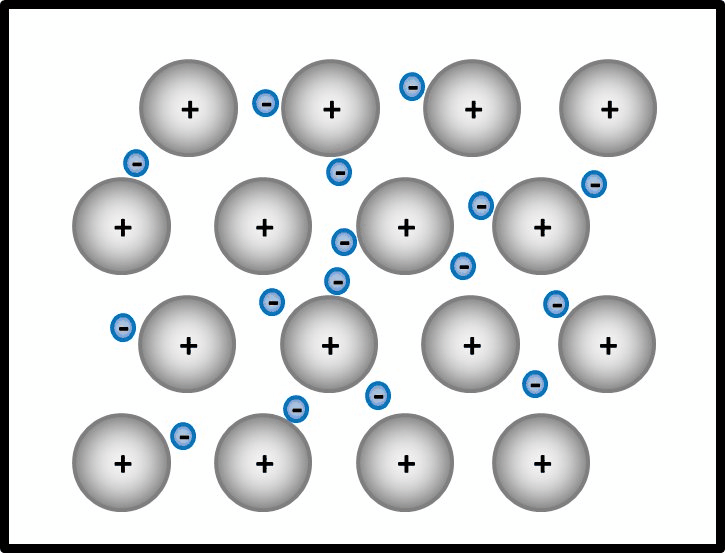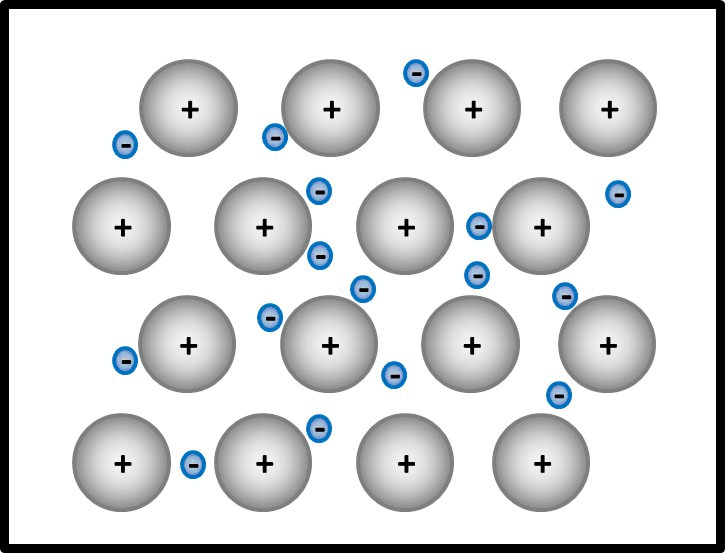
So ähnlich ist es auch bei Metallen: Alle Metall-Atome stellen ihre wenigen Valenzelektronen allen zur Verfügung. Es ist aber kein Partner da, der sie tatsächlich aufnimmt. Die Elektronen schwirren daher einfach zwischen den nun positiv geladenen Atomrümpfen herum und gehören irgendwie allen. Bildlich kann man sich das ungefähr so vorstellen: <br> | |||
[[Datei:Metallgitter_animiert_1.gif]]<br> | |||
Erklärt diese Vorstellung jetzt das Phänomen, warum Metalle in der Regel Feststoffe sind? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Ja! Metalle bestehen nach dieser Vorstellung aus '''positiv geladenen''' Teilchen: Den '''Atomrümpfen''', die durch die Abgabe von Valenzelektronen entstanden sind. Und aus '''negativ geladenen''' Teilchen: Den frei beweglichen Elektronen, auch '''Elektronengas '''genannt. Es sind hier also viele Ladungen im Spiel, die zu sehr hohen Anziehungskräften führen, ganz ähnlich wie bei den Salzen | |||
|Lösung | |Lösung|Lösung ausblenden}} | ||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Noch ein Wort zu den positiv geladenen Atomrümpfen. In der animierten Abbildung seht, ihr dass eine Reihe von Atomrümpfen immer versetzt zur vorangegangen ist und das schön regelmäßig. In Wirklichkeit ist das ganze natürlich dreidimensional. Wenn man nur die Atomrümpfe betrachtet ohne das Elektronengas, sähe das dann so aus aus (man spricht von einer '''dichtesten Kugelpackung'''): <br> | |||
[[Datei:Dichtste_bolstapeling.gif]]<br> | |||
Ähnlich wie bei Salzen, die ja auch einen regelmäßigen Aufbau besitzen, sollten also Metalle ebenfalls Kristalle bilden können. Tatsächlich tun sie das auch, aber oft nur unter bestimmten Umständen. Das folgende Bild zeigt eine Metallplatte, die in flüssiges Zink getaucht wurde. Die unterschiedlich grauen Flächen, die scharf voneinander abgegrenzt sind, stellen solche Metall-Kristalle dar:<br> | |||
[[Datei:Feuerverzinkte_Oberfläche.jpg]]<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Hausaufgabe</span> | |||
|Inhalt= | |||
Lest im Buch die S. 126 und von der S. 127 den 2. Absatz | |||
* Recherchiert (das geht auch ohne PC) das einzige Metall, das bei Raumtemperatur flüssig ist! | |||
* Recherchiert (auch das geht ohne PC) ein Metall, das in der Hand schmilzt! | |||
* Formuliert in einem Satz eine Antwort auf die Frage: Was ist eine Legierung? | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
== Arbeitsauftrag Chemie7 == | |||
{{Box-spezial | |||
|Titel= '''Metalle''' | |||
|Inhalt= | |||
Zu vielen Stoffen eures Alltags könnt ihr aus chemischer Sicht jetzt schon etwas sagen: Die meisten Gegenstände, mit denen ihr in Berührung kommt sind aus '''Molekülen '''aufgebaut: Eure Kleidung, Kunststoffe, Nahrungsmittel. Ihr wisst inzwischen, dass hier Elektronen zwischen Atomen geteilt werden und dadurch eine Bindung entsteht. <br> | |||
Einige Stoffe in eurem Alltag gehören zu den '''Salzen''': z.B. Rohrreiniger (gut, den verwendet ihr jetzt wahrscheinlich nicht so oft), Kochsalz, aber auch keramische Werkstoffe (wie eine Tasse oder ein Teller) gehören hierher. Auch über den Aufbau von Salzen habt ihr schon einiges gelernt: Ihr kennt Ionen, also geladene Teilchen, die zu starken Anziehungskräften in Salzen führen. <br> | |||
Es gibt aber noch eine dritte große Gruppe von Stoffen, die besprochen werden muss: Die ''' Metalle'''! - Heute eine ganz einfache Aufgabe: Sucht in eurem Haushalt drei völlig verschiedene Gegenstände '''aus Metall'''. Legt diese auf ein Blatt Papier und schreibt stichpunktartig darunter, warum dieser Gegenstand wohl aus Metall und nicht aus einem anderen Material (z.B. Plastik) gefertigt worden ist. Macht ein Foto davon und schickt es mir an folgende E-Mail-Adresse: r m g . l u x [at] w e b . d e (ohne die Leerzeichen und das at in eckigen Klammern ist das „Klammeraffen“-Symbol. | |||
Wenn die Gegenstände zu groß sind und nicht auf ein Blatt Papier passen, macht erst Fotos davon, fügt die drei Bilder z.B. in eine PowerPoint-Präsentation ein und schreibt eure Stichpunkte dann darunter. Bitte schickt nicht die PowerPoint-Präsentation sondern wieder ein Foto davon! | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 146: | Zeile 590: | ||
== Arbeitsauftrag Chemie6 == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Wiederholung'''</span> | ||
|Inhalt= | |Inhalt= | ||
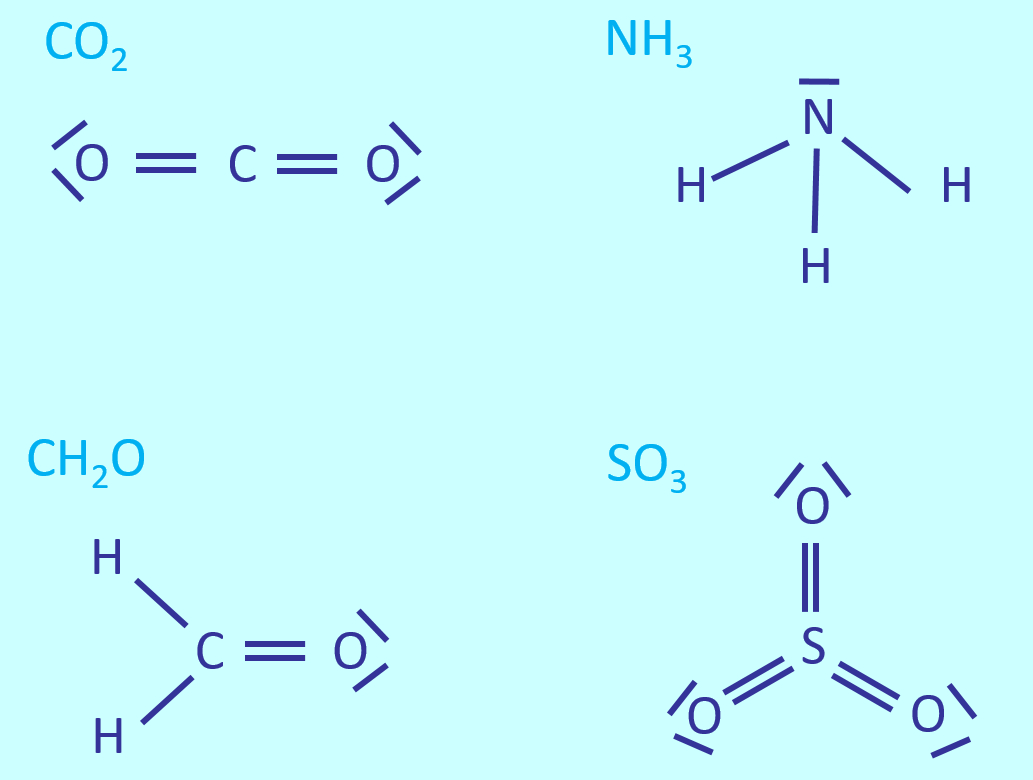
Ein paar einfache Aufgaben, um euch nach zwei Wochen Ferien langsam wieder auf Betriebs-Temperatur zu bringen: | |||
< | |||
* Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | ||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
* Stellt die Bildung der folgenden Salze aus den Element in Form von chemischen Gleichung dar: Calciumoxid, Aluminiumchlorid, Magnesiumnitrid | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:A6_WH_Lsg2_Salzgleichungen.jpg]] | ||
|Lösung|Lösung ausblenden}} | |||
| | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">Das war es schon für heute</span> | |||
|Inhalt= | |||
Falls ihr Schwierigkeiten mit den Aufgaben hattet, meldet euch bitte bei mir. | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
== Arbeitsauftrag Chemie5 == | |||
* Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. | |||
* Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift und Ruhe. | |||
* Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt! | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung: Aggregatszustände'''</span> | |||
|Inhalt= | |||
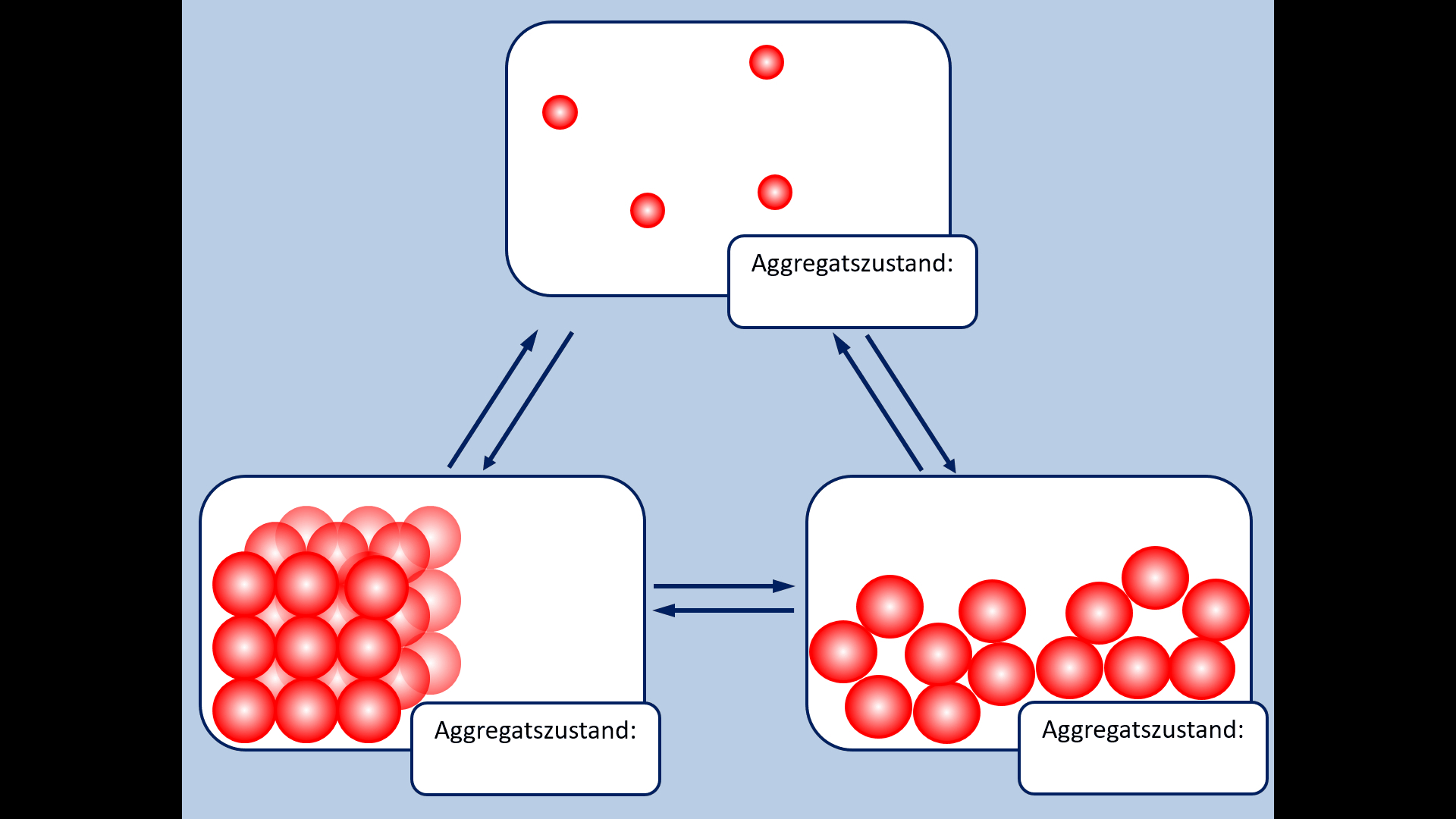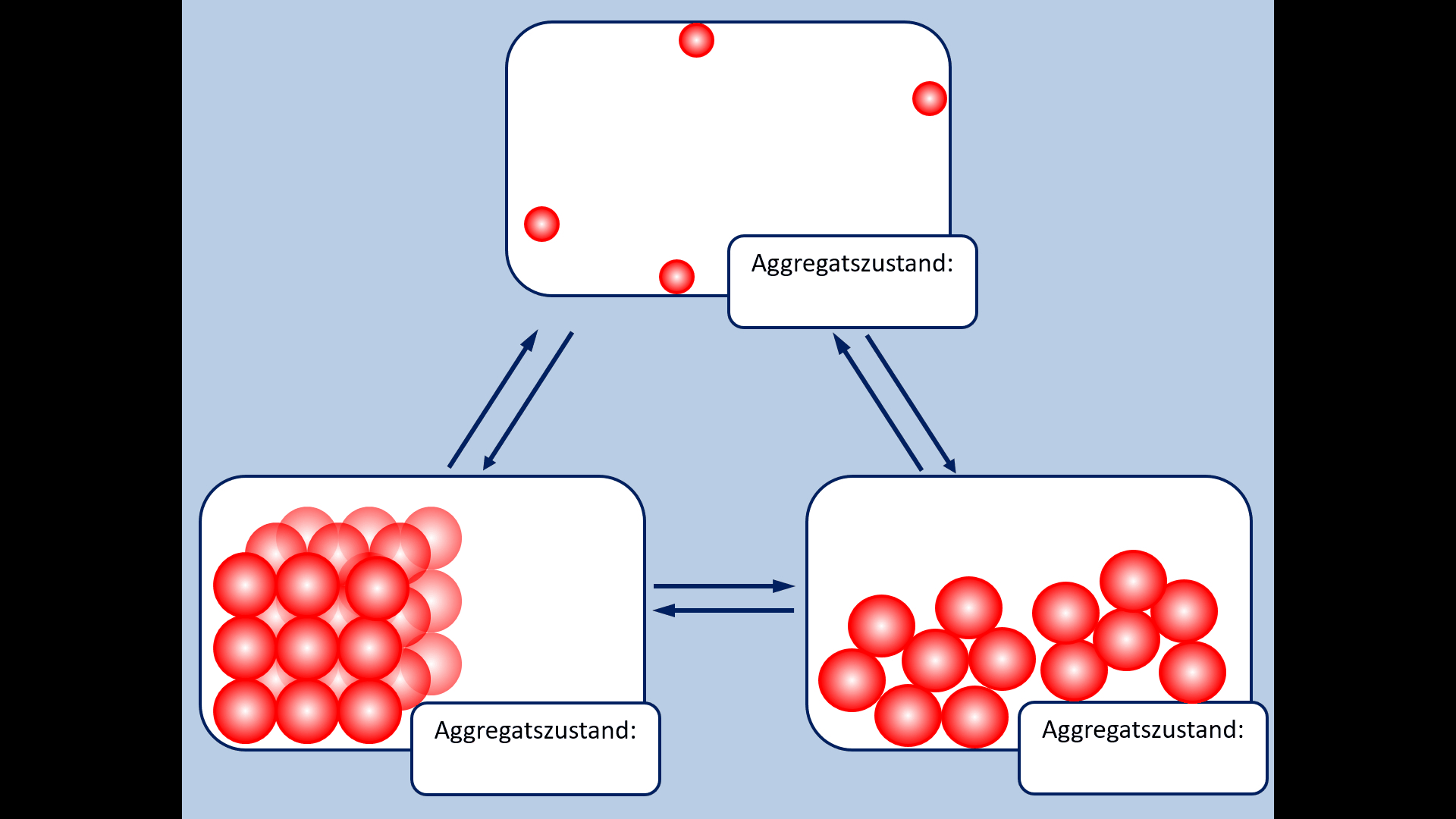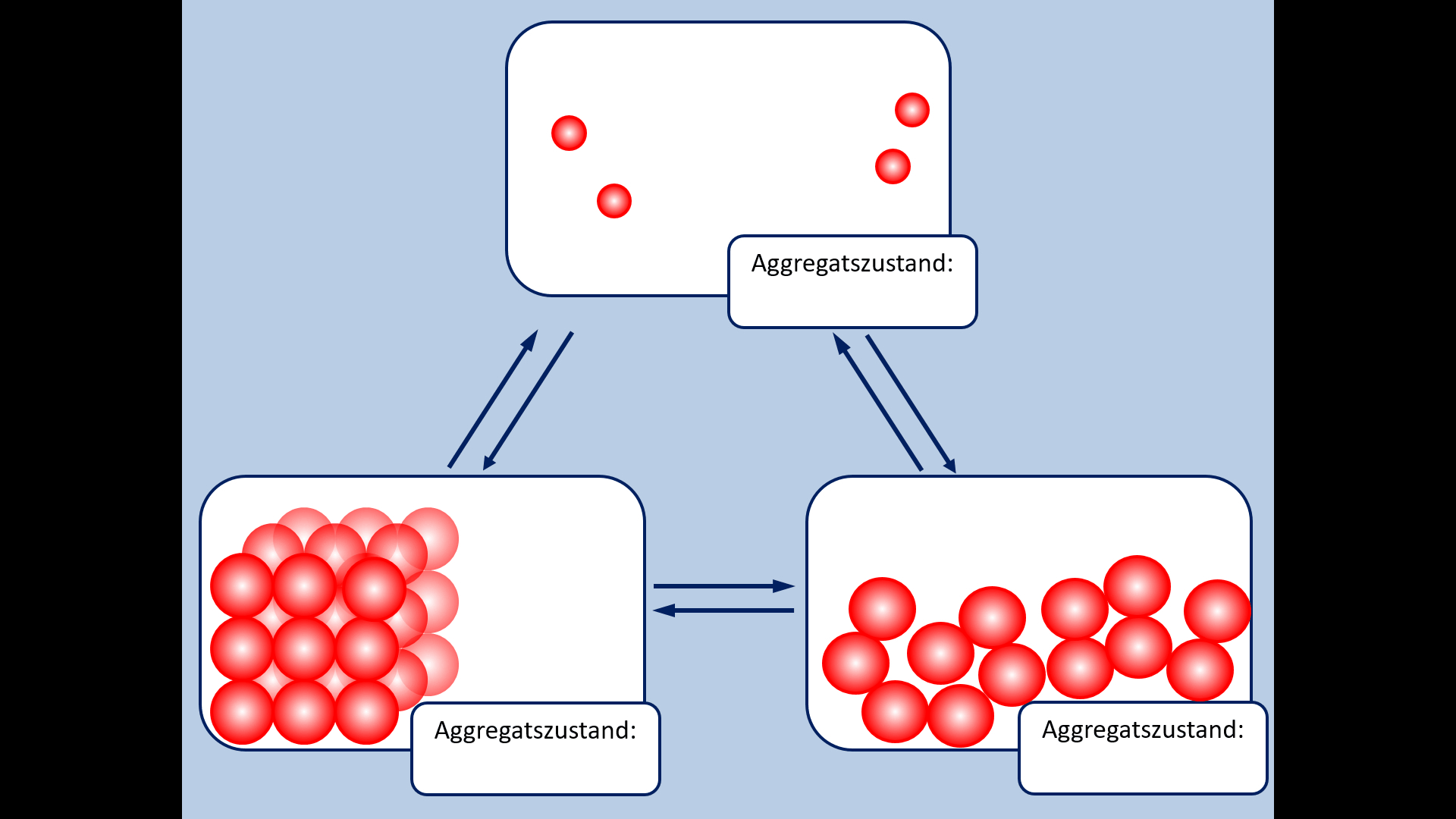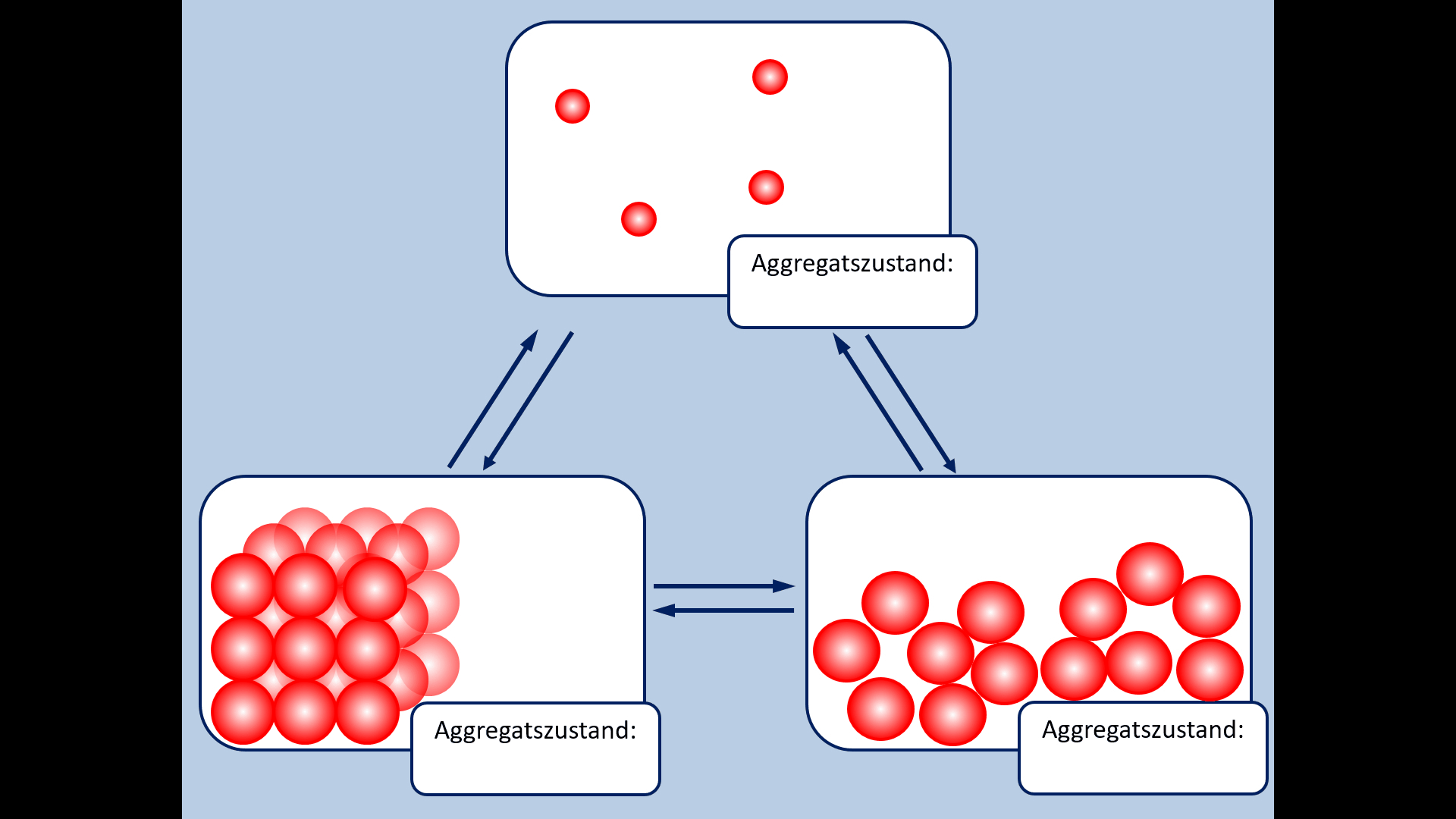
Zu Beginn der 9. Jahrgangsstufe in Chemie wurden die Aggregatszustände von Stoffen besprochen. Ebenso die Fachbegriffe für die Vorgänge wenn ein Stoff von einem in einen anderen Aggregatszustand wechselt. Zur Auffrischung dieser Inhalte noch einmal die entsprechende Abbildung: | |||
[[Datei: | [[Datei:A5_Aggregatszustände_GIF.gif]]<br> | ||
<br> | <br> | ||
* Ergänzt die fehlenden Fachbegriffe! | |||
* | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:A5_Aggregatszustände_ML.jpg|600px]] | |||
|Lösung 1|Lösung ausblenden}} | |Lösung 1|Lösung ausblenden}} | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
''' | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Anziehungskräfte'''</span> | |||
|Inhalt= | |||
Bei Raumtemperatur (und "normalem" Druck) liegen verschiedene Stoffe in verschiedenen '''Aggregatszuständen '''vor, z.B. ist Sauerstoff '''gasförmig''', Wasser '''flüssig '''und Wachs '''fest'''. Um auch Wasser und Wachs bei Raumtemperatur in den gasförmigen Zustand zu überführen, muss man Energie zuführen, am einfachsten in Form von Wärme (es ginge auch z.B. durch "Mikrowellen"). <br> | |||
Bei 100° schafft man es zwar Wasser zu verdampfen, also die Wasserteilchen voneinander zu trennen, mit Wachs klappt das bei dieser Temperatur aber noch nicht.<br> | |||
Stelle eine begründete Vermutung auf, woran das liegen könnte! (Schreibe einen kurzen, vernünftigen Satz.) | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Die Kräfte, die die Wasserteilchen zusammenhalten und verhindern, dass sie sich bei Raumtemperatur voneinander lösen sind nicht so stark wie die Kräfte, die die Wachsteilchen zusammenhalten. | |||
|Lösung 2|Lösung ausblenden}} | |Lösung 2|Lösung ausblenden}} | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Kräfte bei Salzen'''</span> | |||
|Inhalt= | |||
Inzwischen wisst ihr bereits einiges über den Aufbau von bestimmten Stoffen, z.B. Salzen. Ihr wisst, dass die '''festen''' Salzkristalle aus einer großen Menge unterschiedlich '''geladener Ionen''' zusammengesetzt sind, die sich alle gegenseitig anziehen. Es gibt also einen logischen Zusammenhang zwischen dem Bau und dem Aggregatszustand dieser Stoffe: Alle am Aufbau beteiligten Teilchen sind geladen, ziehen sich gegenseitig an und das entspricht starken Anziehungskräften. Es ist daher sehr viel Energie nötig, um diese Kräfte zu überwinden und Salze zu schmelzen oder zu verdampfen (z.B. liegt der Sdp. von Kochsalz (NaCl) bei 1461°C). <br> | |||
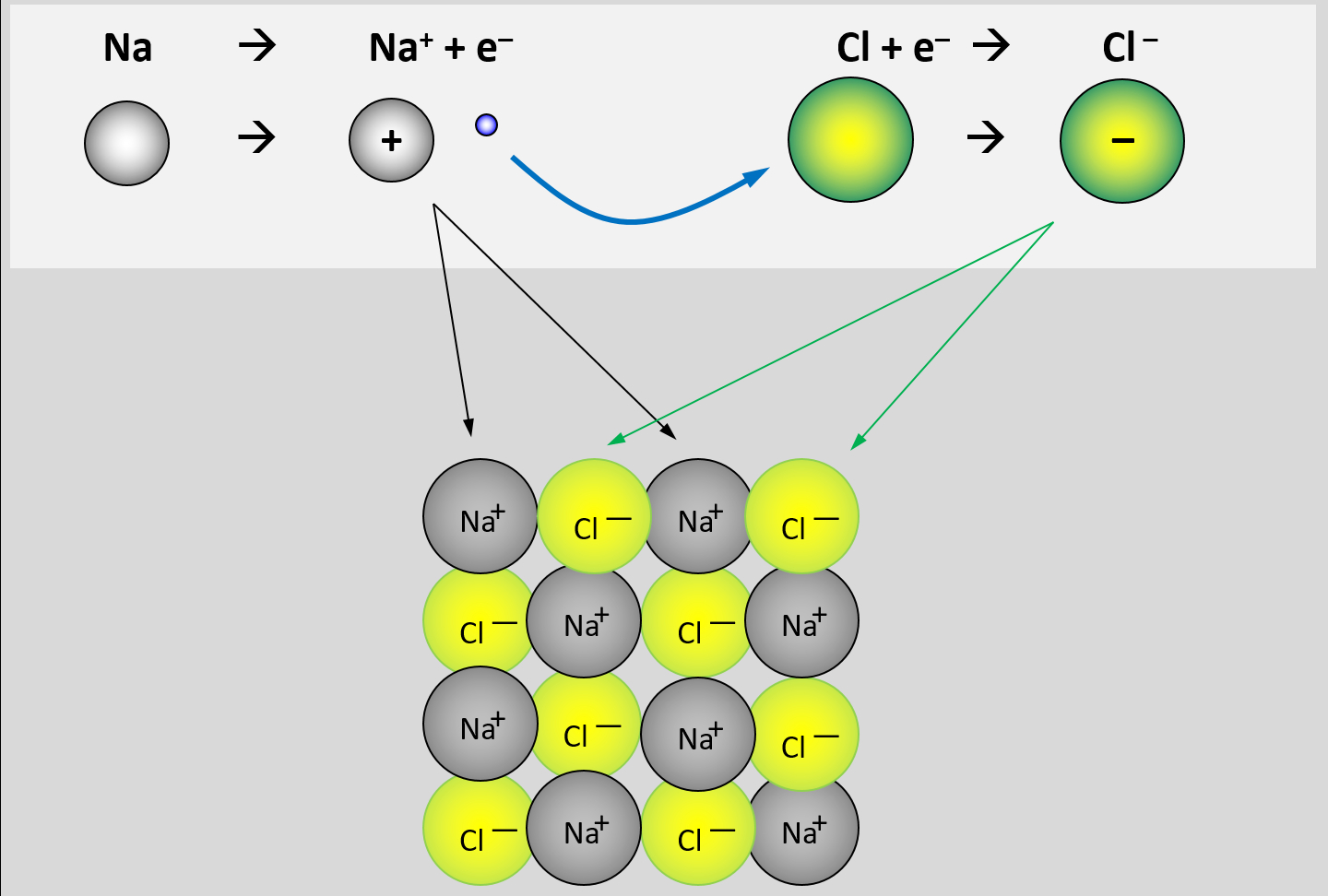
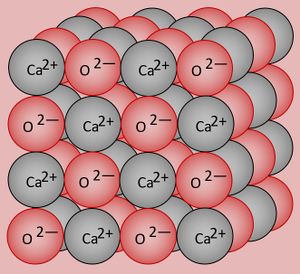
* Zur Wiederholung: Zeichnet den Ausschnitt aus einem Calciumoxid-Kristall (CaO)! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Calcium besitzt 2 VE und wird diese in Verbindungen abgeben (Ca -> Ca<sup>2+</sup> + 2e<sup>-</sup>. Sauerstoff besitzt 6 VE, wird in Verbindungen also 2 aufnehmen (O + 2e<sup>-</sup> -> O<sup>2-</sup>. Damit aus diesen Ionen eine neutrales Salz entsteht, muss jeweils ein O-Atom mit einem Ca-Atom reagieren. Die chemische Formel für das Salz lautet daher CaO. Ein Ausschnitt aus dem Kristallgitter könnte so aussehen: <br> | |||
[[Datei:A5_CaO_Gitter.jpg|300px]] | |||
|Lösung 3|Lösung ausblenden}} | |Lösung 3|Lösung ausblenden}} | ||
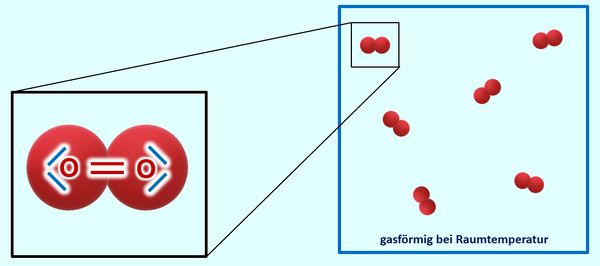
Warum Sauerstoff bei Raumtemperatur gasförmig vorliegt, solltet ihr inzwischen auch gut nachvollziehen können: Über das Sauerstoffmolekül habt ihr gelernt, dass sich zwei Sauerstoffatome über eine Doppelbindung zwei Elektronenpaare teilen und zusammen mit ihren freien Elektronenpaaren jeweils 8 VE zugerechnet bekommen. Damit liegt Edelgaskonfiguration vor. Es gibt zum jetzigen Zeitpunkt für euch keinen Grund anzunehmen, dass zu benachbarten Sauerstoffmolekülen irgendwelche Anziehungskräfte ausgebildet werden. Die Moleküle sind also voneinander getrennt und damit gasförmig: <br> | |||
[[Datei:A5_O2_Valenz_u_Aggregatszusatnd.jpg|600px]]<br> | |||
<br> | |||
'''Das Problem:'''<br> | |||
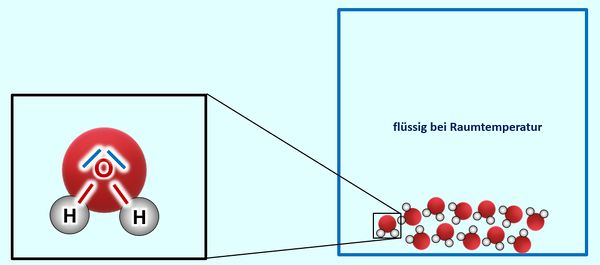
Ihr habt auch den Stoff Wasser als Molekül kennengelernt. Auch hier könnt ihr erklären, warum ein Sauerstoff-Atom mit genau zwei Wasserstoffatomen eine Bindung eingeht. Mehr aber auch nicht. Auch hier sollte es keinen Grund geben, warum sich diese Moleküle '''untereinander '''anziehen sollten. '''Offensichtlich tun sie es aber doch.''' Denn bei Raumtemperatur ist Wasser flüssig, die Moleküle hängen also irgendwie aneinander. Erst bei 100°C "lassen sie sich offenbar los": | |||
[[Datei:A5_H2O_Valenz_u_Aggregatszusatnd.jpg|600px]]<br> | |||
<br> | |||
'''Die Lösung:'''<br> | |||
Ich muss euch enttäuschen... oder zumindest "vertrösten". Die genaue Begründung, warum sich Wassermoleküle auch gegenseitig anziehen, werdet ihr erst in der nächsten Jahrgangsstufe kennenlernen. <br> | |||
Das einzige, was ihr aus dieser Unterrichtsstunde mitnehmen sollt, lautet: <br> | |||
<br> | |||
Auch '''zwischen''' Molekülen existieren '''Anziehungskräfte'''. Man nennt sie... (Spannung, Trommelwirbel):<br> | |||
<br> | <br> | ||
' | <span style="color:#800">'''Zwischenmolekulare Kräfte'''</span> Wahnsinn, oder? | ||
<br> | <br> | ||
* Lest jetzt auf der Seite 109 den letzten Absatz "Moleküle bilden Molekülgitter" | |||
* | * Legt jetzt das Buch beiseite. | ||
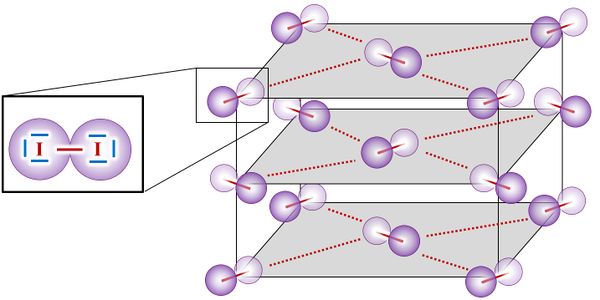
* Betrachtet die folgende Abbildung und erklärt, was die (dunkelroten) durchgezogenen Linien bedeuten und was die gestrichelten Linien bedeuten! | |||
[[Datei:A5_I2_Molekülgitter.jpg|600px]]<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Die durchgezogenen Linien symbolisieren die Atombindungen, die zwei Iod-Atome zu einem Iod-Molekül verbinden. Die gestrichelten Linien symbolisieren die zwischenmolekularen Anziehungskräfte zwischen den Iod-Molekülen. Diese müssen überwunden werden, wenn man Iod in den gasförmigen Zustand überführen möchte (Iod sublimiert). | |||
|Lösung 4|Lösung ausblenden}} | |Lösung 4|Lösung ausblenden}} | ||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 239: | Zeile 715: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''optional (freiwillig)'''</span> | |||
|Inhalt= | |||
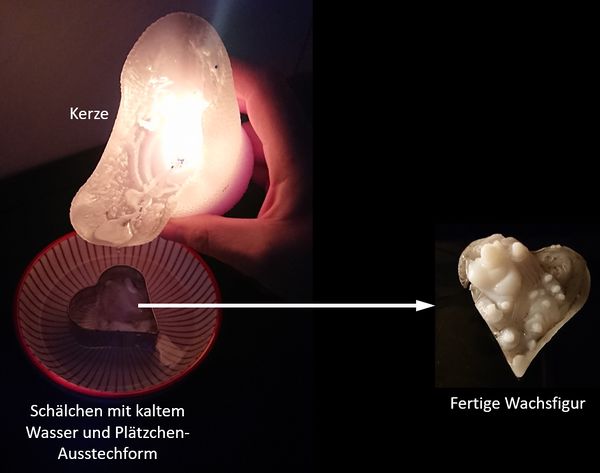
Durftet ihr als Kinder "Wachstropfen" machen? Falls nicht, hier eine kurze Anleitung: <br> | |||
Nehmt ein Schälchen mit Wasser und stellt ein Plätzchen-Ausstech-Förmchen hinein. Das Förmchen sollte zur Hälfte ins Wasser eintauchen. Zündet eine Kerze an und lasst das Wachs ins Förmchen tropfen. (Der Zusammenhang mit dieser Unterrichtseinheit ist: Durch die Flamme überführt ihr die Moleküle des Wachses zunächst in den flüssigen Zustand, ein Teil verdampft sogar und verbrennt. Das flüssige Wachs tropft ins Förmchen und erstarrt im kalten Wasser recht schnell. | |||
Ihr erhaltet dann eine Fachsfigur in der Form der Ausstech-Figur: | |||
[[Datei:A5_optional_Wachstropfen.jpg|600px]]<br> <br> | |||
<br> | |||
* Ihr könnt natürlich farbige (auch mehrere verschiedene) Kerzen nehmen. | |||
* Ihr müsst kein Herz nehmen! Es geht alles, von mir aus auch ein Totenkopf (wenn ihr so etwas als Plätzchen-Ausstech-Förmchen habt. | |||
* Fertigt eine solche Figur an und schenkt sie einem Familienmitglied oder eurer besten Freundin / bestem Freund. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
Keine Hausaufgabe, da das die letzte Stunde vor den Ferien war. Erholt euch gut, trotz Ausgangsbeschränkungen und dem Fall, dass ihr eventuell unter Quarantäne steht. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie4 | == Arbeitsauftrag Chemie4 == | ||
* Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. | * Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. | ||
* Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe. | * Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe. | ||
| Zeile 348: | Zeile 856: | ||
|Inhalt= | |Inhalt= | ||
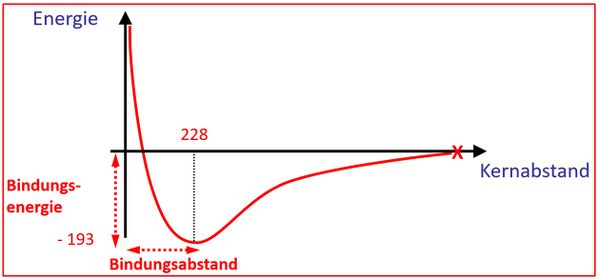
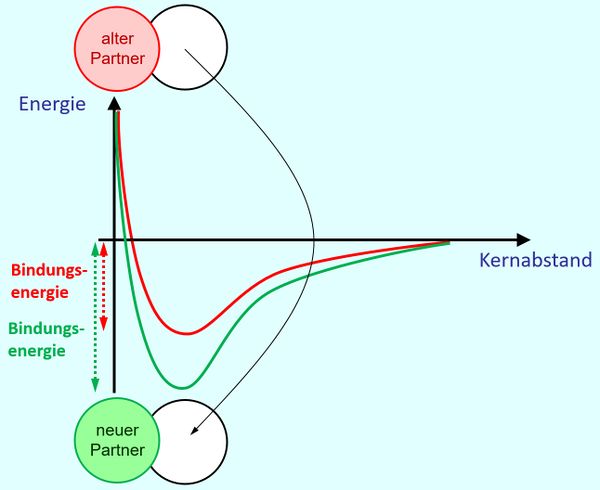
Als Hausaufgabe bearbeitet ihr bitte S. 107 A4. Die Lösung wird erst am Mittwoch hochgeladen. | Als Hausaufgabe bearbeitet ihr bitte S. 107 A4. Die Lösung wird erst am Mittwoch hochgeladen. | ||
|Farbe= # | |||
{{Lösung versteckt| | |||
Es könnte sein, dass bei der neuen Bindung mehr Energie frei wird als bei der alten Bindung: <br> | |||
[[Datei:A4_E_Abstandsdiagramm_HAVerb.jpg|600px]] | |||
|Lösung 3|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
== Arbeitsauftrag Chemie3 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie3 (verpflichtend) '''</span> | |||
|Inhalt= | |||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel und einen Stift. Und Ruhe. Voraussetzung für die Bearbeitung ist, dass ihr Arbeitsauftrag '''Chemie2''' erledigt habt (vom Mo, 23.03.). Am Ende erhaltet ihr einen Hefteintrag sowohl für die Einheit Chemie2 als auch Chemie3. Den könnt ihr abschreiben (bitte nur im Notfall) oder ausdrucken und einkleben.</span><br> | |||
<span style="color:#607">'''Bitte klickt erst auf "Lösung", wenn ihr die Aufgabe wirklich versucht habt zu lösen.'''</span><br> | |||
<br> | |||
'''Verbesserung der Hausaufgabe'''<br> | |||
* Buch S. 107, A1 | |||
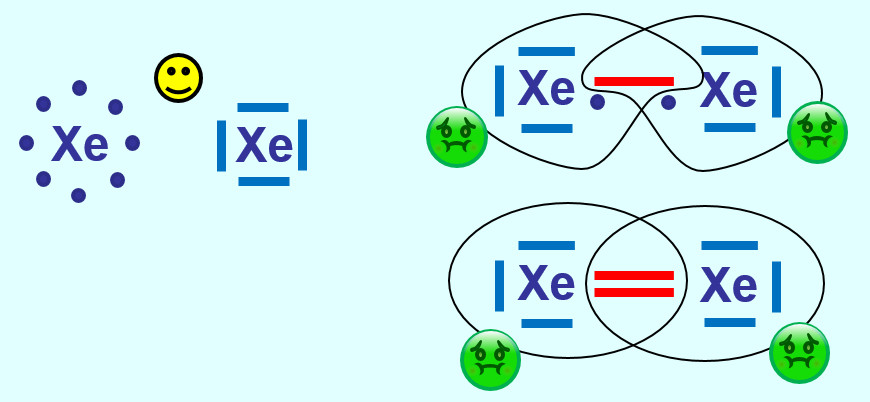
{{Lösung versteckt| | |||
[[Datei:A2_HA_S107_A1.jpg]]<br> | |||
Xenon hat bereits Edelgaskonfiguration (8 VE auf der äußersten Schale). Durch eine (oder mehr) Atombindung(en) mit einem weiteren Xenon-Atom würde dieser energiearme Zustand zerstört werden. Daher kommen alle Edelgase einatomige Gase vor, im Gegensatz zu den anderen elementaren Gasen (wie z.B. Sauerstoff, Stickstoff, Wasserstoff...) | |||
|Hausaufgabe 1|Lösung ausblenden}} | |||
* Buch S. 107, A3 | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_S107_A3.jpg]]<br> | |||
Ein Natrium-Atom könnte mit seinem '''einen Valenzelektron''' lediglich '''eine Atombindung''' aufbauen. Dadurch käme eine Konfiguration zustanden, bei der dem Atom zwei Elektronen zugeordnet werden können. Das ist weit entfernt von einer Edelgaskonfiguration und daher auch nicht stabil. | |||
|Hausaufgabe 2|Lösung ausblenden}} | |||
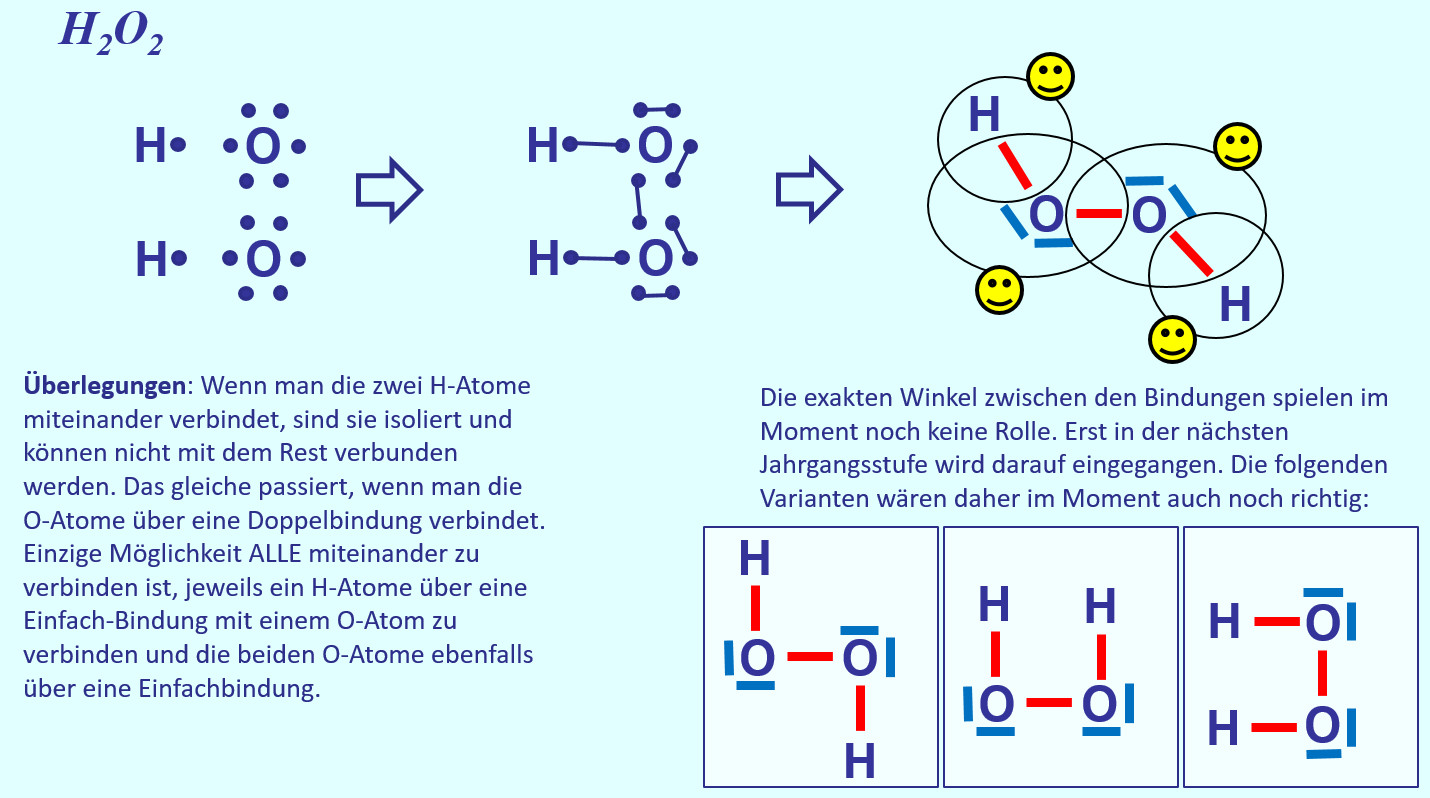
* Zeichne die Valenzstrichformel für Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_H2O2.jpg]]<br> | |||
|Hausaufgabe 3|Lösung ausblenden}} | |||
Neu: '''Unterschiede zwischen Salzen und Molekülen''' <br> | |||
Bevor wir uns einige Spezialfälle beim Aufstellen von Valenzstrichformeln anschauen, soll hier zunächst noch einmal der Unterschied zwischen Salzen und Molekülen etwas genauer beleuchtet werden: Die chemischen Formeln '''CaF<sub>2</sub>''' und '''CO<sub>2</sub>''' sehen sich auf den ersten Blick recht ähnlich: Beide enthalten drei Atome, eines davon kommt doppelt vor. Auf Teilchen-Ebene betrachtet bedeuten sie jedoch etwas völlig anderes. <br> | |||
<br> | |||
'''Zunächst zum Calciumfluorid (CaF<sub>2</sub>)''': Es gibt kein einzelnes CaF<sub>2</sub>-Teilchen. CaF<sub>2</sub> ist ein Salz und besteht aus sehr vielen Ca<sup>2+</sup>- und sehr vielen F<sup>-</sup>-Ionen. Alle ziehen aufgrund der unterschiedlichen Ladungen an ihren entgegen gesetzt geladenen Nachbarn, in alle Richtungen. Es entstehen riesige Gebilde, die Salzkristalle. Insgesamt ist das Verhältnis der vorliegenden Ionen in einem solchen Salzkristall aber immer 1 : 2. Nur so können sich die Ladungen exakt neutralisieren und es entsteht ein ungeladener Stoff (wären Salze geladen, würde man z.B. beim Berühren eine elektrischen Schlag bekommen). Das folgende Bild zeigt den Ausschnitt aus einem CaF<sub>2</sub>-Kristall. Weiß dargestellt sind die Ca<sup>2+</sup>-Ionen, die F<sup>-</sup>-Ionen grün. Man kann erkennen, dass Calcium-Ionen jeweils von acht Fluorid-Ionen als direkte Nachbarn umgeben sind (der graue Würfel links in der Abbildung), während Fluorid-Ionen jeweils nur von vier Calcium-Ionen als direkte Nachbarn umgeben sind (die graue pyramidenähnliche Figur rechts in der Abbildung). Pro Fluorid-Ion sind also doppelt so viele Calcium-Ionen vorhanden. | |||
[[Datei:CaF2_polyhedra.png|300px]]<br> | |||
<br> | |||
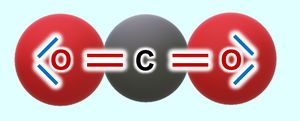
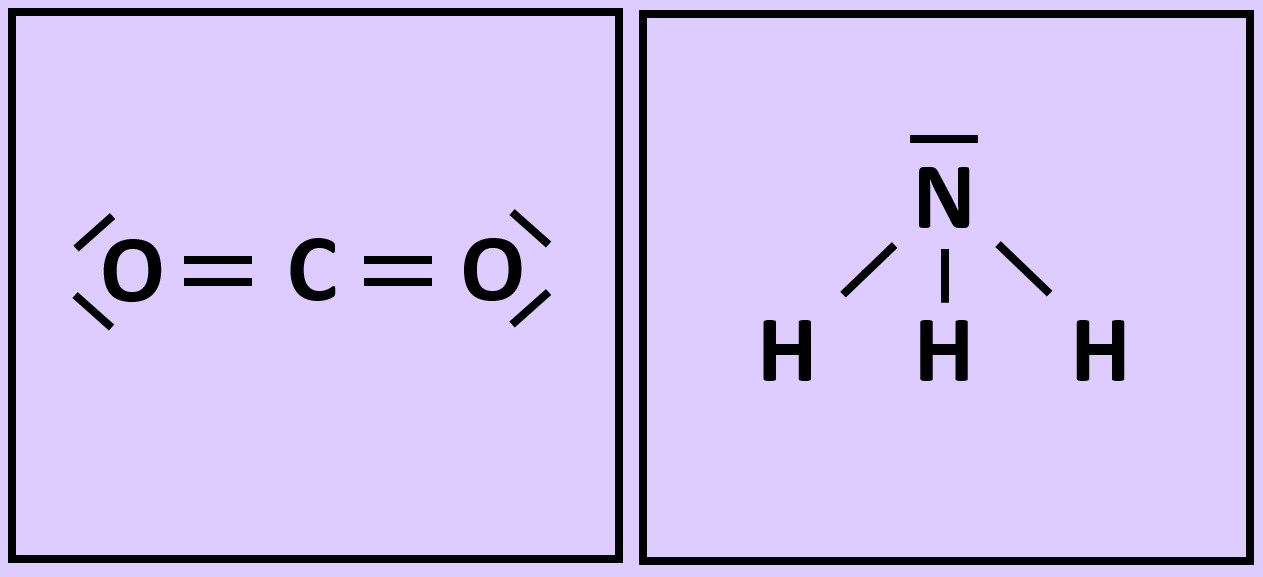
'''Nun zum Kohlenstoffdioxid (CO<sub>2</sub>)''': Hier gibt es tatsächlich einzelne CO<sub>2</sub>Teilchen. Jeweils eine Doppelbindung verbindet genau ein Sauerstoffatom mit dem zentralen Kohlenstoffatom. Diese drei Atome bilden eine Einheit, eben das Molekül. Mit anderen Teilchen tritt zunächst keine Wechselwirkung auf (später werden wir sehen, dass dies nicht korrekt ist, für den Moment bleiben wir aber bei dieser Annahme).<br> | |||
[[Datei:A3_CO2_Einzelmolekül.jpg|300px]]<br> | |||
<br> | |||
Woran erkennt man nun, ob ein Salz oder ein Molekül vorliegt? Im Moment ist auch das noch recht einfach: '''Salze '''liegen vor, wenn es sich um eine Verbindung aus '''einem Metall und einem Nichtmetall''' handelt. '''Moleküle '''liegen vor, wenn es sich um eine Verbindung '''aus Nichtmetallen untereinander''' handelt. <br> | |||
* Entscheidet, ob es sich bei den folgenden Verbindungen um ein Salz oder einen molekularen Stoff handelt (Im PSE in eurem Buch auf der letzten Seite kann man erkennen, ob ein Element zu den Metallen oder Nichtmetallen gezählt wird): NO<sub>2</sub>, K<sub>2</sub>O, Al<sub>2</sub>O<sub>3</sub>, N<sub>2</sub>O<sub>3</sub> | |||
{{Lösung versteckt| | |||
* NO<sub>2</sub>: Stickstoff(N) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: NO<sub>2</sub> ist ein '''molekularer Stoff''' | |||
* K<sub>2</sub>O: Kalium (K) ist ein Metall, Sauerstoff (O) ein Nichtmetall, das bedeutet: K<sub>2</sub>O ist ein '''Salz''' | |||
* Al<sub>2</sub>S<sub>3</sub>: Aluminium (Al) ist ein Metall, Schwefel (S) ein Nichtmetall, das bedeutet: Al<sub>2</sub>S<sub>3</sub> ist ein '''Salz''' | |||
* SO<sub>3</sub>: Schwefel (S) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: SO<sub>3</sub> ist ein '''molekularer Stoff''' | |||
|Lösung 1|Lösung ausblenden}} | |||
'''Zurück zu den Valenzstrichformeln für Moleküle:''' <br> | |||
In der letzten Unterrichtseinheit habt ihr gesehen, wie man die Valenzstrichformel für Moleküle aufstellt. In eurem Buch ist ein mathematisches Verfahren dazu beschrieben. Ich persönlich finde es etwas umständlich und glaube, das man auch ohne dieses Verfahren auskommt. Einfach indem man sich ein paar sinnvolle Gedanken macht und etwas herumprobiert. Ihr dürft aber gerne das mathematische Verfahren anwenden. | |||
* Versucht nun eine Valenzstrichformel für das Molekül Schwefeldioxid (SO<sub>2</sub>) aufzustellen! | |||
{{Lösung versteckt| | |||
Wenn ihr etwas Geduld aufgebracht habt, kommt ihr vielleicht zu der folgenden Lösung: <br> | |||
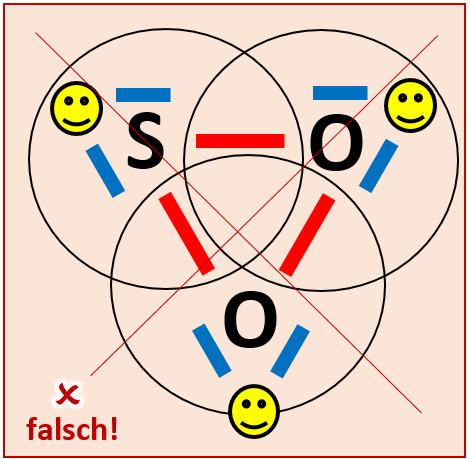
[[Datei:A3_SO2_falsch.jpg]]<br> | |||
Obwohl hier alle drei Atome Edelgaskonfiguration aufweisen würden, bildet sich dieses Molekül nicht! Diese Lösung ist daher leider falsch. Aber woran liegt das? | |||
|Lösung 2|Lösung ausblenden}} | |||
Das Problem ist die Geometrie. Ein Effekt, den ich euch im Moment nicht näher erläutern kann, führt dazu, dass '''Dreiecks- und Vierecks-Verbindungen''' so gut wie nie stabil sind und sich daher auch (fast) nicht bilden. Die oben abgebildete Variante eines SO<sub>2</sub>-Moleküls wäre eine Dreiecks-Verbindung. <br> | |||
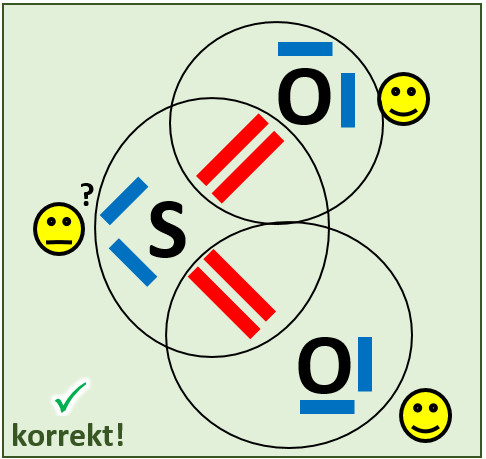
Wenn ihr weiter versucht, eine Lösung zu finden, werdet ihr vermutlich verzweifeln. Es fehlt euch nämlich noch eine wichtige Zusatzinformation. Zunächst zeige ich euch aber die richtige Strukturformel. Klickt auf "Anzeigen", schaut euch das Molekül an und erklärt, warum diese Variante nach eurem bisherigen Wissenstand falsch sein sollte: | |||
{{Lösung versteckt| | |||
[[Datei:A3_SO2_richtig.jpg]] | |||
|Anzeigen|Lösung ausblenden}} | |||
{{Lösung versteckt| | |||
Dem Schwefel-Atom werden in dieser Anordnung '''zehn Valenzelektronen''' zugeordnet. Das ist kein Edelgaszustand. | |||
|Lösung 3|Lösung ausblenden}} | |||
Dennoch ist dieser Zustand stabiler als die Dreiecksverbindung. Man darf allerdings nicht jedem Atom in Molekülen mehr als acht Valenzelektronen zuordnen! Das ist nur möglich, wenn es sich um Elemente der 3. Periode oder noch höher handelt. Für Elemente der 2. Periode gilt die '''Oktettregel '''streng (ohne Ausnahme):<br> | |||
<br> | |||
''Atome besitzen in Verbindungen oft eine Elektronenkonfiguration, bei der auf der äußersten Schale '''acht Elektronen''' sitzen.''<br> | |||
<br> | |||
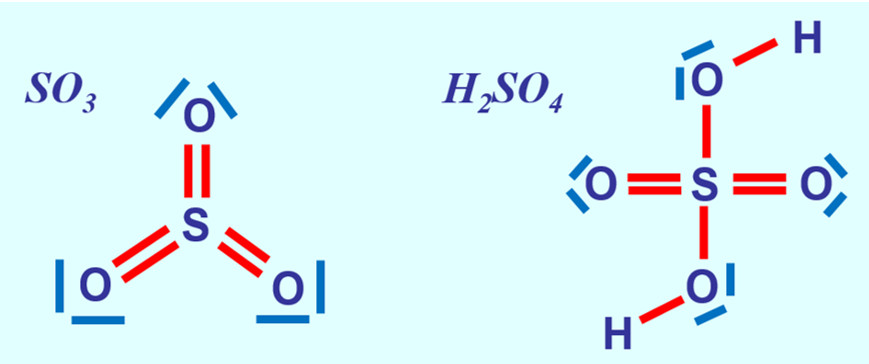
Nachdem Schwefel ein Element der 3. Periode ist, kann im SO<sub>2</sub> das '''Oktett '''(also 8 VE) überschritten werden. | |||
* Wendet dieses neue Wissen jetzt an und stellt die Valenzstrichformeln für Schwefeltrioxid SO<sub>3</sub> (leicht) und Schwefelsäure H<sub>2</sub>SO<sub>4</sub> (schwer) auf! | |||
{{Lösung versteckt| | |||
[[Datei:A3_SO3_H2SO4.jpg]] | |||
|Lösung 4|Lösung ausblenden}} | |||
Ihr könnt euch nun die Hefteinträge für die letzten beiden Einheiten herunterladen: | |||
* [[Spezial:FilePath/A2_Atombdg_Hefteintrag1.pdf| Einheit 1]] | |||
* [[Spezial:FilePath/A2_Atombdg_Hefteintrag2.pdf| Einheit 2]] | |||
Hier findet ihr noch ein Übungsblatt mit vielen Molekülen, zu denen ihr die Valenzstrichformeln aufstellen könnt. '''Meine Empfehlung:''' Macht ab heute jeden Tag als Hausaufgabe drei von der linken und zwei von der rechten Seite. Übung macht den Meister! | |||
* [[Spezial:FilePath/A3_ÜAufg_Valenzstrich_AA.pdf| Übungsaufgaben]] | |||
* [[Spezial:FilePath/A3_ÜAufg_Valenzstrich_ML.pdf| Lösungen]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DCF | ||
|Hintergrund= # | |Hintergrund= #DCF | ||
}} | }} | ||
== Arbeitsauftrag Chemie2 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie2 (verpflichtend) '''</span> | |||
|Inhalt= | |||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein yt-Video zu schauen. Und Ruhe. Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!</span><br> | |||
<br> | |||
'''Die Atombindung (auch: kovalente Bindung)'''<br> | |||
Das folgende yt-Video bietet einen sehr guten Einstieg in die Thematik. Tatsächlich würde ich im Unterricht nahezu genau das gleiche sagen. Zu Beginn des Videos wird auf andere Videos verwiesen, die vorausgesetzt werden. Diese Videos braucht ihr nicht zu schauen. Wir haben das bereits im Unterricht besprochen. <br> | |||
Zum Einstieg vielleicht eine kleine Wiederholung (ca. 5 Min.): | |||
* Notiere, was "Valenzelektronen" sind! | |||
{{Lösung versteckt| | |||
Das sind die Elektronen, die sich bei Atomen eines bestimmten Elements auf der äußersten Schale befinden. | |||
|Lösung 1|Lösung ausblenden}} | |||
* Bestimme die Anzahl der Valenzelektronen (VE) der Atome folgender Elemente mit Hilfe des PSE: Calcium, Lithium, Iod! | |||
{{Lösung versteckt| | |||
Ca: 2 VE, Li: 1 VE, I: 7 VE | |||
|Lösung 2|Lösung ausblenden}} | |||
* Erkläre, wie Du diese Anzahl bestimmt hast! | |||
{{Lösung versteckt| | |||
Die Anzahl der VE entspricht der Hauptgruppen-Nr. im PSE. | |||
|Lösung 3|Lösung ausblenden}} | |||
* Bestimme die chemische Formel des Salzes '''Berylliumbromid'''! | |||
{{Lösung versteckt| | |||
Beryllium besitzt 2 VE. Um Edelgaskonfiguration zu erreichen, muss es diese beiden abgeben. Es entstehen Be<sup>2+</sup>-Ionen. Brom besitzt 7 VE. Um Edelgaskonfiguration zu erreichen muss es ein Elektron aufnehmen. Es entstehen Br<sup>-</sup>-Ionen. Damit ein neutrales (nicht geladenes) Salz entsteht und keine Elektronen verloren gehen oder übrig bleiben, müssen immer zwei Bromid-Atome mit einem Beryllium-Atom reagieren. Die Formel des entstehenden Salzes lautet dann BeBr<sub>2</sub> | |||
|Lösung 4|Lösung ausblenden}} | |||
Das genügt als Wiederholung. Jetzt zum yt-Video (10:06 min.): [https://www.youtube.com/watch?v=PsR-HRiGAzA Hier klicken] | |||
<br><br> | |||
'''Testet, ob ihr die Inhalte des Videos wiedergeben könnt:''' <br> | |||
<br> | <br> | ||
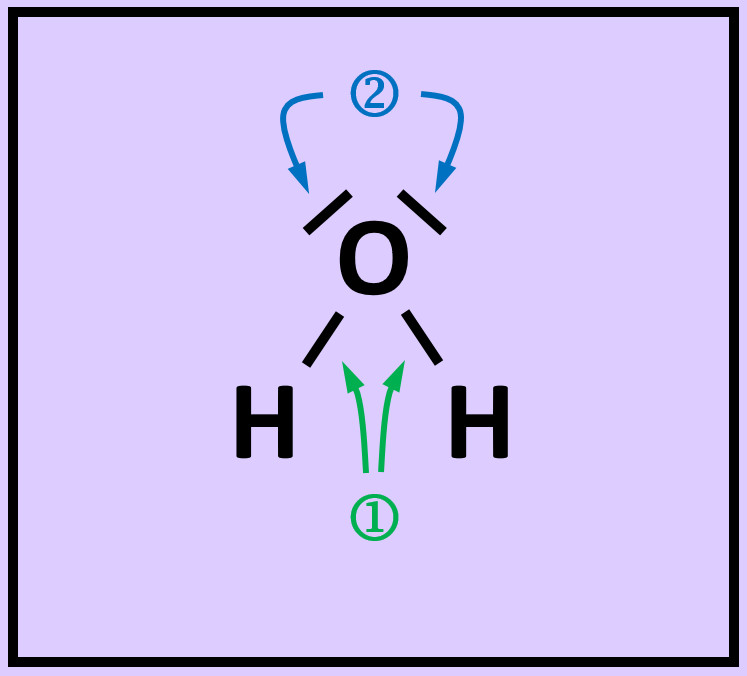
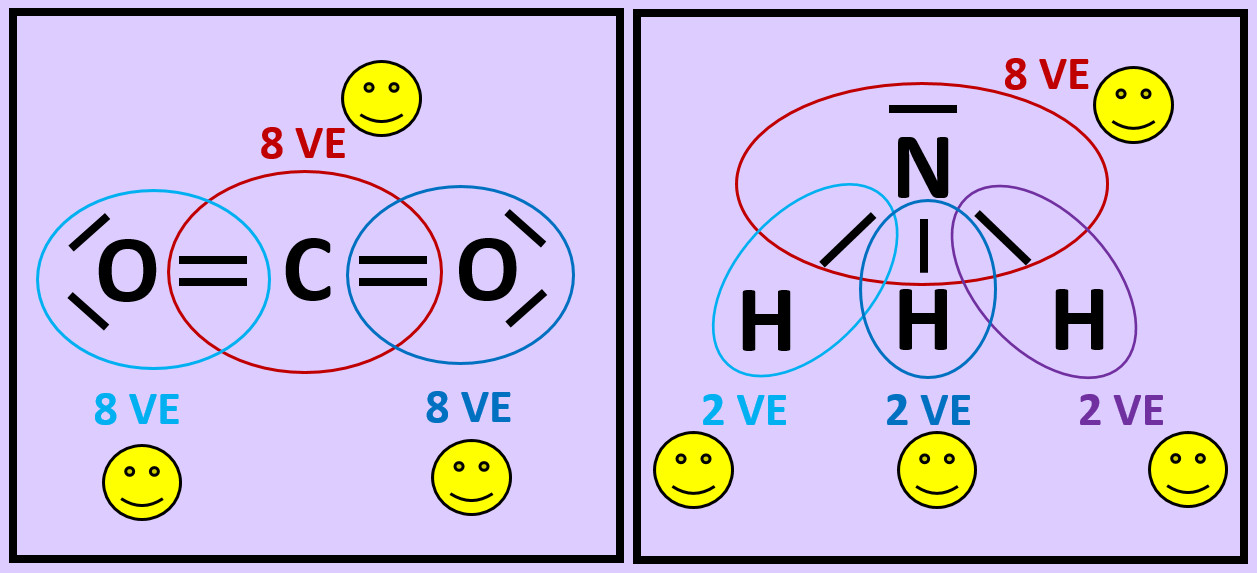
* Das folgende Bild zeigt die Valenzstrichformel des Wassermoleküls. Was bedeuten die mit unterschiedlichen Ziffern markierten Striche? | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_F.jpg]] | |||
== Arbeitsauftrag | {{Lösung versteckt| | ||
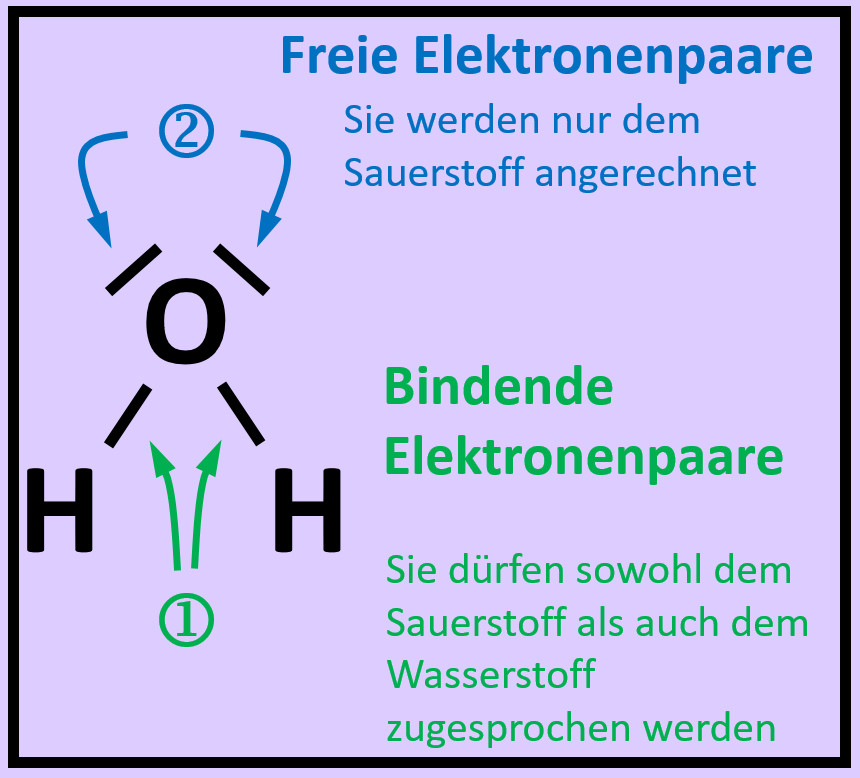
''- noch nicht | [[Datei:A2_Atombdg_ePaare_Unterschied_ML.jpg]]<br> | ||
Freie Elektronenpaare stammen nur von dem Atom, das sie umgeben. Bei den bindenden Elektronenpaaren stammt ein Elektron vom einen Partner (hier: Sauerstoff) und das andere Elektron vom anderen Partner (hier: Wasserstoff) | |||
|Lösung 5|Lösung ausblenden}} | |||
* Zeichnet das Wassermolekül ab. Kreist nun jedes Atom ein. Achtet dabei darauf, dass im Kreis alle Elektronen (freie Elektronenpaare und bindende Elektronenpaare) enthalten sind, die dem Atom zugerechnet werden können! | |||
* Zählt nun die Elektronen, die ihr jedem Atom zugeordnet habt! | |||
* Entscheidet, ob durch diese Anordnung Edelgaskonfiguration erreicht wurde! | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_ML2.jpg]]<br> | |||
|Lösung 6|Lösung ausblenden}} | |||
* Warum kann man beim Wasserstoff von Edelgaskonfiguration sprechen, obwohl ihm nur zwei Elektronen zugesprochen werden? | |||
{{Lösung versteckt| | |||
Die beiden Elektronen sitzen auf der innersten Schale, der K-Schale. Damit ist diese voll besetzt. Dies entspricht der Konfiguration von Helium und damit einem Edelgas. | |||
|Lösung 7|Lösung ausblenden}} | |||
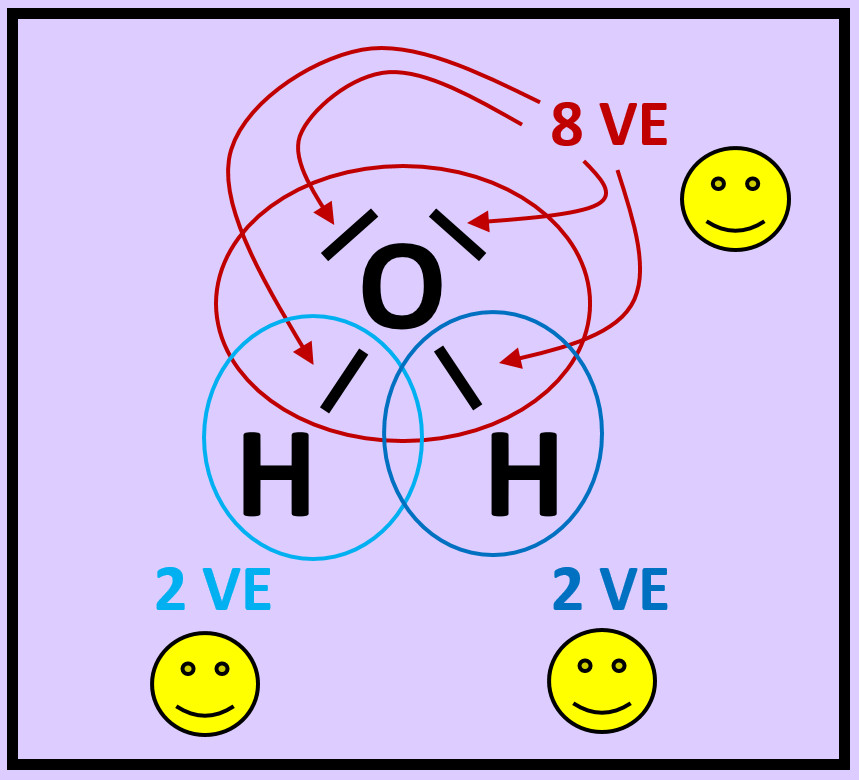
* Wiederholt die vorangegangenen Schritte (Einkreisen der Atome; Zählen der Elektronen; Entscheiden, ob Edelgaskonfiguration vorliegt) für die Moleküle '''"Kohlenstoffdioxid" (CO<sub>2</sub>)''' und '''"Ammoniak" (NH<sub>3</sub>)''' <br> | |||
[[Datei:A2_Atombdg_Co2_NH3_A.jpg]] | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_Co2_NH3_ML.jpg]]<br> | |||
|Lösung 8|Lösung ausblenden}} | |||
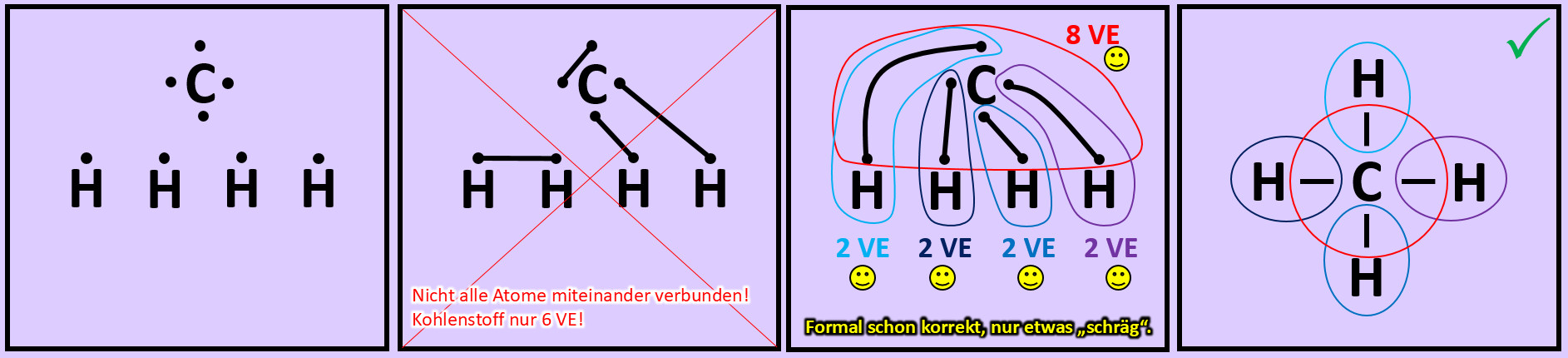
Versucht nun mit Hilfe der Valenzstrichformel selbst ein Molekül zu zeichnen, das ihr noch nicht im Video gesehen habt: '''"Methan" (CH<sub>4</sub>)'''. Geht wie folgt vor: | |||
* Zeichnet die Elementsymbole aller fünf Atome auf das Papier. Tipp: Wählt eine möglichst symmetrische Anordnung. | |||
* Zeichnet nun um jeden Atom die richtige Anzahl an Valenzelektronen. | |||
* Versucht nun die Punkte so zu verbinden, dass alle Atome miteinander zusammenhängen und gleichzeitig Edelgaskonfiguration erreicht wird. | |||
* Hinweis: Wenn man die zwei Valenzelektronen von zwei Wasserstoffen miteinander verbindet, dann besitzen zwar diese beiden Edelgaskonfiguration können aber keine weitere Bindung mehr eingehen. Sie können dann mit den restlichen Atomen nicht mehr verknüpft werden. Man muss also nach einer anderen Lösung suchen... | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_CH4_ML.jpg]]<br> | |||
|Lösung 9|Lösung ausblenden}} | |||
In eurem Buch ist auf der Seite 113 ist ein Verfahren beschrieben, mit dem man die Valenzstrichformeln "berechnen" kann. Ihr dürft das in Zukunft gerne so durchführen. Wenn man etwas übt, dann klappt es aber nach einiger Zeit auch ohne dieses Verfahren. Lest dieses Verfahren jetzt noch nicht, sondern erst als Hausaufgabe. | |||
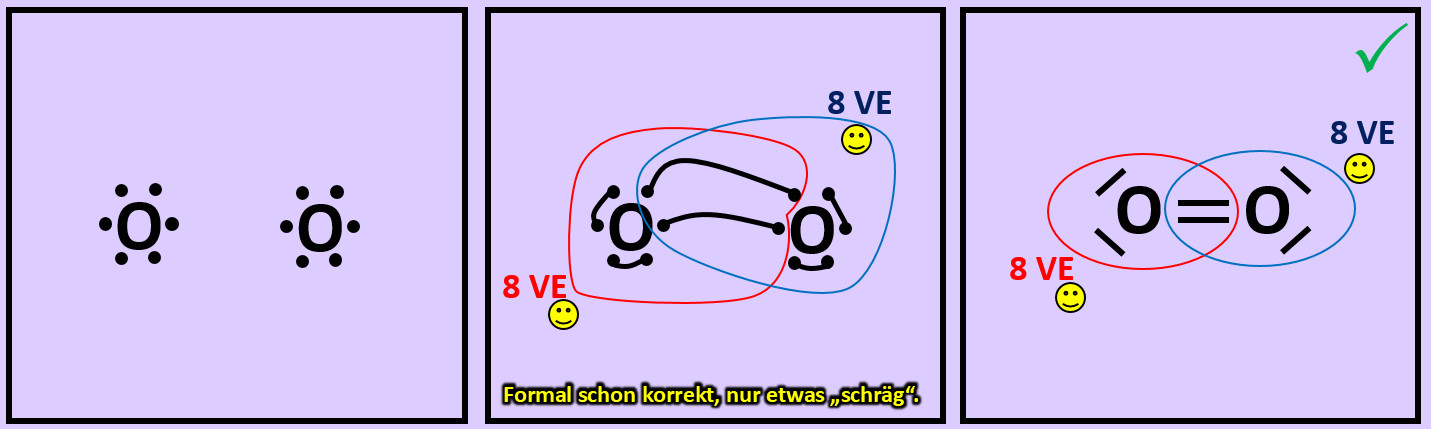
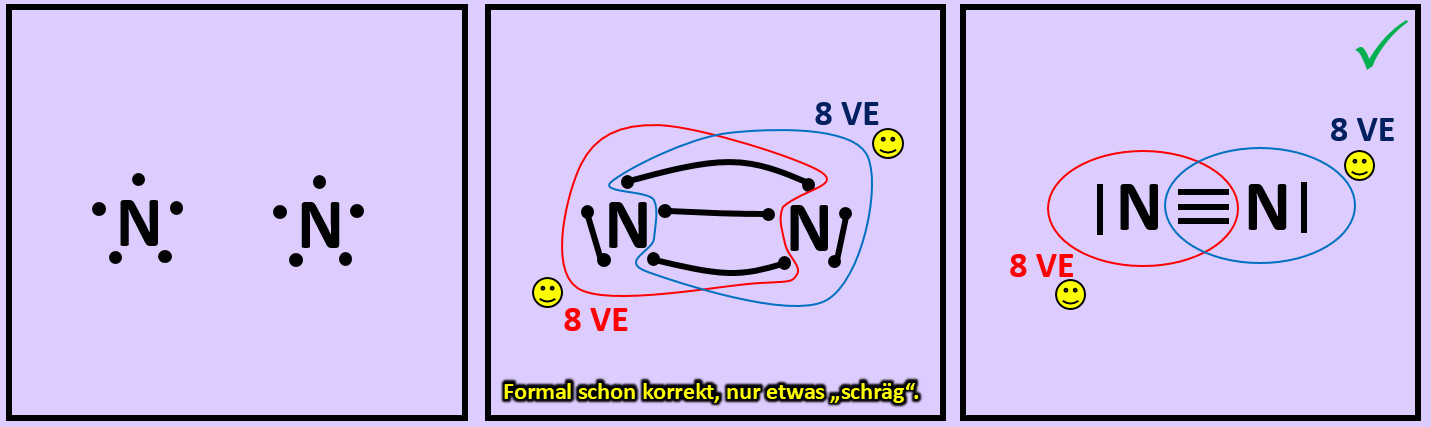
* Versucht erst noch zwei weitere Moleküle mit Hilfe der Valenzstrichformeln darzustellen: '''"Sauerstoff" (O<sub>2</sub>)''' und '''"Stickstoff" (N<sub>2</sub>)''' | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_O2_ML.jpg]]<br> | |||
[[Datei:A2_Atombdg_N2_ML.jpg]]<br> | |||
|Lösung 10|Lösung ausblenden}} | |||
* Beim Sauerstoffmolekül sind an der Bindung zwischen den beiden Atomen zwei Elektronenpaare, beim Stickstoffmolekül drei beteiligt. Diese Formen von Bindungen haben eigene Namen. Wie nennt man diese Bindungen? | |||
{{Lösung versteckt| | |||
Beim Sauerstoffmolekül: Doppelbindung, beim Stickstoffmolekül: Dreifachbindung. | |||
|Lösung 11|Lösung ausblenden}} | |||
<span style="color:#607">'''Hausaufgabe''': Lest im Buch folgende Abschnitte: S. 107 "Das Konzept der Elektronenpaarbindung", S. 108 komplett, S. 109 "Die Molekülformel". (Hinweis: Der Begriff "stöchiometrische Wertigkeit" spielt im meinen Unterricht keine große Rolle.) '''Bearbeitet die Aufgaben 1 + 3 auf S. 107''' und stellt die Valenzstrichformel für Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) auf (schwierig).<br></span> | |||
<span style="color:#607">'''Bitte macht die Hausaufgabe nicht jetzt sofort, sondern am besten erst morgen. Die Lösung wird am Mittwoch eingestellt.''' </span> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Arbeitsauftrag Chemie1 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie1 '''</span> | |||
|Inhalt= | |||
Züchtet einen Salzkristall: | |||
* Dokumentiert jeden der folgenden Schritte mit einem Foto, damit ihr daraus später eine schöne Anleitung am PC erstellen könnt! | |||
* Füllt ein Glas mit heißem Wasser. Ihr braucht es nicht extra erhitzen, nehmt einfach das heißeste Wasser, was ihr aus eurer Leitung bekommen könnt. | |||
* Gebt löffelweise '''Spülmaschinen-Salz''' dazu und rührt um. Minutenlang! (Wenn ihr kein Spülmaschinen-Salz habt, geht auch normales Speisesalz) | |||
* Irgendwann wird sich das Salz im Glas nicht mehr auflösen. Lasst den Ansatz dann noch 5 Minuten stehen. | |||
* Filtriert das Salzwasser durch einen Kaffee-Filter und fangt das Wasser in einem zweiten Glas auf | |||
* Schüttet etwas von dem Filtrat in eine Untertasse (am besten eine, die nicht weiß ist) und stellt es an einen sonnigen Platz auf das Fensterbrett, wo der Ansatz bis Montag stehen bleiben kann ohne dass er stört. Er sollte nicht bewegt werden. | |||
* Macht alle 24 Stunden ein Foto. | |||
* Am Montag, 23.03. geht es weiter | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Lösung versteckt| | |||
<gallery mode="packed"> | |||
SalzkristallZüchten_V1_LsgiGlas.jpg|Gesättigte Salzlösung | |||
SalzkristallZüchten_V1_LsgiUTasse.jpg|Klare Salzlösung in Untertasse | |||
SalzkristallZüchten_V1_LsgiUTasse2.jpg|nach 12 Stunden | |||
SalzkristallZüchten_V1_LsgiUTasse3.jpg|nach 24 Stunden | |||
SalzkristallZüchten_V1_LsgiUTasse4.jpg|nach 36 Stunden | |||
</gallery> | |||
|Lösung Chemie1|Lösung ausblenden}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie1b (freiwillig)'''</span> | |||
|Inhalt= | |||
Sofern ihr Arbeitsauftrag Chemie1 durchgeführt habt, könnt ihr nun folgende Überlegungen anstellen: | |||
* Gibt es in eurem Haushalt noch andere "reine Salze" mit denen ihr diesen Versuch durchführen könnte. Wenn ja: Probiert es aus! | |||
* Wenn man das Wasser vollständig verdunsten lässt, entstehen ganz zum Schluss viele kleine Kristalle, die wie ein Schleier alles überziehen. | |||
** Wenn man das nicht möchte, kann man vorher (z.B. nach 12 Stunden) einen kleinen, sauberen Kristall aus der Lösung holen und in ein neues Gefäß mit gesättigter Salzlösung überführen. Man kann ihn auch an einem Faden in ein Glas mit der Salzlösung hängen. Im Internet gibt es dazu reichlich Anleitungen. Wenn man Glück hat, wächst nur der kleine Kristall zu einem großen heran. Versucht das! | |||
** Man kann aus Draht z.B. einen Stern formen und diesen in ein Glas mit der Salzlösung hängen. Oder auch wieder in eine Untertasse mit der Salzlösung legen. Lässt man das Wasser komplett verdunsten, ist der Draht dann überall mit kleinen Kristallen überzogen. Manche finden das schön. | |||
* Führt den Versuch erneut durch. Stellt das Gefäß, in dem die Kristalle wachsen sollen, an einen ungestörten Ort. Baut eine Halterung, in der ihr euer Handy / euren Fotoapparat zum Anfertigen des Fotos kurz einspannen könnt, so dass jedes Foto vom Versuch aus exakt der selben Perspektive gemacht wird. Macht alle 8 Stunden (besser alle 4 oder 2 - was nachts aber schwierig ist...) ein Foto. Aus diesen Fotos kann man später eine Zeitrafferaufnahme machen. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
Aktuelle Version vom 24. Mai 2020, 07:17 Uhr
Arbeitsauftrag Chemie14 (hoffentlich letzter)
Arbeitsauftrag Chemie13
Arbeitsauftrag Chemie12
Arbeitsauftrag Chemie11
Arbeitsauftrag Chemie10
Arbeitsauftrag Chemie9
Arbeitsauftrag Chemie8
Arbeitsauftrag Chemie7
Arbeitsauftrag Chemie6
Arbeitsauftrag Chemie5
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie4
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie3
Arbeitsauftrag Chemie2
Arbeitsauftrag Chemie1