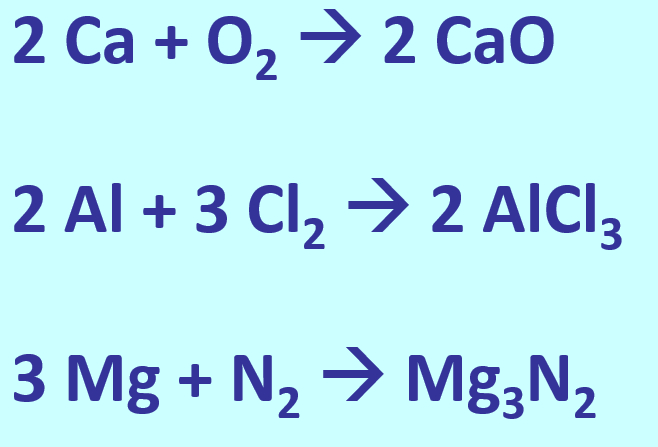Corona-Arbeitsaufträge (Chemie) LUX: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
(Bild-Links einfgefügt) Markierung: 2017-Quelltext-Bearbeitung |
||
| (4 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 10: | Zeile 10: | ||
}} | }} | ||
<br> | <br> | ||
== Arbeitsauftrag Chemie14 (hoffentlich letzter) == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung: Salze und Moleküle'''</span> | |||
|Inhalt= | |||
Ich hoffe, dass wir uns nach den Pfingstferien endlich wieder im Klassenzimmer sehen können. Ich gehe daher davon aus, dass dies die letzte Online-Einheit sein wird. In der vorangegangenen wurden noch einem Metalle wiederholt, heute sind Abschlussaufgaben zum Thema Salze und Moleküle dran. Ihr braucht zur Bearbeitung der Aufgaben euer Buch, um die Aufgaben zu lesen. Bei zwei Aufgaben müsst ihr auch noch eine weitere Textpassage lesen.<br> | |||
Teilt euch die Aufgaben auf! Empfehlung: Heute drei Aufgaben zum Bereich Salze und vier zum Bereich Moleküle, am Mittwoch die restlichen.<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Aufgaben zum Thema Salze'''</span> | |||
|Inhalt= | |||
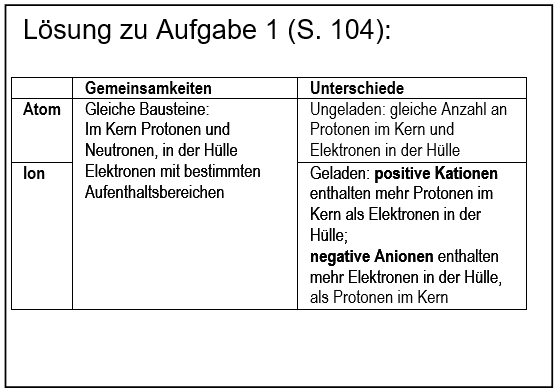
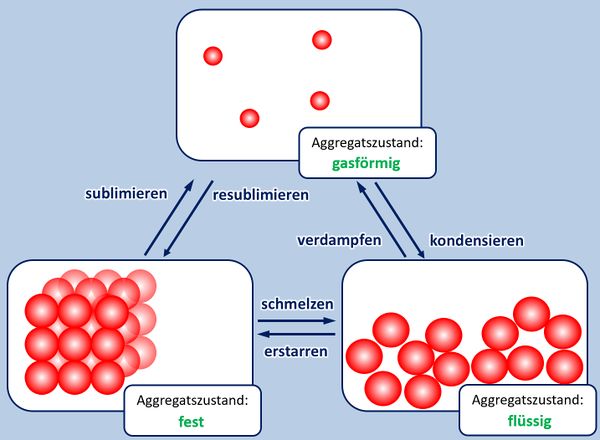
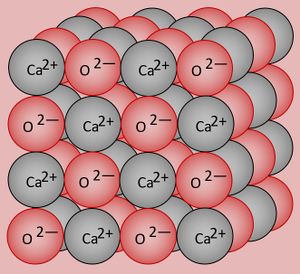
* Salze: S. 104, Aufgabe 1 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A1.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
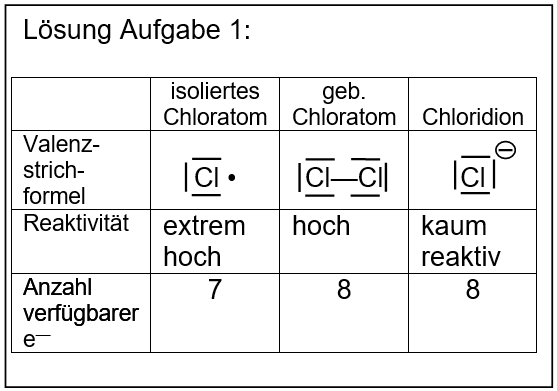
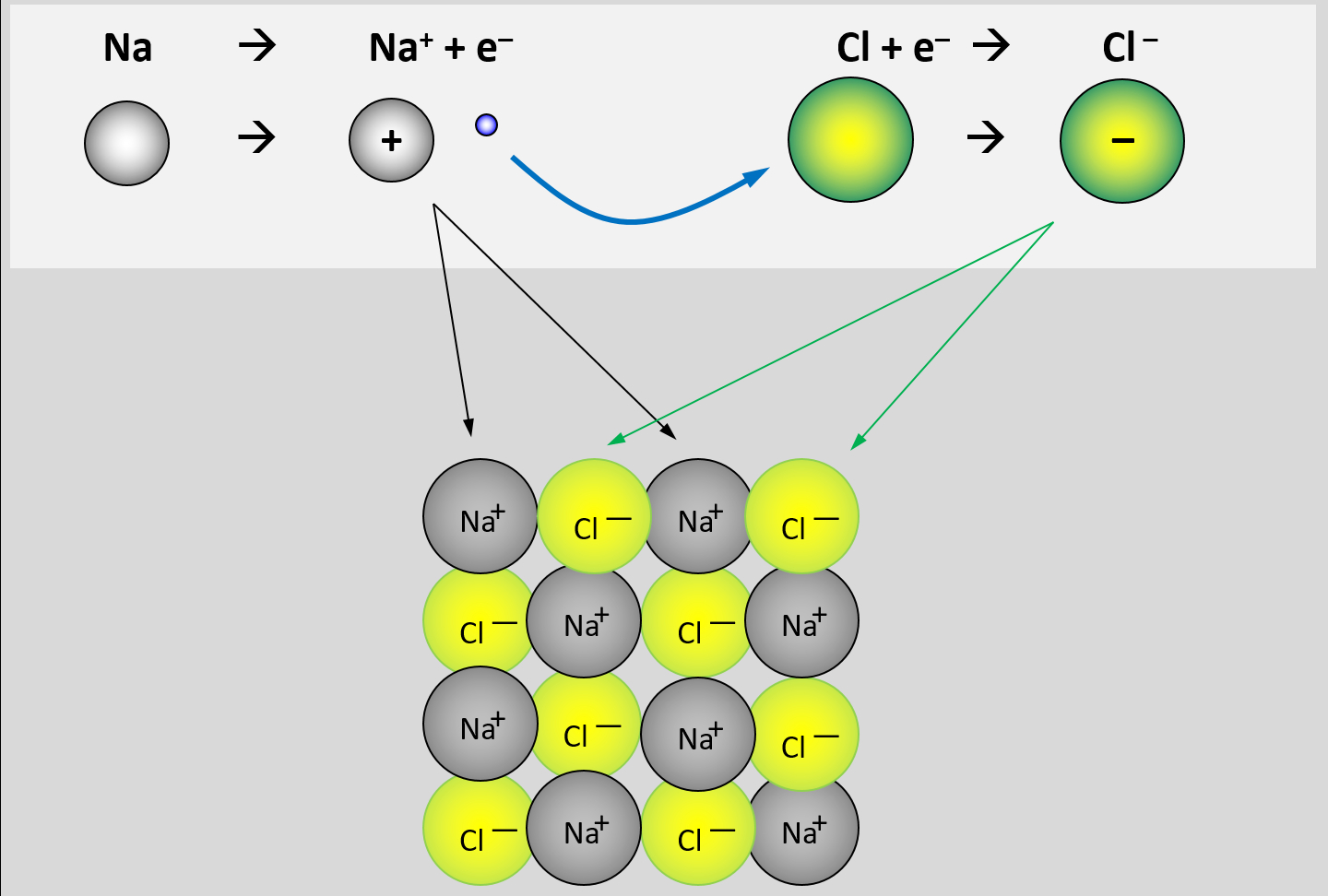
* Salze: S. 104, Aufgabe 4 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A4.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 104, Aufgabe 6 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A6.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
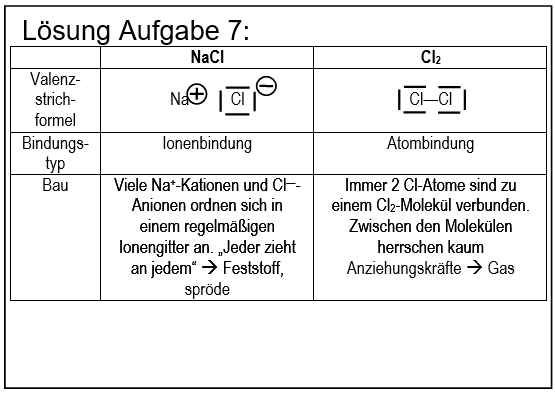
* Salze: S. 104, Aufgabe 7 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A7.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
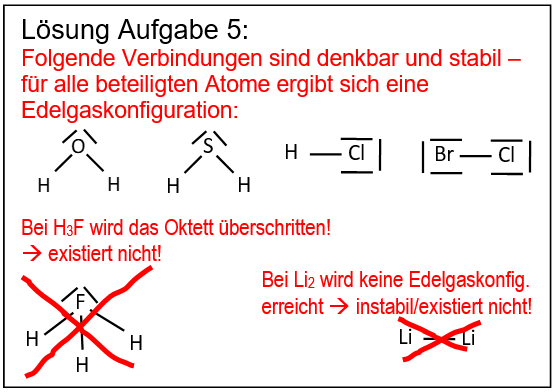
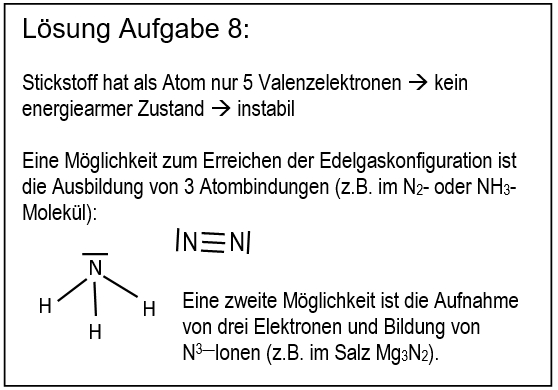
* Salze: S. 104, Aufgabe 10 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A10.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
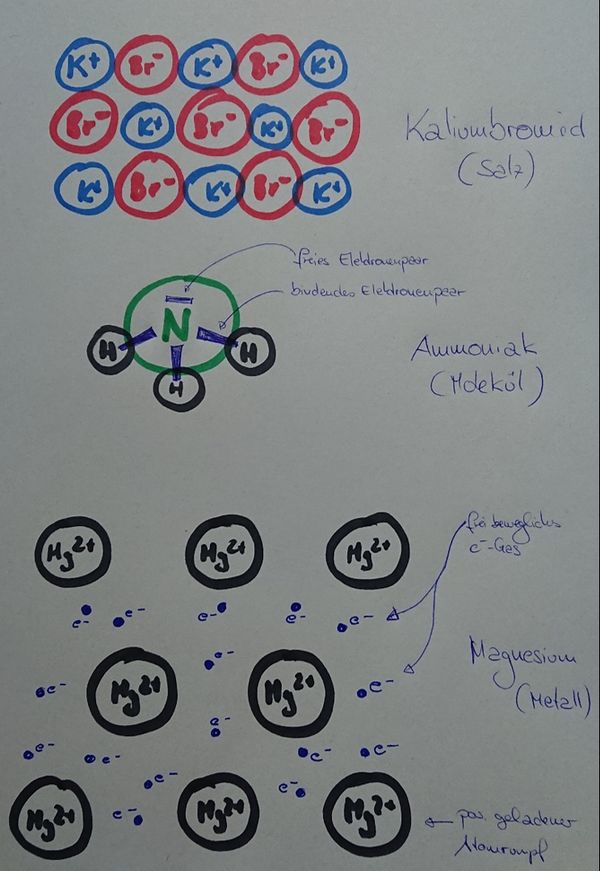
* Salze: S. 104, Aufgabe 11 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A11.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 104, Aufgabe 15 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_104_A15.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Aufgaben zum Thema Moleküle'''</span> | |||
|Inhalt= | |||
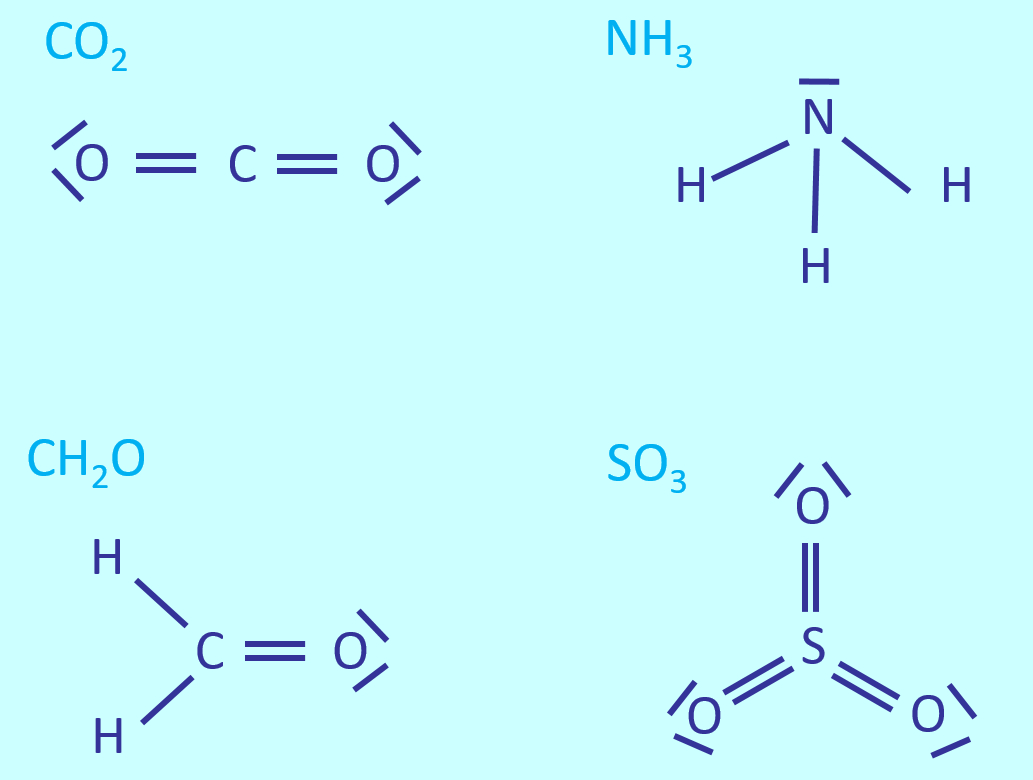
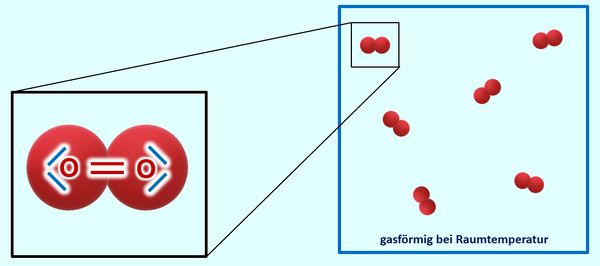
* Salze: S. 122, Aufgabe 1 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A1.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
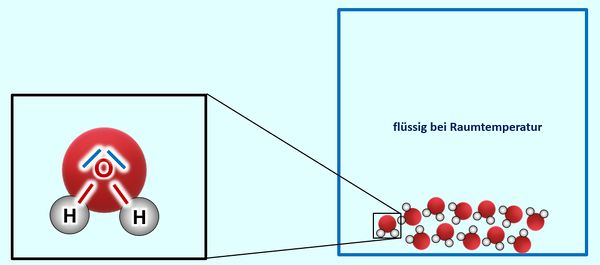
* Salze: S. 122, Aufgabe 3 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A3.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
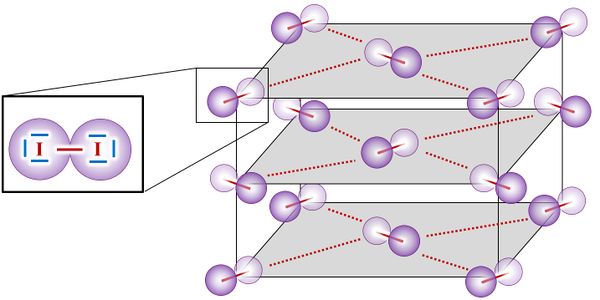
* Salze: S. 122, Aufgabe 5 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A5.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 6 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A6.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 7 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A7.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 8 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A8.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
* Salze: S. 122, Aufgabe 19 | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZF_Lsg_122_A19.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Arbeitsauftrag Chemie13 == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Nochmals Metalle'''</span> | |||
|Inhalt= | |||
Die wichtigsten Punkte, die ihr für die nächste Jahrgangsstufe in Chemie braucht, haben wir bereits angesprochen. Ein großes Kapitel fehlt zwar noch, aber das besprechen wird nach den Pfingstferien. Bis dahin werden wir die bisher behandelten Inhalte noch etwas wiederholen bzw. vertiefen.<br> | |||
Das folgenden Videos beschäftigt sich noch einmal mit Metallen. Es ist weniger theoretisch, sondern enthält ein paar schöne Versuche, die ich teilweise auch im Unterricht durchgeführt hätte. Ihr bekommt diese Woche keinen weiteren Arbeitsauftrag mehr. Am besten, ihr teilt euch das Material selbständig auf. Ich empfehle folgendes Vorgehen:<br> | |||
<br> | |||
'''Heute, Montag 18.05.''' (Bearbeitungszeit: ca. 25min.)<br> | |||
Schaut zunächst in der Mediathek des Bayerischen Rundfunks den 15 min. Film über die Eigenschaften von Metallen:[https://www.br.de/mediathek/video/chemie-metalle-werkstoffe-aus-boden-und-weltall-av:5e6be9a81c429f0013448556 zur Mediathek]<br> | |||
<br> | |||
Beantwortet im Anschluss folgende Fragen (am besten wirklich schriftlich in Stichpunkten): | |||
* Metalle kann man in der Natur oder im Alltag in elementarer Form finden oder in Form von Ionen gebunden in Mineralien. Nenne drei verschiedene Alltags-Gegenstände, die aus elementarem Metall bestehen. | |||
* Wiederhole die vier wichtigsten Eigenschaften von Metallen und zeige jeweils eine Anwendungsmöglichkeit von Metallen auf, bei der diese Eigenschaft ausgenutzt wird! | |||
* Beschreibe, was eine Legierung ist und nenne drei Beispiele! | |||
<br> | |||
{{Lösung versteckt| | |||
Hast Du wirklich eine Lösung für die drei Aufgaben schriftlich, stichpunktartig auf einem Blatt Papier stehen? | |||
{{Lösung versteckt| | |||
* z.B. Schmuckstücke aus Gold, Fahrradrahmen aus Aluminium/Stahl/Titan, Stromkabel aus Kupfer | |||
* '''Metallischer Glanz''': Schmuckstücke, '''gute Verformbarkeit''': Herstellen kompliziert geformter Bauteile (z.B. Fahrradrahmen, Auto-Karosserieteile) , '''gute elektrische Leitfähigkeit''': Verwendung als "Stromkabel", '''gute Wärmeleitfähigkeit''': im Film kam hier keine Anwendungsmöglichkeit gezeigt, aber z.B. ist in jedem Computer ein speziell geformtes metallisches Bauteil vorhanden, dass die enorme Hitze vom Prozessor wegleitet. Man spricht von "Kühlrippen". Googelt diesen Begriff! | |||
* Bei einer Legierung handelt es sich um eine "Mischung" von Metallen. Die Eigenschaften der Legierung unterscheiden sich von den Eigenschaften der Ausgangs-Metalle. Bsp.: Stahl (Eisen und Vandium und andere), Bronze (Kupfer und Zinn), Messing (Kupfer und Zink) | |||
|selbstverständlich|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Übermorgen, Mittwoch 20.05.''' (Bearbeitungszeit: ca. 25min.)<br> | |||
Schaut zunächst in der Mediathek des Bayerischen Rundfunks den 15 min. Film über den atomaren Bau von Metallen: | |||
[https://www.br.de/mediathek/video/chemie-metalle-metalle-das-geheimnis-ihres-atomaren-aufbaus-av:5e6fa570899b870013e1f566 zur Mediathek] | |||
<br> | |||
Beantwortet im Anschluss folgende Fragen (am besten wirklich schriftlich in Stichpunkten): | |||
* Was passiert auf Teilchenebene, wenn ein Metallstück auf einer Seite erhitzt wird? | |||
* Was passiert auf Teilchenebene, wenn ein Metallstück verformt wird? | |||
* Was ist der Unterschied zwischen einem Edelmetall und einem unedlen Metall? Nenne jeweils zwei Beispiele! | |||
<br> | |||
{{Lösung versteckt| | |||
Hast Du wirklich eine Lösung für die drei Aufgaben schriftlich, stichpunktartig auf einem Blatt Papier stehen? | |||
{{Lösung versteckt| | |||
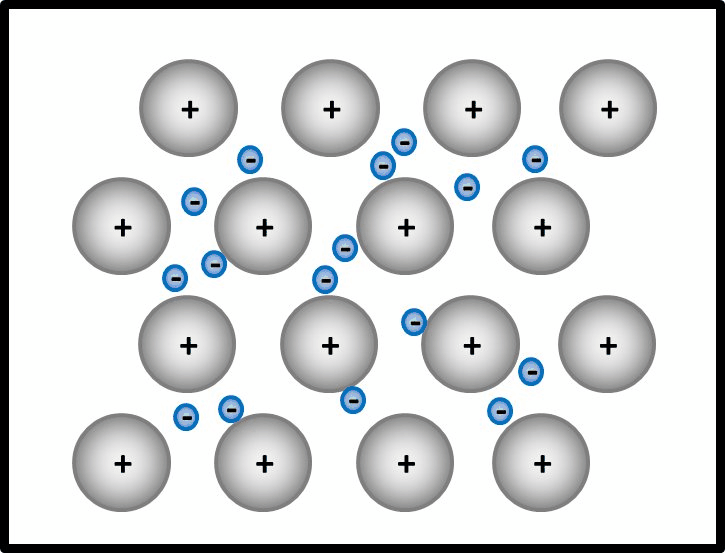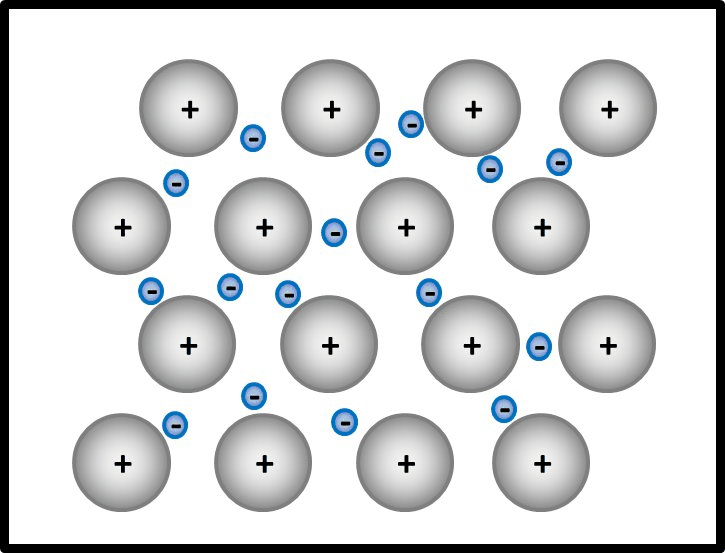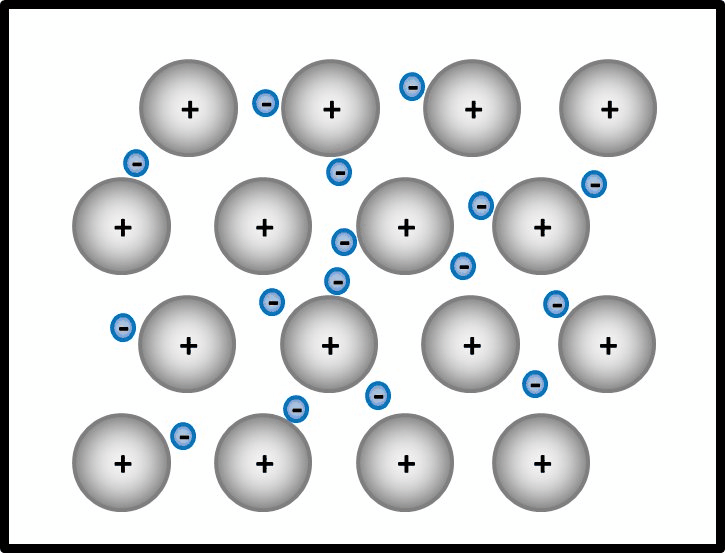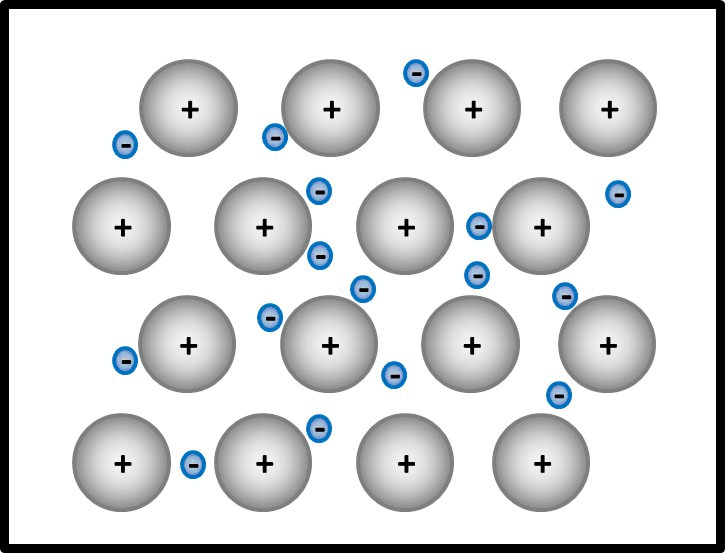
* Die Atomrümpfe und das Elektronengas beginnen an der erhitzten Stelle stärker zu schwingen. Diese Schwingungen können leicht an benachbarte Teilchen weitergegeben werden, weil kein Teilchen starr an einen bestimmten Platz gebunden ist. Daher leiten Metalle die Wärme sehr gut. | |||
* Die Atomrümpfe, die normalerweise in einer dichtesten Kugelpackung angeordnet sind, können durch das Einwirken einer Kraft verschoben werden und eine neue Position einnehmen, ohne dass das Metallstück dabei zerbricht. Das negativ geladene Elektronengas hält die positiven Atomrümpfe permanent zusammen. | |||
* Im Film wurde das nicht ganz so deutlich: Die Einteilung ist tatsächlich vom Reaktionsverhalten abhängig: Unedle Metalle reagieren mit Säuren, Edelmetalle nicht. Nicht immer lösen sich in unedle Metalle aber in Säuren auf, so wie es im Film am Beispiel von Magnesium gezeigt wurde. Typische Edelmetalle: Gold, Silber, Platin. Typische unedle Metalle: Magnesium, Aluminium. | |||
|selbstverständlich|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Arbeitsauftrag Chemie12 == | == Arbeitsauftrag Chemie12 == | ||
Aktuelle Version vom 24. Mai 2020, 07:17 Uhr
Arbeitsauftrag Chemie14 (hoffentlich letzter)
Arbeitsauftrag Chemie13
Arbeitsauftrag Chemie12
Arbeitsauftrag Chemie11
Arbeitsauftrag Chemie10
Arbeitsauftrag Chemie9
Arbeitsauftrag Chemie8
Arbeitsauftrag Chemie7
Arbeitsauftrag Chemie6
Arbeitsauftrag Chemie5
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie4
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie3
Arbeitsauftrag Chemie2
Arbeitsauftrag Chemie1