Corona-Arbeitsaufträge (Chemie) LUX: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
(AA8 umstrukturiert: versteckte Lösungen in Boxen integriert) Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 560: | Zeile 560: | ||
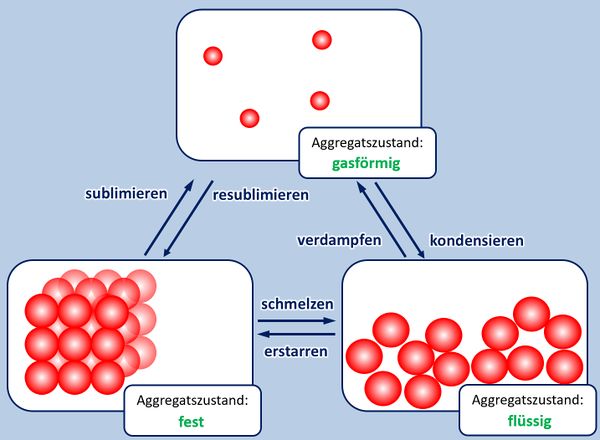
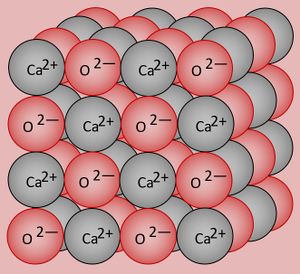
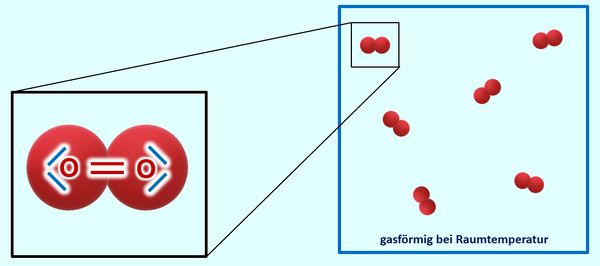
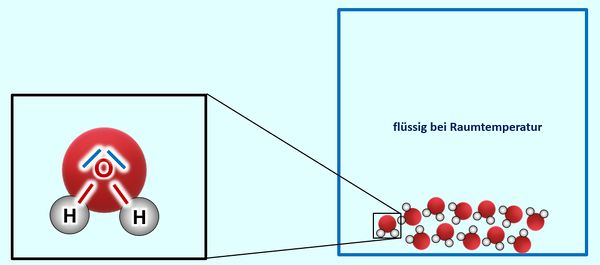
Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest die kleinen, wie z.B. O<sub>2</sub>, gasförmig) | Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest die kleinen, wie z.B. O<sub>2</sub>, gasförmig) | ||
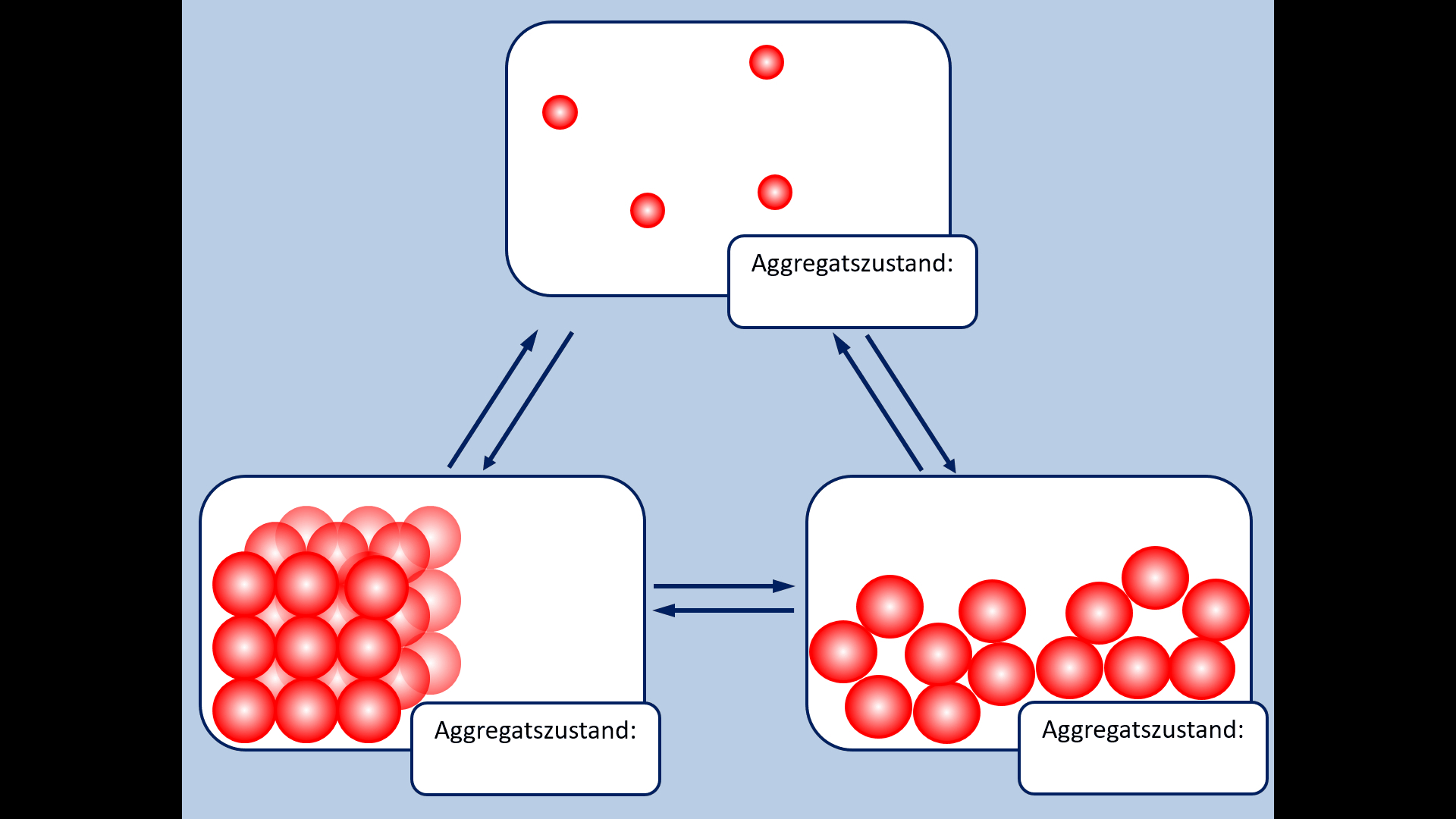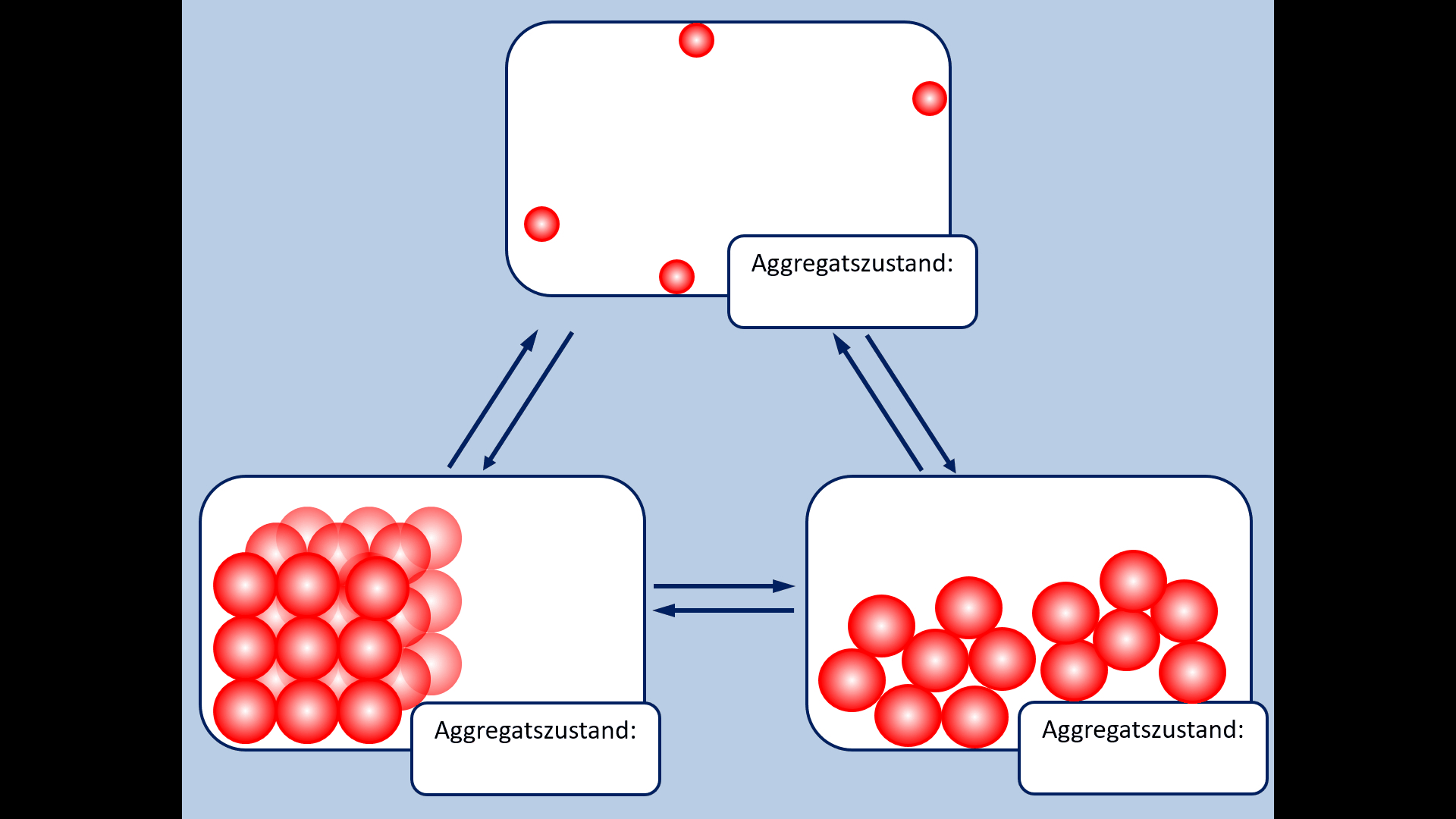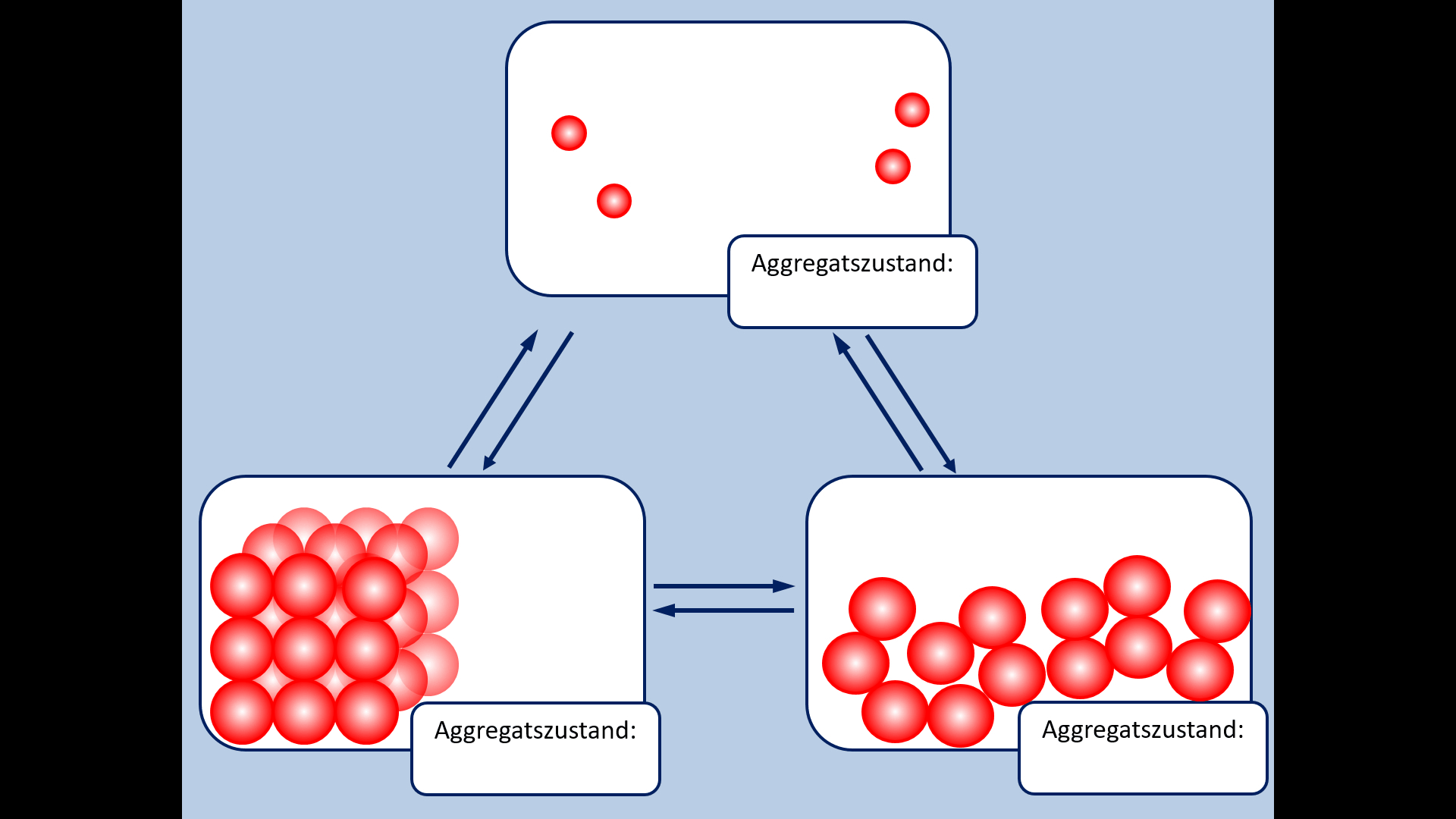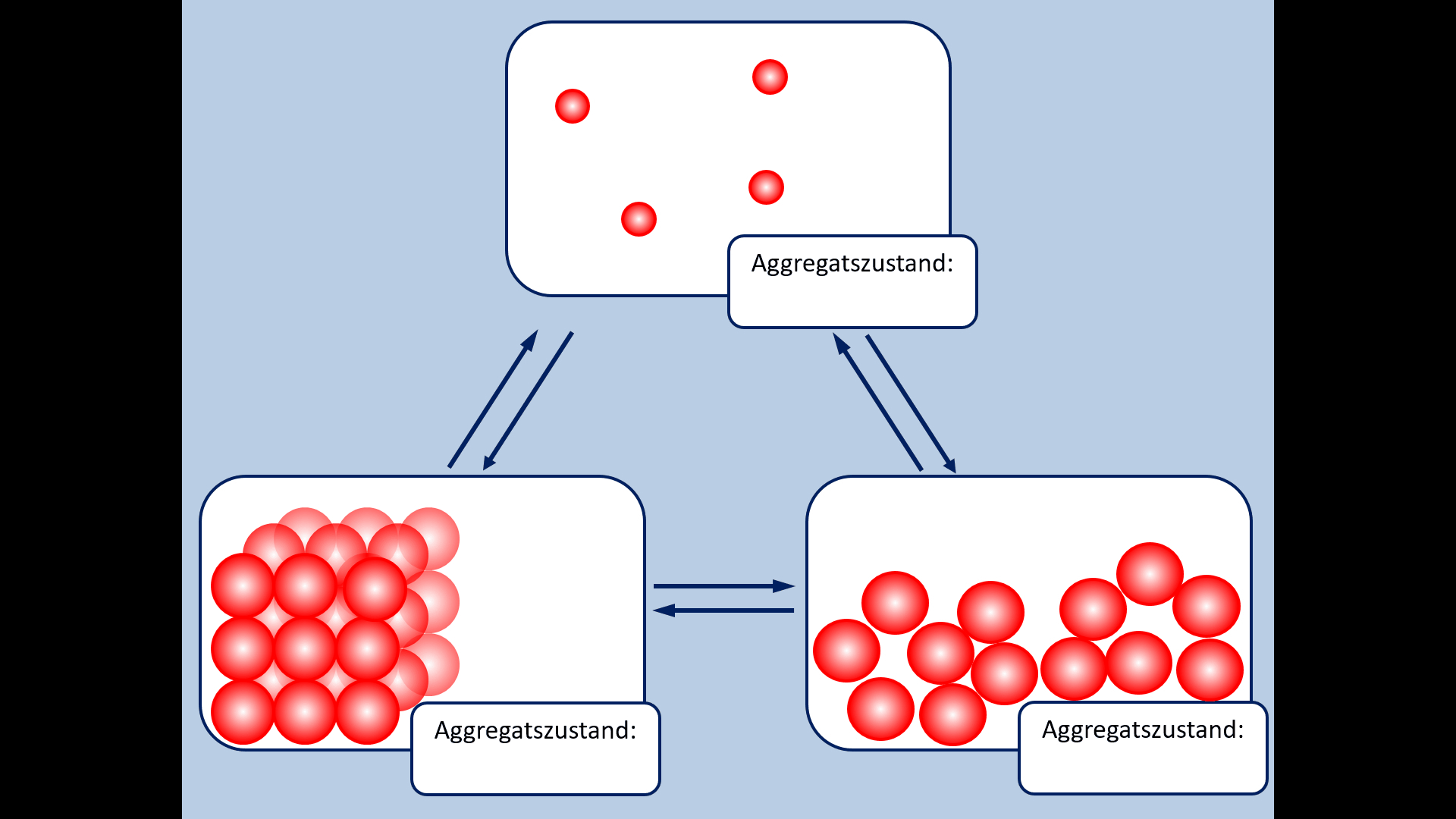
* Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | * Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:A5_Aggregatszustände_ML.jpg|600px]] | [[Datei:A5_Aggregatszustände_ML.jpg|600px]] | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 583: | Zeile 572: | ||
<br> | <br> | ||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
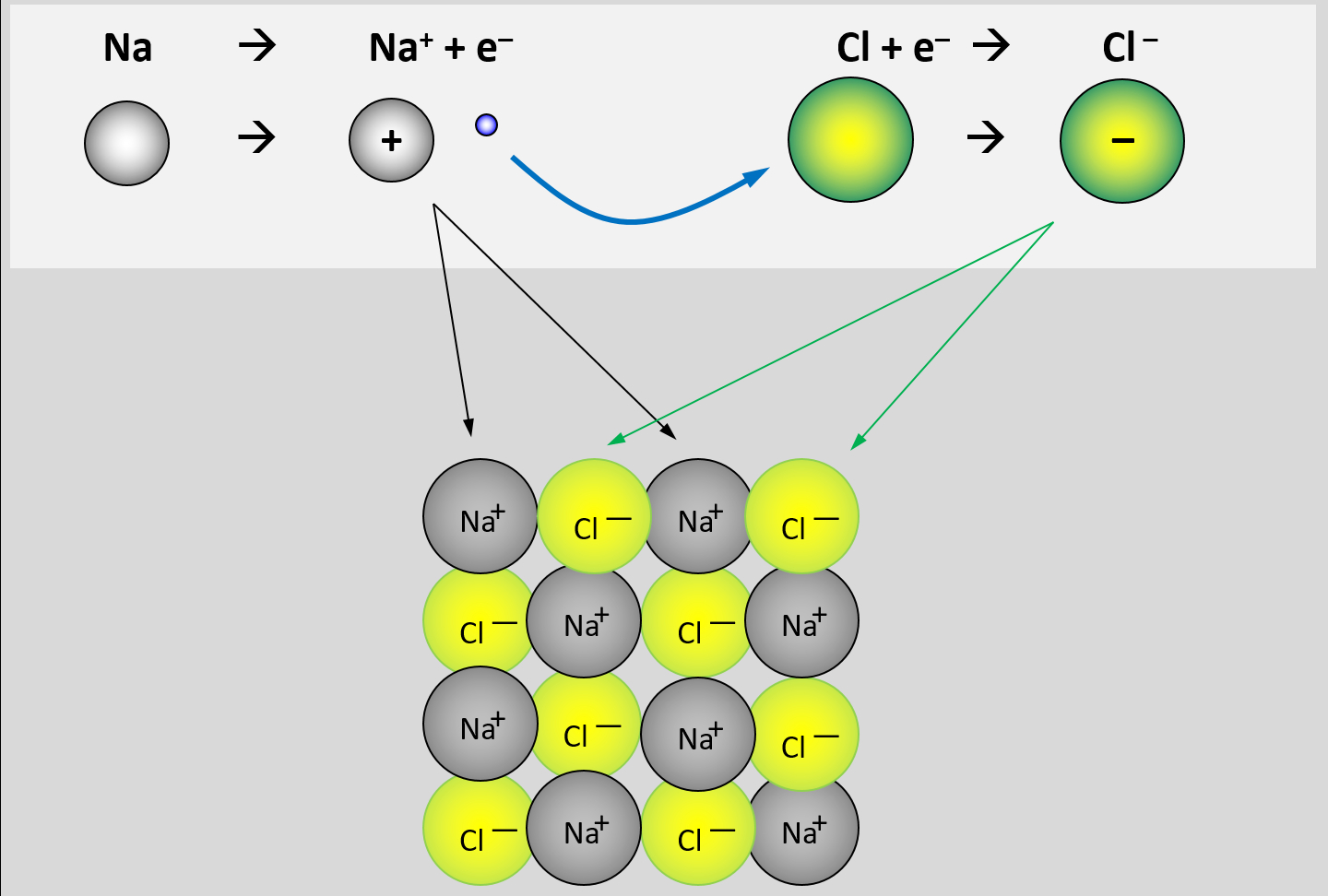
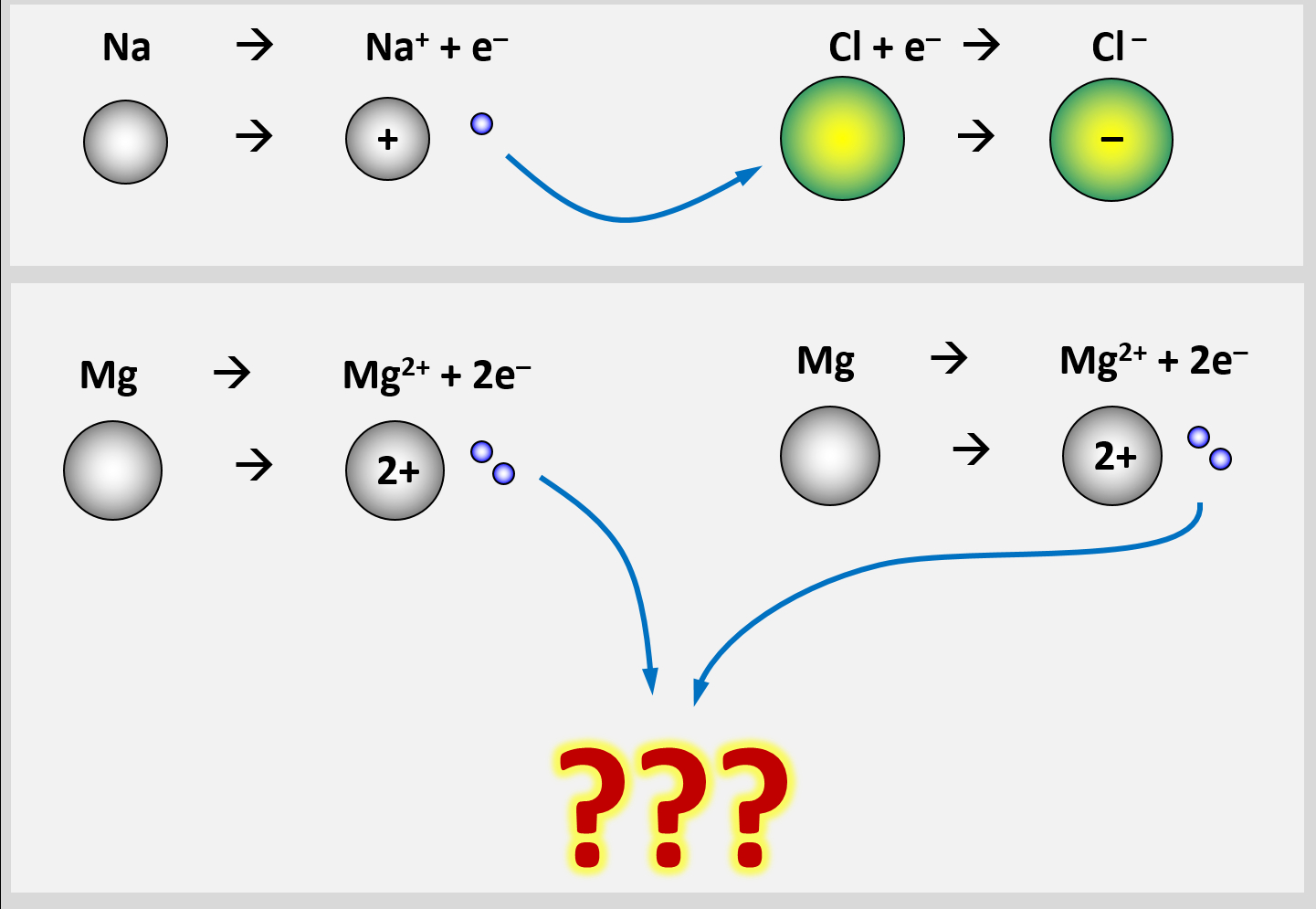
* Erkläre, warum Salze so hohe Schmelz- und Siedetemperaturen besitzen! Gehe bei Deiner Erklärung auch darauf ein, wie sich Salze aus den Elementen bilden. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Met1_IonenbildungBeiSalzen.jpg]] | [[Datei:Met1_IonenbildungBeiSalzen.jpg]] | ||
Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 601: | Zeile 588: | ||
<br> | <br> | ||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= | |||
Nachdem die meisten Metalle bei Raumtemperatur ebenfalls fest sind, könnte man zunächst ja vermuten, dass ein ähnlicher Grund wie bei den Salzen zur starken Anziehung der Metallteilchen untereinander führt.<br> | |||
Man stößt allerdings sehr schnell auf Probleme, wenn man versucht das Bindungs-Prinzip von Salzen auf ein Stück Metall zu übertragen. Versucht zu begründen, warum in einem Stück Magnesium-Metall die Bindung der Mg-Atome aneinander keinesfalls auf den gleichen Gründen beruhen kann, wie bei einem Salzkristall. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Met1_IonenbildungUnmöglich.jpg]] | [[Datei:Met1_IonenbildungUnmöglich.jpg]] | ||
| Zeile 606: | Zeile 598: | ||
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | <br> | ||
| Zeile 614: | Zeile 612: | ||
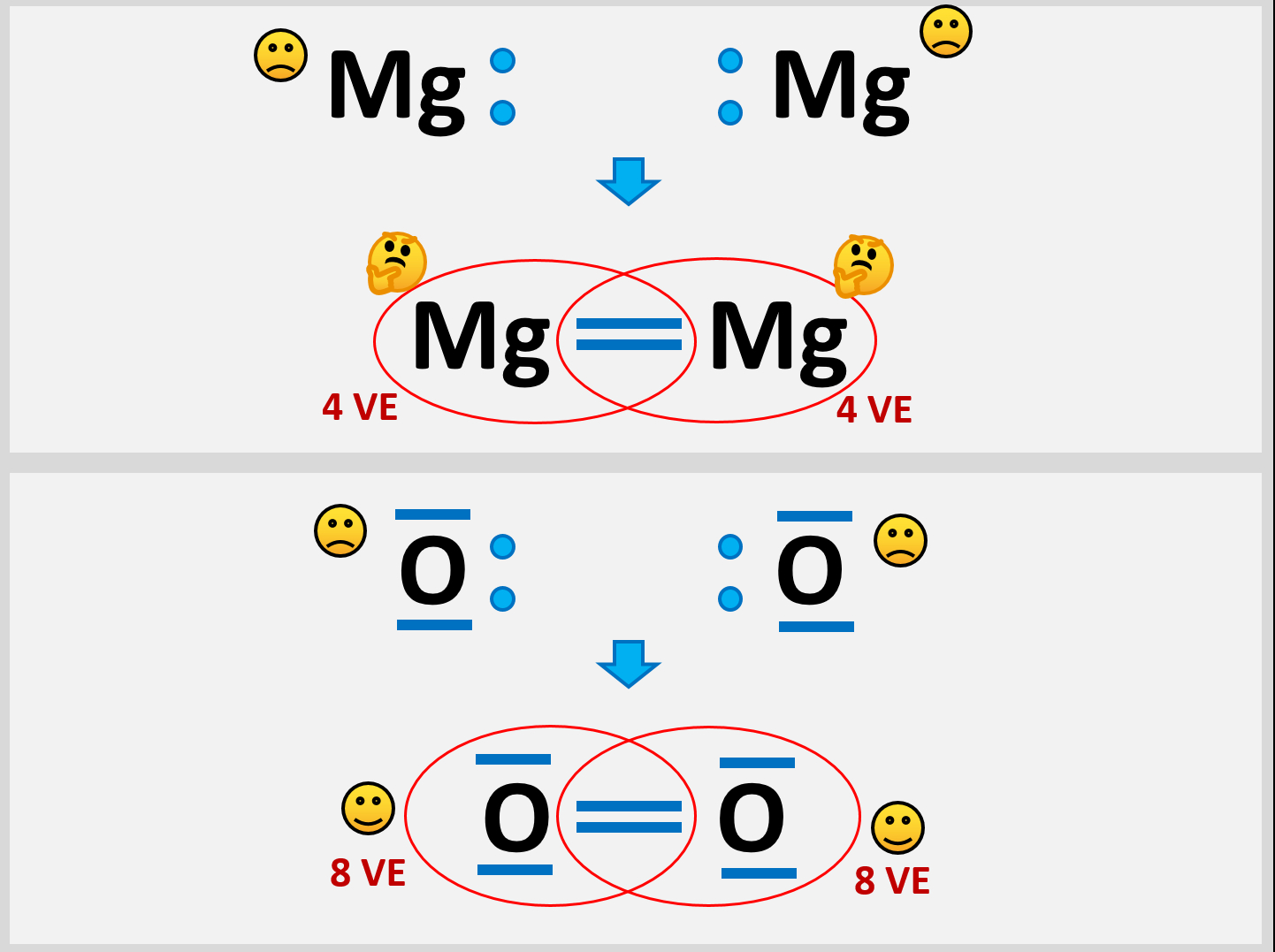
* Versuche aus zwei Mg-Atomen ein Molekül zu bilden und beschreibe genau, die Probleme, die dabei auftauchen! | * Versuche aus zwei Mg-Atomen ein Molekül zu bilden und beschreibe genau, die Probleme, die dabei auftauchen! | ||
* Vergleicht die Situation mit einem Sauerstoff-Molekül | * Vergleicht die Situation mit einem Sauerstoff-Molekül | ||
{{Lösung versteckt| | |||
[[Datei:Met1_AtombdgUnmöglich.jpg]] | |||
Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.<br> | |||
Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 621: | Zeile 625: | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 632: | Zeile 630: | ||
|Inhalt= | |Inhalt= | ||
Die Lösung ist eigentlich simpel. Wenn man sie kennt. Von alleine darauf zu kommen ist schwierig (glaube ich). Trotzdem zeige ich euch mal ein Szenario aus der "Lebenswelt" auf und ihr versucht das auf Metall-Atome zu übertragen: Stellt euch vor, ihr wollt alle mit einem Ball spielen. Aber nicht jeder von euch hat einen. Sagen wir mal, nur jeder zweite. Was kann man tun, damit alle "zufrieden" sind? | Die Lösung ist eigentlich simpel. Wenn man sie kennt. Von alleine darauf zu kommen ist schwierig (glaube ich). Trotzdem zeige ich euch mal ein Szenario aus der "Lebenswelt" auf und ihr versucht das auf Metall-Atome zu übertragen: Stellt euch vor, ihr wollt alle mit einem Ball spielen. Aber nicht jeder von euch hat einen. Sagen wir mal, nur jeder zweite. Was kann man tun, damit alle "zufrieden" sind? | ||
{{Lösung versteckt| | |||
Jeder sucht sich einen Partner, es bilden sich also Pärchen. Alle können so mit den zur Verfügung stehenden Bällen spielen. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 637: | Zeile 639: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
<br> | <br> | ||
| Zeile 649: | Zeile 646: | ||
Die oben genannte Situation könnte man mit der Situation bei Molekülen vergleichen, die ja aus Nichtmetallen aufgebaut sind: Bei Nichtmetall-Atomen sind viele Elektronen verfügbar (jedes Atom hat 6 VE). Die Elektronen entsprechen den Bällen. Wenn sich jedes Atom ein Elektron (auch zwei oder drei) Elektronen mit einem anderen Partner teilt, sind alle "zufrieden" (fachwissenschaftlich: Es entsteht ein energetisch günstiger Zustand). | Die oben genannte Situation könnte man mit der Situation bei Molekülen vergleichen, die ja aus Nichtmetallen aufgebaut sind: Bei Nichtmetall-Atomen sind viele Elektronen verfügbar (jedes Atom hat 6 VE). Die Elektronen entsprechen den Bällen. Wenn sich jedes Atom ein Elektron (auch zwei oder drei) Elektronen mit einem anderen Partner teilt, sind alle "zufrieden" (fachwissenschaftlich: Es entsteht ein energetisch günstiger Zustand). | ||
Bei Metallen funktioniert das nicht. Es sind einfach zu wenig Elektronen verfügbar. Wieder zurück zum Beispiel mit den Bällen: Alle (sagen wir z.B. mal 22 Schülerinnen und Schüler) wollen Ball spielen, aber es ist nur ein Ball da. Was kann man tun? | Bei Metallen funktioniert das nicht. Es sind einfach zu wenig Elektronen verfügbar. Wieder zurück zum Beispiel mit den Bällen: Alle (sagen wir z.B. mal 22 Schülerinnen und Schüler) wollen Ball spielen, aber es ist nur ein Ball da. Was kann man tun? | ||
{{Lösung versteckt| | |||
Man spielt Fußball! - Was hat das jetzt mit der Metall-Bindung zu tun? Ich gebe zu, das Beispiel ist jetzt nicht der Wahnsinn, aber soooo schlecht ist es auch nicht: Beim Fußball-Spielen teilen sich viele Menschen einen Ball. Weil alle spielen wollen, sorgt der Ball dafür, dass alle auf dem Spielfeld bleiben.<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 656: | Zeile 657: | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 667: | Zeile 664: | ||
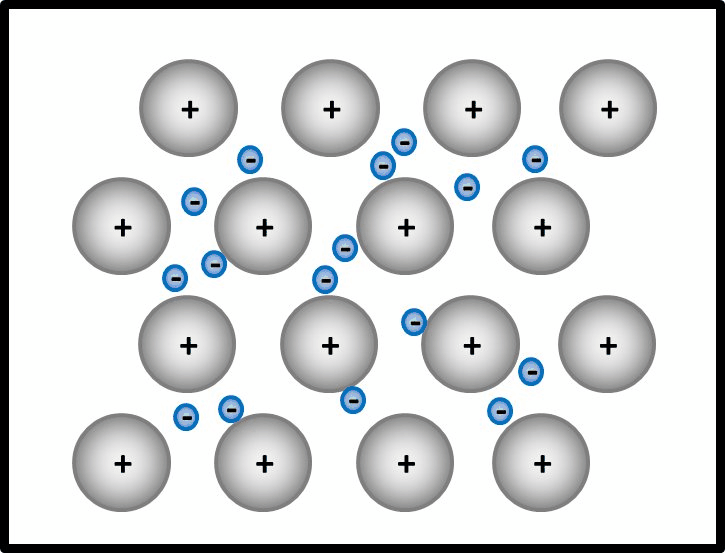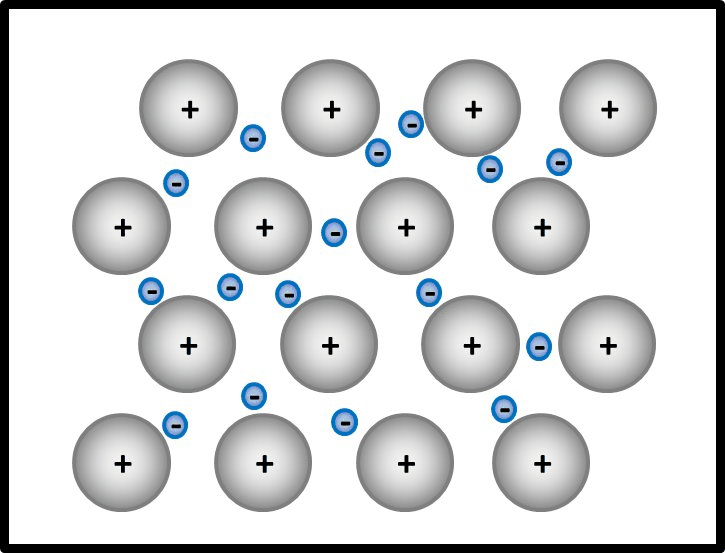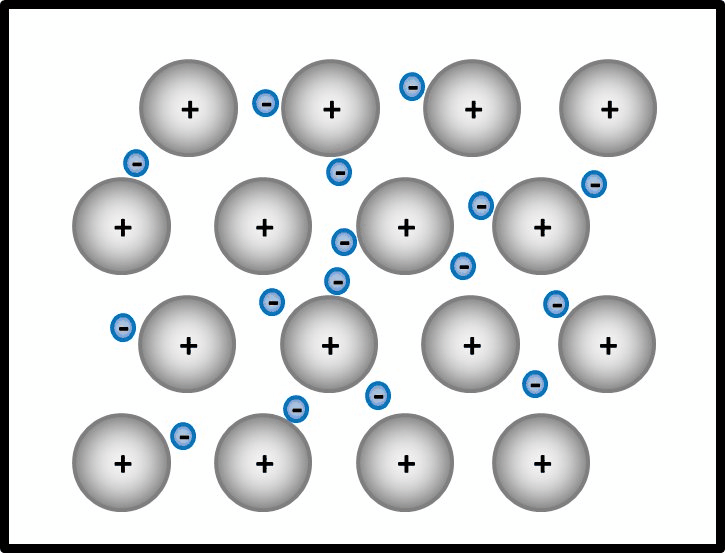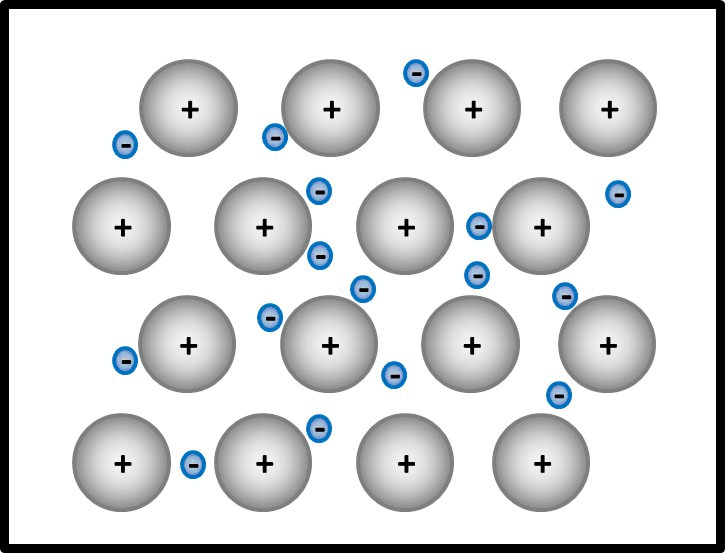
[[Datei:Metallgitter_animiert_1.gif]]<br> | [[Datei:Metallgitter_animiert_1.gif]]<br> | ||
Erklärt diese Vorstellung jetzt das Phänomen, warum Metalle in der Regel Feststoffe sind? | Erklärt diese Vorstellung jetzt das Phänomen, warum Metalle in der Regel Feststoffe sind? | ||
{{Lösung versteckt| | |||
Ja! Metalle bestehen nach dieser Vorstellung aus '''positiv geladenen''' Teilchen: Den '''Atomrümpfen''', die durch die Abgabe von Valenzelektronen entstanden sind. Und aus '''negativ geladenen''' Teilchen: Den frei beweglichen Elektronen, auch '''Elektronengas '''genannt. Es sind hier also viele Ladungen im Spiel, die zu sehr hohen Anziehungskräften führen, ganz ähnlich wie bei den Salzen | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 674: | Zeile 676: | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 707: | Zeile 705: | ||
==Arbeitsauftrag Chemie9== | ==Arbeitsauftrag Chemie9== | ||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
* Das einzige bei Raumtemperatur flüssige Metall ist Quecksilber (kann man aus dem PSE ablesen, wenn man die Schmelzpukte auf der Rückseite anschaut: -39°C) | |||
* Ein Metall, das in der Hand schmilzt: Gallium (Smp.: 30°C). Wer möchte, kann das folgende Video schauen, in dem ein Mann mit Gallium herumspielt (Achtung: Gallium ist giftig uns sollte nicht angefasst werden. Ich schätze aber, das man in Deutschland sowieso nicht so einfach an reines Gallium kommt) | |||
{{#ev:youtube|4u6A40QTWVI}} | |||
* Eine Legierung ist eine stabile "Mischung" verschiedener Metalle. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
{{Box-spezial | {{Box-spezial | ||
| Zeile 723: | Zeile 738: | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#070">'''Das war es schon für heute | |Titel=<span style="color:#070">'''Das war es schon für heute'''</span> | ||
|Inhalt= | |Inhalt= | ||
Schönen 1. Mai! - Bis nächste Woche :) | |||
|Farbe= #070 | |Farbe= #070 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
Version vom 1. Mai 2020, 16:15 Uhr
Arbeitsauftrag Chemie1
Arbeitsauftrag Chemie2 (verpflichtend)
Arbeitsauftrag Chemie3 (verpflichtend)
Arbeitsauftrag Chemie4 (verpflichtend)
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie5 (verpflichtend)
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Arbeitsauftrag Chemie6 (Wiederholung)
Arbeitsauftrag Chemie7
Arbeitsauftrag Chemie8
Arbeitsauftrag Chemie9