Benutzer:Thomas Lux/Test Q11-Struktur: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(Bild-Links ergänzt) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 4: | Zeile 4: | ||
|Titel=<span style="color:#607">'''Ergebnisse der Hausaufgabe'''</span> | |Titel=<span style="color:#607">'''Ergebnisse der Hausaufgabe'''</span> | ||
|Inhalt= | |Inhalt= | ||
[[Datei: | [[Datei:Met1_Kollage_MetalleImHaushalt.jpg]] | ||
Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner. <br> | Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner. <br> | ||
Ihr solltet euch Gedanken machen, warum manche Gegenstände aus Metall sind und kein anderes Material zur Herstellung verwendet wurde. Eine Eigenschaft wurde sehr häufig hervorgehoben, auch wenn ihr es teilweise unterschiedlich ausgedrückt habt: Die "Stabilität" von Metallen. In dieser und der nächsten Einheit, möchte ich mit euch versuchen zu klären, woher diese "Stabilität" kommt.<br> | Ihr solltet euch zusätzlich zu den Bildern auch Gedanken dazu machen, warum manche Gegenstände aus Metall sind und kein anderes Material zur Herstellung verwendet wurde. Eine Eigenschaft wurde sehr häufig hervorgehoben, auch wenn ihr es teilweise unterschiedlich ausgedrückt habt: Die '''"Stabilität"''' von Metallen. In dieser und der nächsten Einheit, möchte ich mit euch versuchen zu klären, woher diese "Stabilität" kommt.<br> | ||
<span style="color:#60F">Achtung: "Stabilität" steht im Moment noch in Anführungszeichen, weil dieser Begriff eigentlich ziemlich ungenau ist: Wenn ihr einen Eisennagel und ein Stück Plastik im Garten vergrabt, werdet ihr nach einem Jahr den Nagel ziemlich verrostet wiederfinden, während das Stück Plastik sich kaum verändert hat. '''Chemisch''' betrachtet sind viele Metalle nämlich überhaupt nicht stabil.</span> | <span style="color:#60F">Achtung: "Stabilität" steht im Moment noch in Anführungszeichen, weil dieser Begriff eigentlich ziemlich ungenau ist: Wenn ihr einen Eisennagel und ein Stück Plastik im Garten vergrabt, werdet ihr nach einem Jahr den Nagel ziemlich verrostet wiederfinden, während das Stück Plastik sich kaum verändert hat. '''Chemisch''' betrachtet sind viele Metalle nämlich überhaupt nicht "stabil".</span> | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 19: | Zeile 19: | ||
|Inhalt= | |Inhalt= | ||
Das, was wir gerade besprechen, ist übrigens ein Haupt-Anliegen der Wissenschaft "Chemie": Sie versucht Zusammenhänge herzustellen zwischen dem '''Aufbau von Stoffen''' und den '''Eigenschaften''', die diese Stoffe haben.<br> | Das, was wir gerade besprechen, ist übrigens ein Haupt-Anliegen der Wissenschaft "Chemie": Sie versucht Zusammenhänge herzustellen zwischen dem '''Aufbau von Stoffen''' und den '''Eigenschaften''', die diese Stoffe haben.<br> | ||
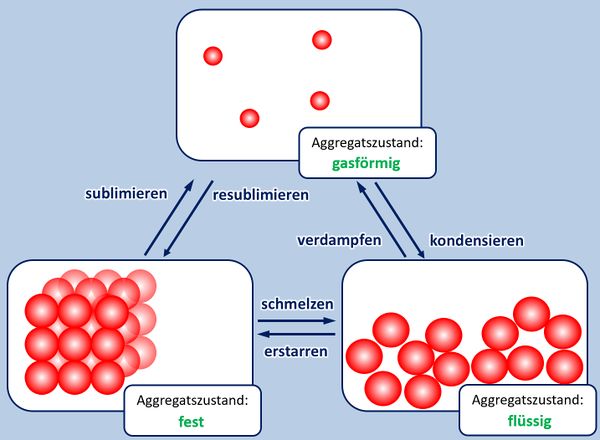
Einen solchen wichtigen Zusammenhang habt ihr nun schon oft gehört und in der letzten Einheit vor den Osterferien noch einmal intensiv besprochen: Es gibt einen Zusammenhang zwischen dem Aggregatszustand eines Stoffes und den Anziehungskräften der im Stoff enthaltenen Teilchen. Die Anziehungskräfte wiederum hängen eng mit dem Aufbau der Teilchen zusammen. Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest | Einen solchen wichtigen Zusammenhang habt ihr nun schon oft gehört und in der letzten Einheit vor den Osterferien noch einmal intensiv besprochen: Es gibt einen Zusammenhang zwischen dem Aggregatszustand eines Stoffes (bei Raumtemperatur) und den Anziehungskräften der im Stoff enthaltenen Teilchen. Die Anziehungskräfte wiederum hängen eng mit dem Aufbau der Teilchen zusammen.<br> | ||
Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest die kleinen, wie z.B. O<sub>2</sub>, gasförmig) | |||
* Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | * Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln! | ||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 45: | Zeile 46: | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
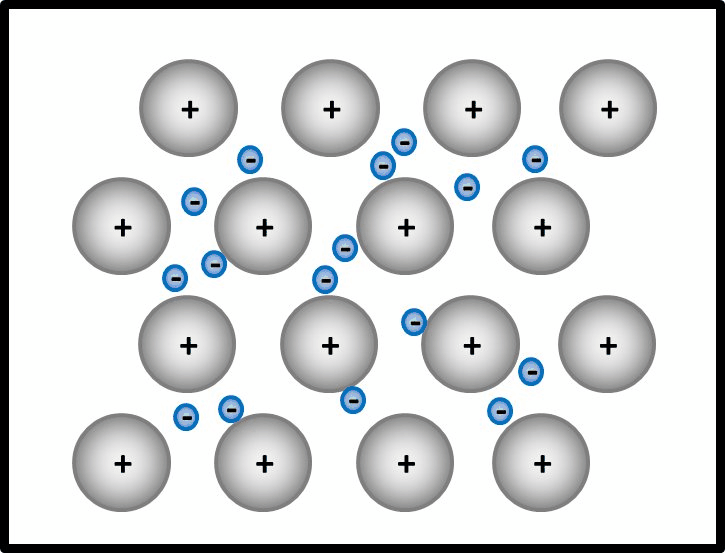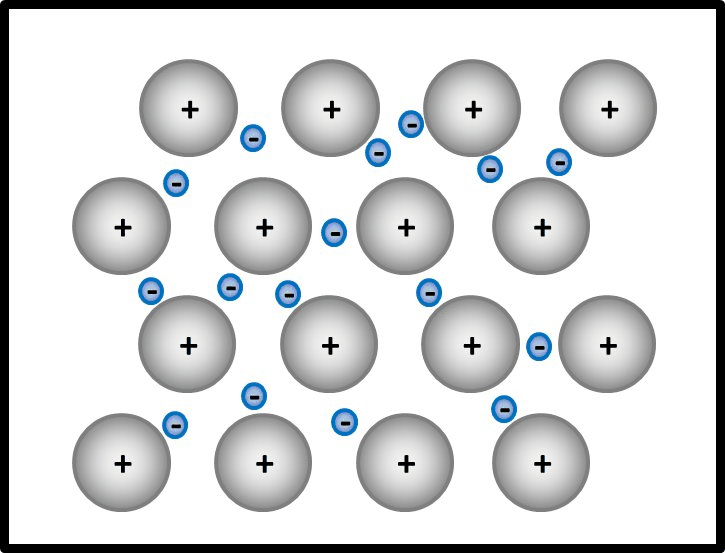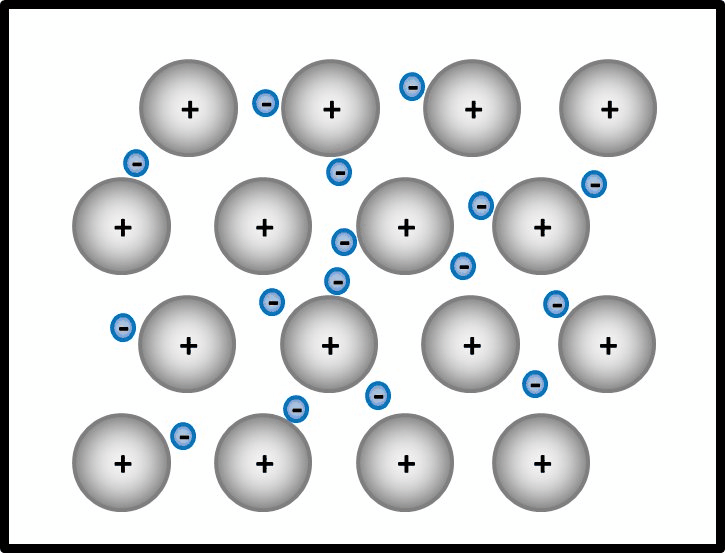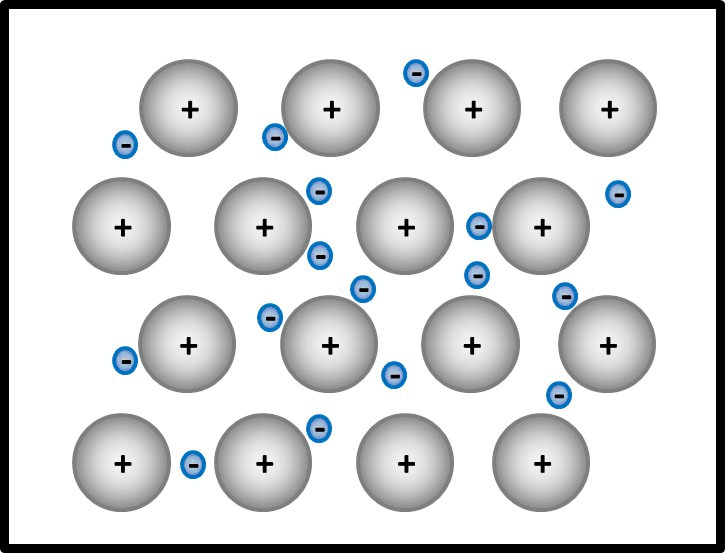
[[Datei: | [[Datei:Met1_IonenbildungBeiSalzen.jpg]] | ||
Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | Bei der Bildung von Salzen reagiert ein '''Metall '''mit einem '''Nichtmetall'''. Das Metall gibt Elektronen ab und es entstehen '''positiv geladene Metall-Kationen'''. Das Nichtmetall nimmt Elektronen auf und es entstehen '''negativ geladene Anionen'''. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen. | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | <br> | ||
| Zeile 63: | Zeile 64: | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Met1_IonenbildungUnmöglich.jpg]] | ||
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, '''Elektronen abzugeben''', um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese '''Elektronen aufnehmen''' können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.<br> | In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, '''Elektronen abzugeben''', um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese '''Elektronen aufnehmen''' können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.<br> | ||
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden | ||
| Zeile 83: | Zeile 84: | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Met1_AtombdgUnmöglich.jpg]] | ||
Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.<br> | Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.<br> | ||
Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen. | Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen. | ||
Version vom 26. April 2020, 09:08 Uhr
Arbeitsauftrag 8
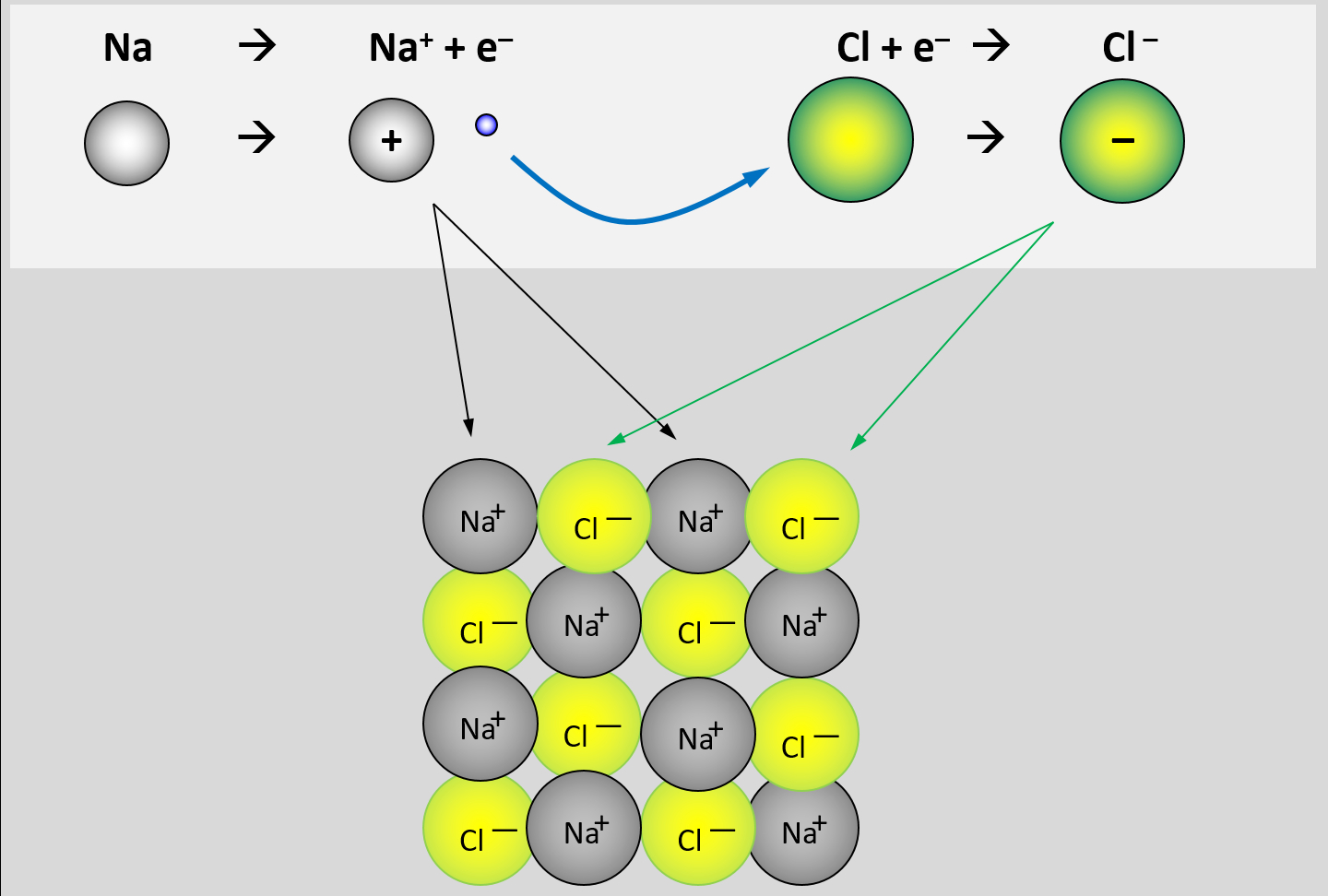 Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
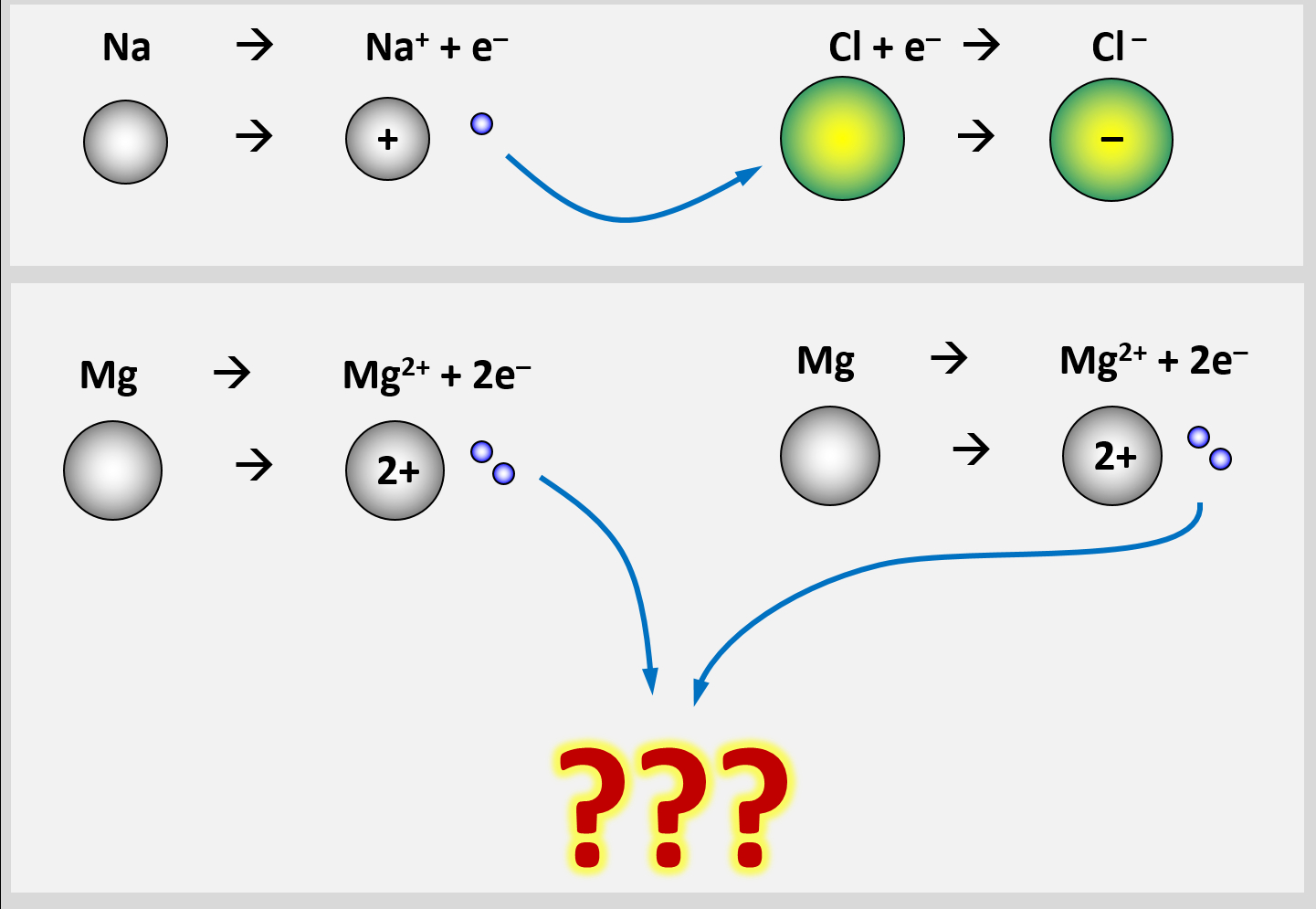 In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden
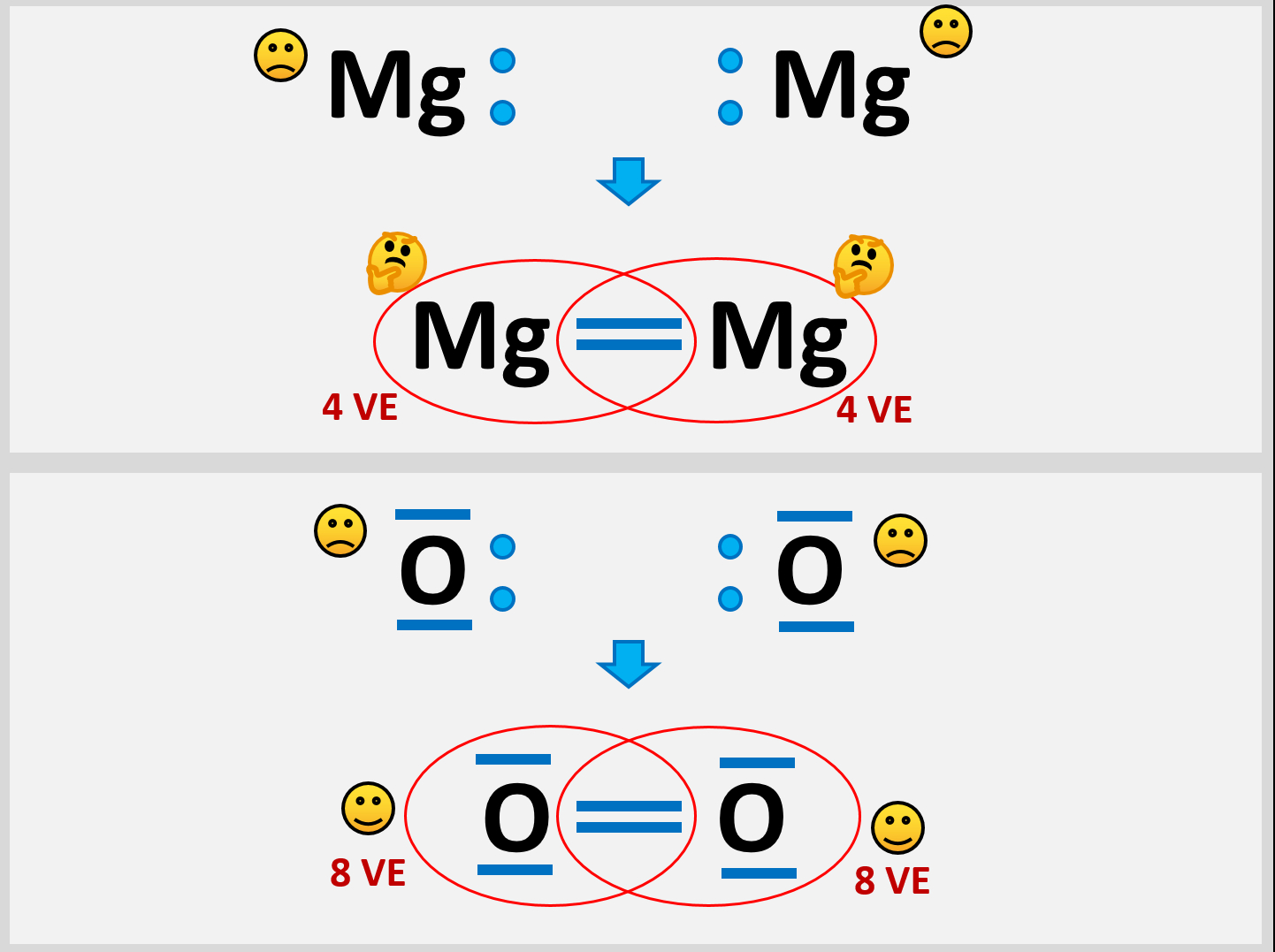 Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.
Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.
Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen.
Jeder sucht sich einen Partner, es bilden sich also Pärchen. Alle können so mit den zur Verfügung stehenden Bällen spielen.
Man spielt Fußball! - Was hat das jetzt mit der Metall-Bindung zu tun? Ich gebe zu, das Beispiel ist jetzt nicht der Wahnsinn, aber soooo schlecht ist es auch nicht: Beim Fußball-Spielen teilen sich viele Menschen einen Ball. Weil alle spielen wollen, sorgt der Ball dafür, dass alle auf dem Spielfeld bleiben.
Ja! Metalle bestehen nach dieser Vorstellung aus positiv geladenen Teilchen: Den Atomrümpfen, die durch die Abgabe von Valenzelektronen entstanden sind. Und aus negativ geladenen Teilchen: Den frei beweglichen Elektronen, auch Elektronengas genannt. Es sind hier also viele Ladungen im Spiel, die zu sehr hohen Anziehungskräften führen, ganz ähnlich wie bei den Salzen